文献荐读|胡兴胜教授:小细胞肺癌的研究进展
时间:2023-07-20 13:14:53 热度:37.1℃ 作者:网络
01 研究背景
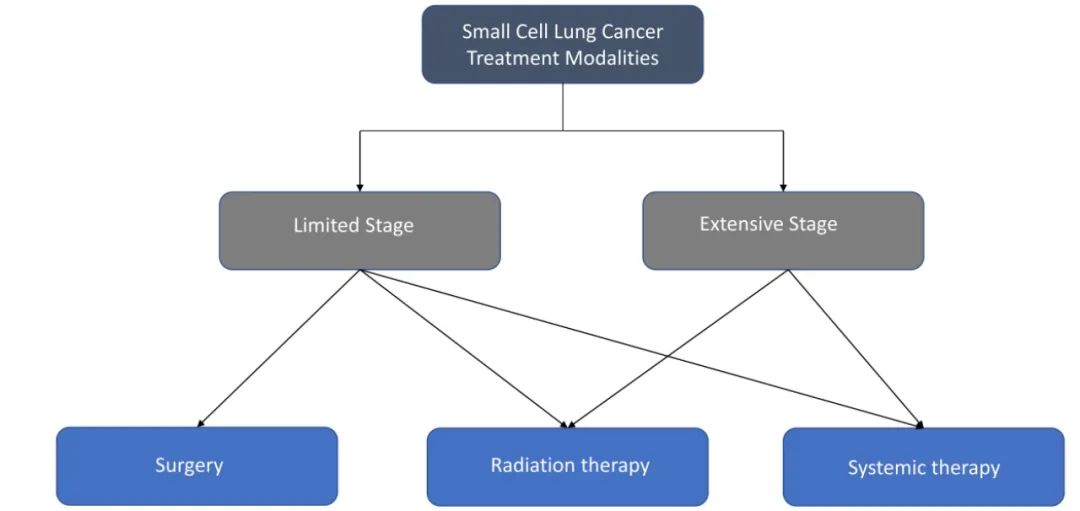
小细胞肺癌(SCLC)是一种顽固性癌症,目前迫切需要新型治疗方式和临床前研究阐明其快速耐药的分子机制。LS-SCLC指影像学显示局限于一侧胸腔或能接受放疗的疾病,而ES-SCLC指超出局限期的疾病。局限期疾病主要的治疗方式是同步放化疗;广泛期疾病的主要治疗方式为系统治疗,并可提供姑息性放疗。30多年来,铂-依托泊苷一直是SCLC的一线治疗方式。由于SCLC预后不良和治疗方式单一,NCI指定其为迫切需要研究的顽固恶性肿瘤,需要开发新的治疗方式和临床前模型、了解其快速耐药机制。
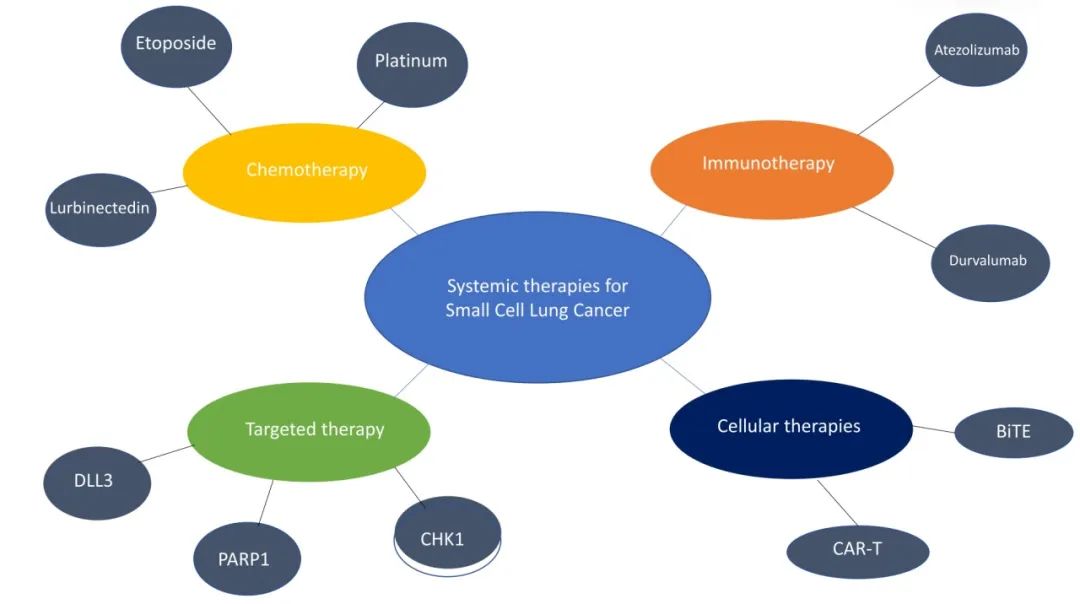
近期人们对SCLC的认识有了许多进展,并进一步发展了新的治疗方法,改善了患者预后。研究发现一线化疗联合免疫治疗(使用阿替利珠单抗和得瓦鲁单抗)可提高初治ES-SCLC的生存率。本文回顾了近期SCLC分子分型方面的新突破,以及转录抑制剂、细胞周期调节抑制剂等免疫治疗、针对DLL3的靶向治疗、细胞治疗在内的各种系统治疗的最新进展。
02 研究内容
一 SCLC的亚分类
传统上SCLC被认为是一种同质性恶性肿瘤,但近期对SCLC的分型采取了进一步研究。目前基于3种主要转录因子ASCL1、NEUROD1和POU2F3的表达水平,SCLC分别被分为SCLC- A、SCLC- N和SCLC- P以及上述3种转录因子均低表达并具有炎症基因特征的SCLC- I亚型。虽然亚型间不存在独特的差异且亚型不与特定的分子改变(如p53, Rb或SOX)共分离,但其仍存在许多特征和共同特点。例如,与SCLC-P相比,SCLC-A和SCLC-N具有更多的神经内分泌表型,也有高神经内分泌标志物和高DLL3,这提示针对DLL3的靶向治疗可能对SCLC-A和SCLC-N亚型活性更强,但这仍需要验证性研究来证实。此外,SCLC-A亚型中MYC和NOTCH表达增加,小鼠研究和人体试验的数据表明SCLC-A亚型相比其他亚型更受益于Aurora Kinase A抑制剂的治疗。与其他亚型相比,SCLC-I亚型有涉及免疫检查点和人类白细胞抗原的独特的基因特征,且其上皮-间质转化(EMT)倾向性最高,表明SCLC-I更容易早期转移并产生治疗耐药性。scRNA-seq显示与铂敏感的SCLC相比,耐药的SCLC中I亚型增加。
此外,虽然初治SCLC模型中HLA普遍表达阴性,但顺铂复发模型特别是在SCLC-I亚群中一致获得了MHC II类基因的表达。值得注意的是,治疗耐药的出现并不仅仅是因为SCLC-I 亚型的出现,也可能是由于所有亚型的SCLC均具有更高的肿瘤突变负荷(TMB)。
SCLC的分子分型很快就可以指导临床治疗选择:基于PDX模型的体外研究表明,与其他亚型相比,SCLC-P对IGF1R耗竭表现出独特的敏感性;而对IMpower133试验数据进行亚型特异性分析时,SCLC-I显示出更高的总生存率趋势,表明其可能从免疫检查点阻断中获益更多。
二 免疫治疗
最近,基于CASPIAN和IMpower133研究的结果,在ES-SCLC的铂-依托泊苷一线化疗中添加PD-L1免疫检查点抑制剂阿替利珠单抗和德瓦鲁单抗可以有效改善患者生存。2022年举行的欧洲医学学会 (ESMO)会议上,一项最新研究表明,化疗联合免疫治疗组的3年生存率比单独化疗组有所提高(17.6% vs 5%;P = 0.0003),几乎高出了三倍。虽然纳武单抗作为二线或维持治疗没有显示出令人鼓舞的结果,但ECOG-ACRIN EA5161试验显示,纳武单抗联合铂-依托泊苷的一线治疗可延长PFS(5.5月vs. 4.6月; p = 0.012) 、OS (11.3月 vs. 9.3月; p = 0.047) 。然而,与CASPIAN和IMpower133研究的结果相似,mOS 和PFS增加的绝对值是适度的。
2019年,基于KEYNOTE-028和KEYNOTE-158研究的结果,PD-1抑制剂帕博利珠单抗作为转移性SCLC的二线治疗获得了FDA 的加速批准。III期KEYNOTE-604试验显示铂-依托泊苷中联合帕博利珠单抗一线治疗可改善PFS(4.5月vs 4.3月;p = 0.0023)和mOS(10.8月vs. 9.7月;p = 0.0124)。虽然在联合组与单独化疗组中,估计的2年OS也延长了(22.5% vs 11.2%;p = 0.0164),但未达到预定的有效性界值0.0128。因此,帕博利珠单抗的三线治疗适应症在2021年3月被制造商自愿撤回。对于前线免疫治疗研究中不同结果的一个可能解释是,与CASPIAN和IMpower133相比,KEYNOTE-604患者基线存在更多的脑转移、更高的体能状态评分比例、更大的肿瘤体积、更高的LDH和更多的远处转移位点(≥3个)。
三 细胞周期调节抑制剂
TP53和RB1基因的普遍缺失表明细胞周期失调在SCLC的发展中起着关键作用,导致了G1/S检查点活性的缺失并使肿瘤细胞依赖于G2/M检查点的DNA修复作用。因此,细胞周期调节因子如WEE1和Aurora Kinase A/B成为了感兴趣的研究目标。DNA损伤后,WEE1抑制CDK1导致G2检查点阻滞,直到受损的DNA被修复。通过抑制WEE1,肿瘤细胞在没有DNA修复的情况下继续分裂,最终导致细胞死亡。目前,许多使用WEE1作为SCLC患者单药或联合治疗的I/II期试验正在进行中。
Aurora Kinase A在细胞周期调节中起关键作用,因为它参与中心体功能、染色体排列和向G2/M的过渡。一种Aurora Kinase A抑制剂Alisertinib联合紫杉醇二线治疗SCLC的II期研究显示:与安慰剂+紫杉醇相比,Alisertinib联合治疗组的中位PFS获得改善(101 vs 66天;p = 0.038)。一种CDK4/6抑制剂曲拉西利(Trilaciclib)作为减少标准化疗的骨髓抑制的方法在ES-SCLC中进行了II期临床试验:在化疗和阿替利珠单抗治疗前接受曲拉西利的患者4级中性粒细胞减少的发生率和持续时间显著降低(1.9% vs 49.1%;P < 0.0001)。FDA于2020年2月批准了曲拉西利用于减少化疗引起的骨髓抑制。
四 细胞周期调节抑制剂
SCLC的另一个重要特征是DNA修复蛋白PARP1和CHK1的异常表达。在一项II期研究中,一种PARP1抑制剂Veliparib被添加到标准一线治疗方案铂-依托泊苷中,但OS或PFS中未能显示明显的益处。Berzosertib是一种ATR抑制剂,可抑制复制应激反应的激活,与拓扑替康联用在复发的SCLC中显示出良好的反应。一项研究初步表明,在铂耐药的SCLC中,Berzosertib治疗后肿瘤持续消退,ORR达到36%,达到主要疗效终点。此外,高神经内分泌分化是更好反应的预测标志物,可能是由于复制应激反应增强所致。
五 转录抑制剂
卢比替定(Lurbinectedin)通过与富含CG的区域共价结合并阻断DNA修复,导致RNA聚合酶II的阻滞和降解来抑制转录。由于SCLC是一种嗜转录肿瘤,卢比替定对其具有显著的抗肿瘤活性。此外,该药还可通过抑制基质重塑、肿瘤增殖和血管生成来影响肿瘤微环境(TME)。初始II期试验中,卢比替定的二线治疗ORR为35.2%,其安全性可控。III期ATLANTIS试验在铂耐药患者中将卢比替定联合阿霉素与环磷酰胺/阿霉素/长春新碱或拓扑替康联合用药相比,主要终点OS未达显著性水平,但次要终点 (PFS, ORR和DOR)倾向于卢比替定+阿霉素组。重要的是,本研究采用较低剂量的卢比替定(2.0mg/m2), 而FDA批准的剂量为3.2mg/m2。卢比替定组在3级及以上药物相关AE、AE导致的死亡和AE导致的治疗中断方面表现出更好的安全性。总体而言,尽管该研究没有满足预定的主要终点显著性标准,但结果仍很有希望,卢比替定仍被批准用于SCLC的二线治疗选择。
六 DLL3靶向治疗
Notch信号通路参与肺神经内分泌细胞的发育。DLL3是该途径的一种抑制性配体,在SCLC细胞中高度上调。因此,DLL3靶向治疗引起了人们极大的兴趣,目前多项试验正对此类药物进行开发。基于PDX的研究显示,与顺铂-依托泊苷相比,抗体-药物偶联物Rova-T有快速和持久的疗效,甚至化疗耐药或复发模型也显示出反应。但后续的临床试验如包括TRINITY、TAHOE和MERU均未能达到中期PFS和OS终点,且显示出高于预期的毒性发生率,如胸膜和心包积液渗出,最可能的解释可能是连接物过早裂解并释放PBD。目前Rova-T的开发已停止。尽管Rova-T的失败和ADC具有独特的副作用,ADC仍是一种有前途的癌症治疗方法,其独特的靶向肿瘤细胞表面特异性抗原的能力具有更高的特异性和效力。
针对DLL3的CAR-T疗法也在开发中,特别是以DLL3为靶点的遗传修饰的自体T细胞药物AMG 119。基于PDX的体外和体内研究均表明,AMG 119可有效根除DLL3阳性细胞并减少肿瘤平均体积,该药目前正在进行Ⅰ期试验。


