AFM:四川大学谢宇开发了一种基于核酸纳米材料的皮肤光损伤透皮给药系统
时间:2023-07-24 17:20:13 热度:37.1℃ 作者:网络
皮肤光损伤是由紫外线(UV)辐射引起的,是皮肤损伤的常见原因。在此,四川大学谢宇团队开发了一种用于皮肤光损伤局部治疗的透皮给药系统,该系统由四面体骨架核酸(tFNAs)和硫辛酸(LA)组成。tFNAs-LA(TLA)纳米复合材料表现出良好的生物相容性,以及抗氧化、抗细胞凋亡和抗炎能力。tFNA作为载体,促进TLA进入细胞和穿透皮肤,而负载的LA增强了抗氧化和抗炎能力。在光损伤的人真皮成纤维细胞(HDF)中,TLA促进增殖和迁移,同时抑制细胞凋亡激活和活性氧的产生。此外,TLA调节凋亡相关蛋白和NF-𝜿B信号通路,增加细胞分泌,同时抑制光损伤的高密度脂蛋白细胞的炎症反应。在体内实验中,局部应用TLA可促进光损伤皮肤的组织愈合,并调节炎症和胶原相关蛋白的表达。研究表明,TLA的透皮能力使皮肤光损伤的非侵入性治疗成为可能,这突显了使用基于核酸的经皮给药系统治疗皮肤病的潜力。该研究以题为“A Transdermal Drug Delivery System Based on Nucleic Acid Nanomaterials for Skin Photodamage Treatment”的论文发表在《Advanced Functional Materials》上。

为了提高皮肤光损伤的非侵入性治疗效果,通过合成纳米材料-药物复合体来构建一种新型的经皮给药系统。先前的研究已经确认四面体骨架核酸(tFNAs)是一种由特定核酸序列组成的纳米材料。tFNAs已被证明具有高的细胞内化率和强大的穿透真皮的能力。同时,tFNAs具有很高的生物相容性和可编辑性,可以作为小分子、多肽和siRNA的载体来改善自身的抗氧化、抗炎或其他特性。硫辛酸(LA)具有强大的抗氧化和抗炎特性,为细胞新陈代谢提供保护,并作为最有效的细胞氧化调节剂之一发挥作用。适用于治疗皮肤光损伤。然而,由于其水溶性、化学稳定性和光稳定性较差,阻碍了其生物利用度和应用。因此,tFNAs是一种理想的载药载体,可用于皮肤光损伤的治疗。本研究旨在构建一种经皮给药系统,并突出其在非侵入性治疗皮肤光损伤方面的潜力。通过将LA负载到tFNAs上形成tFNAs-LA(TLA)复合体,研究了TLA对光损伤的人真皮成纤维细胞(HDF)的影响,并在动物实验中观察了TLA对光损伤皮肤的渗透和作用。
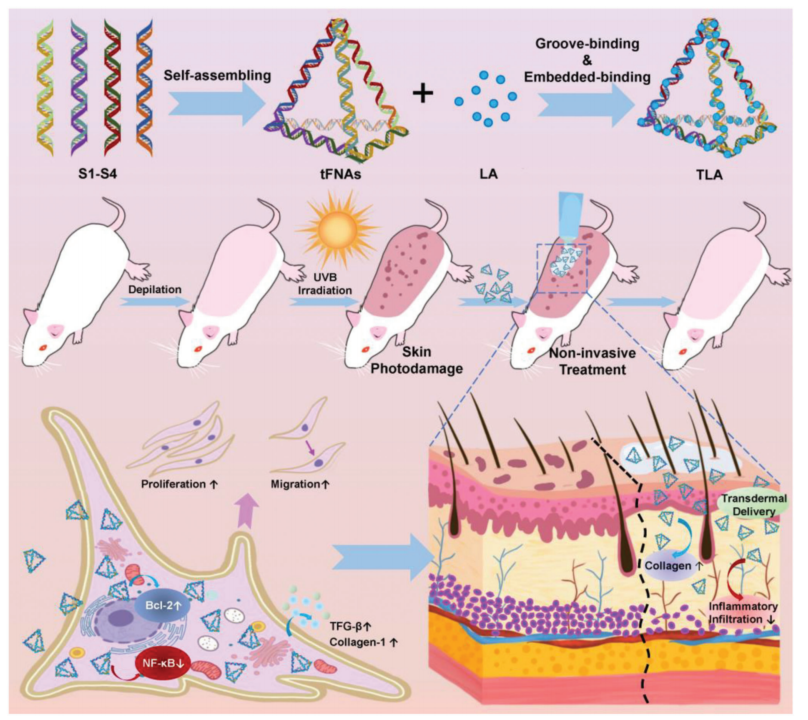
方案1.由TLA构建的透皮给药系统通过以非侵入性方式抑制炎症来帮助修复光损伤
【TFNAs和TLA的合成】
图1A给出了tFNAs和TLA的合成过程示意图。PAGE和高效毛细管电泳法检测tFNAs和TLA的成功合成。tFNAs分子呈现出典型的三角锥形结构,而TLA络合物则更接近球形结构。这种形态变化可能与小分子的负载有关。
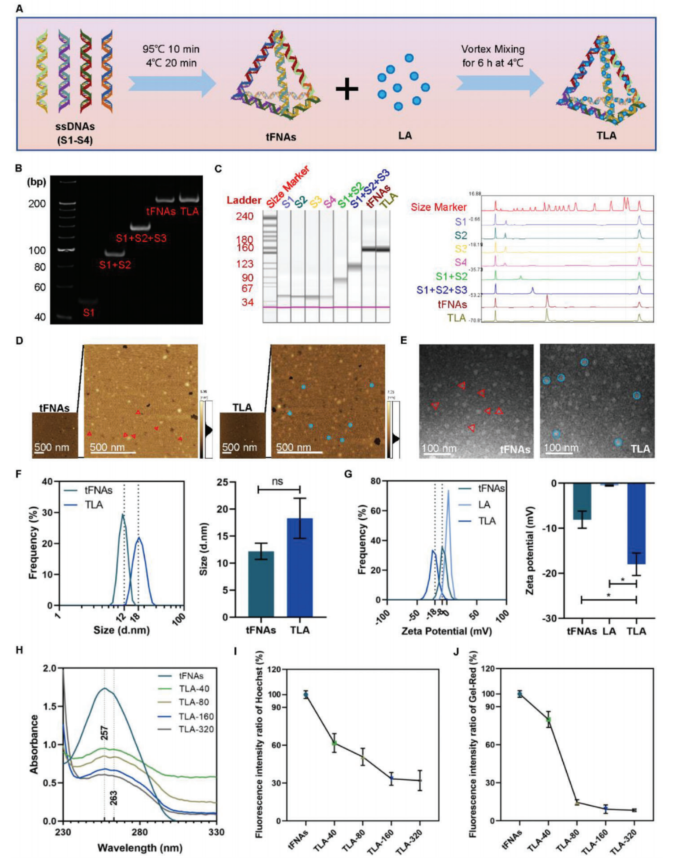
图1.TLA的合成与表征
【TLA的促增殖作用、细胞进入能力和促迁移作用】
皮肤真皮在紫外线诱导的皮肤损伤和修复中起着至关重要的作用。过去的研究表明,tFNAs可以促进细胞增殖,对大多数细胞没有细胞毒性。然而,仍有必要验证TLA对HDF细胞的细胞毒性。通过CCK-8实验,发现tFNAs和TLA都能促进正常HDF细胞的增殖。而不同tFNAs/LA比例(tFNAs/LA:1/80、1/160或1/320)的TLAs对正常HDF细胞增殖活性的促进作用无显著差异。鉴于TLA-160在载药效率方面的优势,该浓度比被选择用于随后的体外和体内实验。
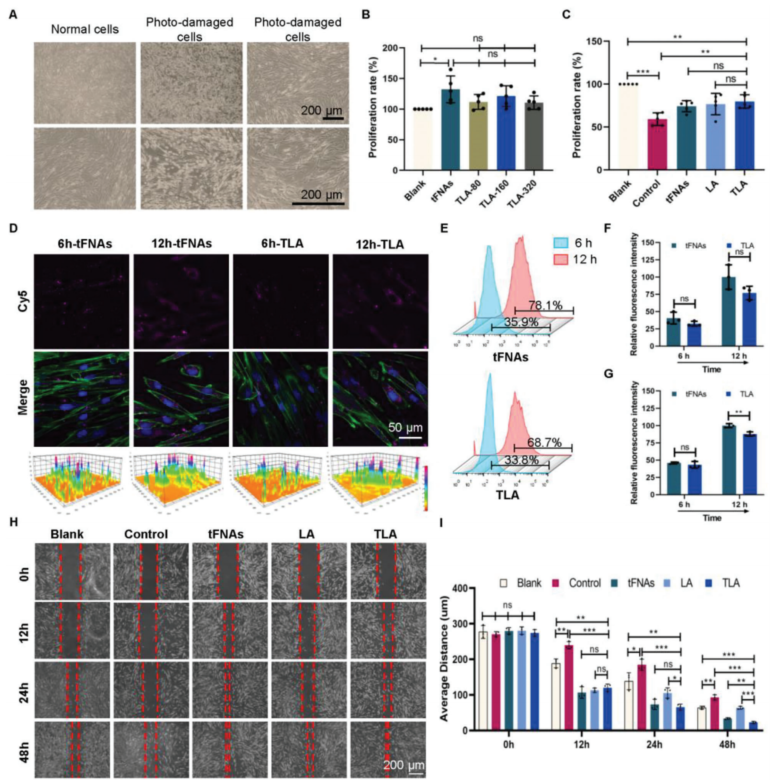
图2.HDF细胞的光损伤模型以及TLA在HDF细胞的增殖、细胞摄取和迁移中的作用
【TLA通过抑制ROS的产生和调节细胞凋亡相关蛋白来减少细胞凋亡】
皮肤光损伤触发大量ROS和自由基的释放,导致表皮和真皮细胞的氧化应激,这进一步影响细胞并激活细胞凋亡。流式细胞仪分析显示,在UVB诱导的光损伤后,由于氧化应激,细胞凋亡显著增加。而TLA处理能有效抑制细胞凋亡的激活。UVB辐射可以促进大量ROS的产生,改变细胞氧化还原动态平衡,诱导氧化应激,并激活细胞凋亡。TLA的抗氧化作用使细胞产生的ROS接近正常水平。
为了解释TLA的抗细胞凋亡作用,分析了细胞凋亡相关蛋白的表达变化。光损伤细胞中MAPK蛋白的表达被激活,这与ROS的大量产生密切相关。MAPK信号通路的激活进一步诱导了ROS的产生和细胞的凋亡,影响了凋亡相关蛋白的表达,并促进了NF-𝜅B信号通路的激活。TLA治疗可以减轻MAPK的表达,这可能也与其清除ROS的抗氧化作用有关。提示TLA对细胞凋亡相关蛋白的表达具有良好的调节作用。
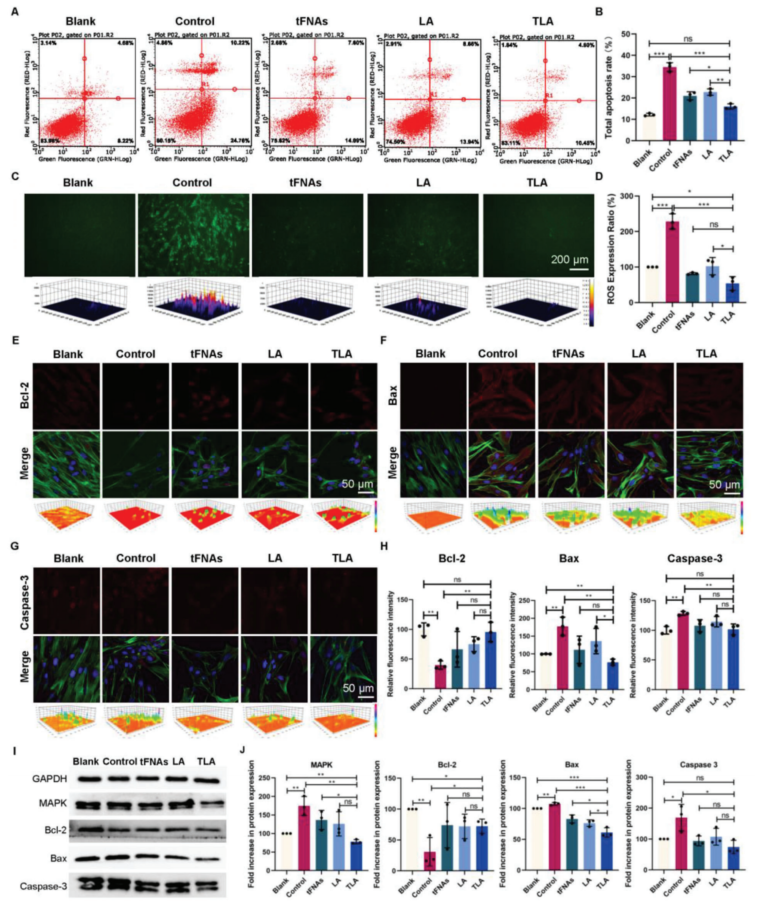
图3.光损伤的HDF细胞中ROS介导的细胞凋亡和凋亡相关蛋白的表达
【TLA通过抑制NF-κB信号通路抑制炎症反应和促进细胞分泌】
NF-κB是一种氧化还原敏感的转录因子,可调节多种炎症细胞因子的表达,并参与炎症级联效应。正常情况下,NF-κB通过与IκB结合形成非激活的复合体。然而,在光损伤细胞中,细胞内ROS水平显著增加,导致IκB蛋白的泛素化和降解,NF-κB的释放,以及其磷酸化蛋白p-NF-κB的产生。事实上,UVB辐射诱导的光损伤可以激活HDF细胞中的NF-κB信号通路。经TLA处理后,NF-κB和p-NF-κB的表达下调,IκB的表达增加。这可能与TLA抑制细胞内ROS的产生,从而抑制I-κB的降解有关。因此,可以认为TLA可以抑制光损伤细胞中NF-κB信号通路的激活。同时,tFNAs也显示了对NF-κB信号通路的调节作用。然而,LA对NF-κB信号通路的调节没有明显的作用。
胶原-1是皮肤中含量最丰富的胶原蛋白,有助于形成胶原纤维,确保皮肤弹性。光损伤造模后,胶原-1蛋白表达明显减少,与NF-𝜅B和MAPK信号通路激活引起的炎症因子增加密切相关。TLA治疗后胶原-1的表达显著增加,有利于光损伤皮肤的恢复。
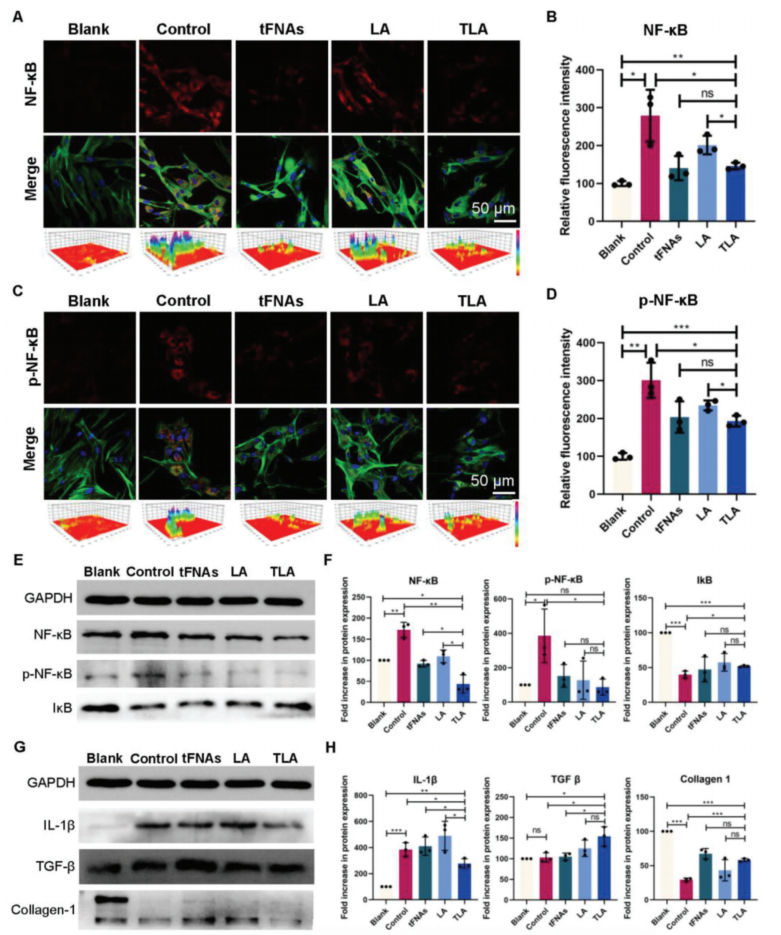
图4.光损伤HDF细胞的炎症反应和细胞分泌相关蛋白的表达
【TLA促进光损伤皮肤的组织修复,调节皮肤炎症和胶原蛋白的表达】
为了研究TLA透皮给药系统对皮肤光损伤的透皮能力和治疗效果,选用对紫外线辐射敏感的Balb/c小鼠建立了紫外光损伤模型。在经历了光损伤建模和经皮给药治疗后,记录了Balb/c小鼠的皮肤状况。正常情况下,小鼠皮肤光滑、平整、有弹性,没有明显的红肿或疤痕。光损伤皮肤变红、变少弹性、充血、红斑、结皮。局部应用药物乳膏混合物后,tFNAs和LA组的皮肤外观均有轻微改善,而TLA组的改善更为显著。TLA组结痂消失,皮肤弹性明显恢复,皮肤红斑明显改善,皮肤损伤愈合迅速。通过组织学荧光染色评价tFNAs和TLA的透皮特性。结果表明,tFNAs和TLA主要分布在毛囊和皮肤附属物中。TLA被发现具有与tFNAs类似的强大的皮肤穿透能力,使其能够顺利进入皮肤真皮。此外,经TLA治疗后,真皮表层厚度明显减少,真皮中炎性细胞浸润减少,TLA处理对光损伤皮肤组织的修复效果最好。
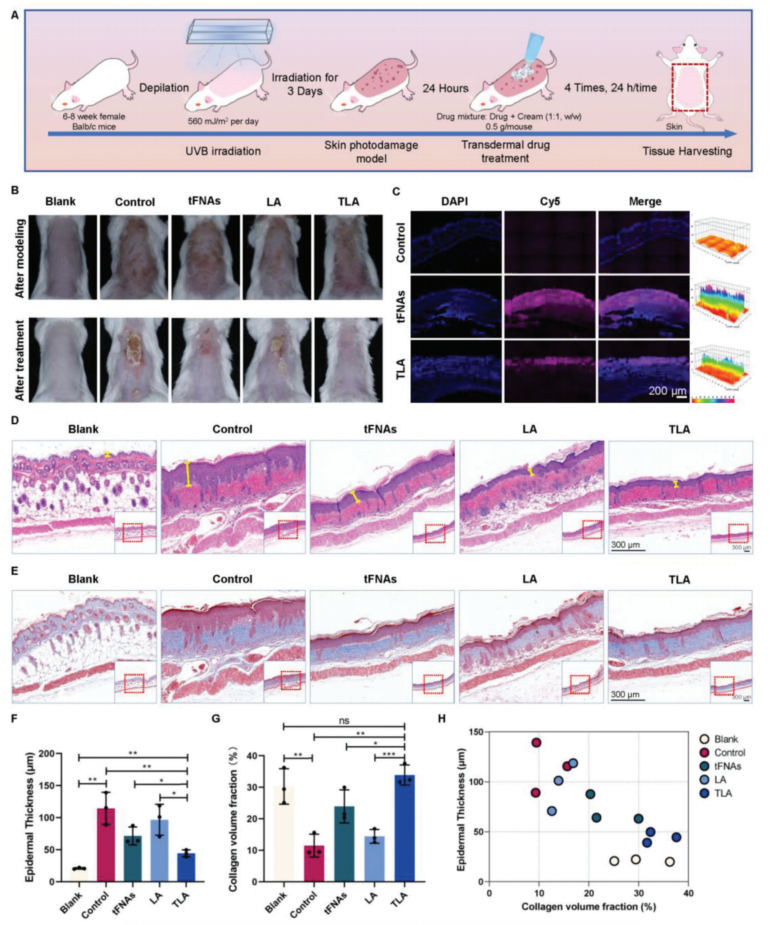
图5.透皮给药治疗皮肤光损伤的TLA
组织学蛋白表达分析表明,tFNAs对光损伤皮肤蛋白表达的调节作用较弱,LA对胶原-1的表达有一定的调节作用,而TLA对这三种蛋白的表达均有较强的调节作用。TLA治疗后,光损伤皮肤炎症和胶原蛋白表达基本恢复到正常水平这提醒人们,TLA通过调节NF-𝜅B信号通路和胶原相关蛋白的表达来帮助修复光损伤的小鼠皮肤。
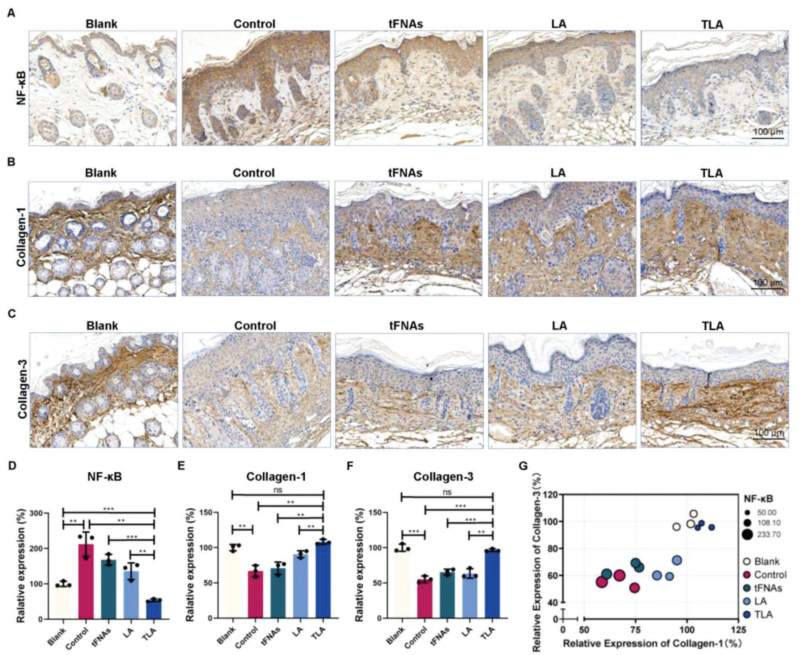
图6.炎症和胶原蛋白产生相关蛋白的免疫组织化学染色
【小结】
综上所述,该研究通过将LA负载到tFNAs上,开发了一种新的透皮给药系统TLA,该系统具有较高的细胞内化和皮肤穿透能力。局部应用TLA对细胞和皮肤都有抗炎和促进修复的作用,使皮肤光损伤的非侵入性治疗成为可能。TLA通过促进细胞增殖和迁移,提高光损伤的HDF细胞的活性。同时,TLA通过抑制ROS的产生,调节MAPK信号通路和凋亡相关蛋白,从而抑制细胞的凋亡激活。通过抑制NF-𝜅B途径的激活,TLA减轻炎症,促进胶原相关蛋白的表达。在涉及体内光损伤皮肤治疗的实验中,TLA施加皮肤渗透性,通过经皮给药影响表皮和真皮。TLA的主要作用是抑制炎症,促进胶原合成,表现为光损伤小鼠皮肤的表面变化和组织学修复。
该研究认为,负载小分子的新型核酸纳米药物TLA可以对皮肤光损伤的局部修复产生积极的影响。这为UVB皮肤损伤的治疗提供了新的见解。利用纳米材料的皮肤渗透性,可以与其他药物一起构建类似于TLA的透皮给药系统。这种方法也有望用于治疗其他皮肤病。TLA对皮肤光损伤的调节作用有望成为一种新的临床应用策略。然而,TLA在体外和体内治疗光损伤中减轻炎症和促进胶原含量的具体机制仍有待阐明。未来的研究将集中在通过进一步的实验来探索TLA治疗皮肤光损伤的机制。
原文链接:
https://doi.org/10.1002/adfm.202303580


