类器官技术,临床筛选药物的模型“新宠”
时间:2022-12-24 18:01:18 热度:37.1℃ 作者:网络
来源:小桔灯网
近年来,类器官技术因具有成本低、时间短、生理相关度更高等优势而备受青睐,不仅走进了国家药监局的指导性文件,更成为国际顶级医学期刊的座上宾。
去年11月,国家药品监督管理局药品评审中心(Center for Drug Evaluation,NMPA)就发布了《基因治疗产品非临床研究与评价技术指导原则(施行)》在内的两份基因治疗指导文件。其中明确了类器官模型可作为替代性模型,也为基因治疗和基因修饰细胞治疗产品提供了可参照建议。
2022年6月《中国癌症防治杂志》发表了一篇专家共识,即《类器官药物敏感性检测指导肿瘤精准治疗临床应用专家共识 (2022年版)》。共识的发布意味着类器官技术的临床应用也在快速成熟,这让许多耐药性高和罕见性的病以及有“同病异治”需求的肿瘤患者将得到精准用药。
01
“一物生万物”之HUB类器官
我们知道,药物研发会经历从临床前到临床阶段再到市场批准这样的一个过程,而临床的转化效率不到10%,主要原因在于临床前使用的测试模型与临床相关度偏低。
而类器官是能忠实体现原组织生理学的体外技术,可为药物开发和组织工程等应用提供快速且经济高效的模型。其原理是将患者来源的健康组织或新鲜肿瘤组织经体外三维细胞培养后建立的与患者体内基因形态、结构形态和生理特性高度相似的一种立体模型。HUB技术的类器官具备三个特征即临床相关、3D培养、纯体外模型,也就是说从开始建立到后续的扩增都是在培养皿或培养板中进行的。虽不是真正意义上的人体器官,但其能在结构和功能上模拟真实器官,因此“类器官”也常被称为“微器官”。
HUB类器官模型是由荷兰的Hans Clevers教授团队建立。而在临床前肿瘤CRO赛道中,只有冠科生物获得了HUB的独家授权、是全球唯一可在服务中开发和使用HUB成体干细胞衍生类器官。

来源:冠科生物
类器官的细胞来源不同会造就应用之间的关键差别,这在肿瘤研究和药物研发方面表现的尤为突出。HUB技术开发的肿瘤类器官主要是上皮瘤药物研发唯一可用的临床相关类器官模型,HUB肿瘤类器官技术真正实现了“将患者带入实验室”。
去年科技部下发的《关于对“十四五”国家重点研发计划6个重点专项2021年度项目申报指南征求意见的通知》中,把“基于类器官的恶性肿瘤疾病模型”列为“十四五”国家重点研发计划中首批启动重点专项任务;并且,中国CDE也首次在《基因治疗和细胞治疗验证指南》中将类器官纳入基因治疗产品的非临床药理学研究。在产业端,恒瑞医药、百济神州等已纷纷将类器官技术应用到新药研发中。可见类器官模型已经成为主流,类器官技术的发展必将给制药和精准医疗带来巨大变革。
02
类器官的“妙手”
我们知道,临床前肿瘤药物研发都是在细胞系中观察药效并确定潜在的抗癌药物,然后过渡到PDX来研究体内的药效及安全性。但因为肿瘤细胞系在体外培养环境中无法保留原肿瘤的遗传特性和肿瘤微环境,且肿瘤细胞系对药物的耐受性较低,容易出现凋亡,所以也存在一定局限性。虽然PDX模型对肿瘤有代表性,但其培养周期及检测效应较长,且不太适用于高通量检测,而类器官技术避开了细胞系和PDX模型的一些弊端,且肿瘤类器官的药物敏感性检测与配对患者的异质性更高。
OrganoidBaseTM是冠科生物开发的全球最大商业化人源肿瘤类器官模型数据库,涵盖了PDX来源的肿瘤类器官(PDXO)模型,以及患者来源的肿瘤类器官(PDO)模型。现已有近600个模型,并且在持续扩充中,这个数据库可以选择出最具临床相关性的3D体外模型,用以完善肿瘤药物研发和肿瘤免疫学项目。

来源:冠科生物
冠科生物独特的类器官体外临床试验平台具备高度临床转化性、高通量重复性和结果精准性特征。其优势主要体现在以下五个方面:
▸ 平台可同时运行同一患者肿瘤组织和健康组织来源的类器官,能快速检测药物疗效和药物副作用;
▸ 生物库中每个样本的遗传背景和基因表达都是已知的,便于客户根据研究需求进行模型匹配。
▸ 作为体外模型扩展性强,在384板孔的高通量筛选中可同时选中主要候选药物,便于快速识别目标患者人群和和早期患者分层。
▸ 可定量评价多个模型和超过15种适应症的化合物疗效,概括患者人群异质性;
▸ 可同时检测多种药物联合策略,以确定最佳剂量。
冠科生物的类器官技术真正彰显了“问渠那得清如许,为有源头活水来”的内涵。2019年发表在《The Scientist》的一篇名为《Patient-derived organoids model treatment response of metastatic gastrointestinal cancers》的论文的研究结果表明,比较了结直肠癌患者的类器官和临床反应,结果相当惊人,对阴性结果的预测达到100%, 阳性结果的预测达到90%。
03
冠科生物类器官助力临床试验
一位行业大家说过,制药听起来复杂,其实就是简单的两件事:一是理解疾病发生和发展背后的生物学机制;二是找一个干预手段。无论是在肿瘤药物研发与转化医学或是在肿瘤免疫学中的应用中,类器官技术其实都是在寻找一种生物学的干预手段,前者是去干预肿瘤,而后者是去干预免疫系统。
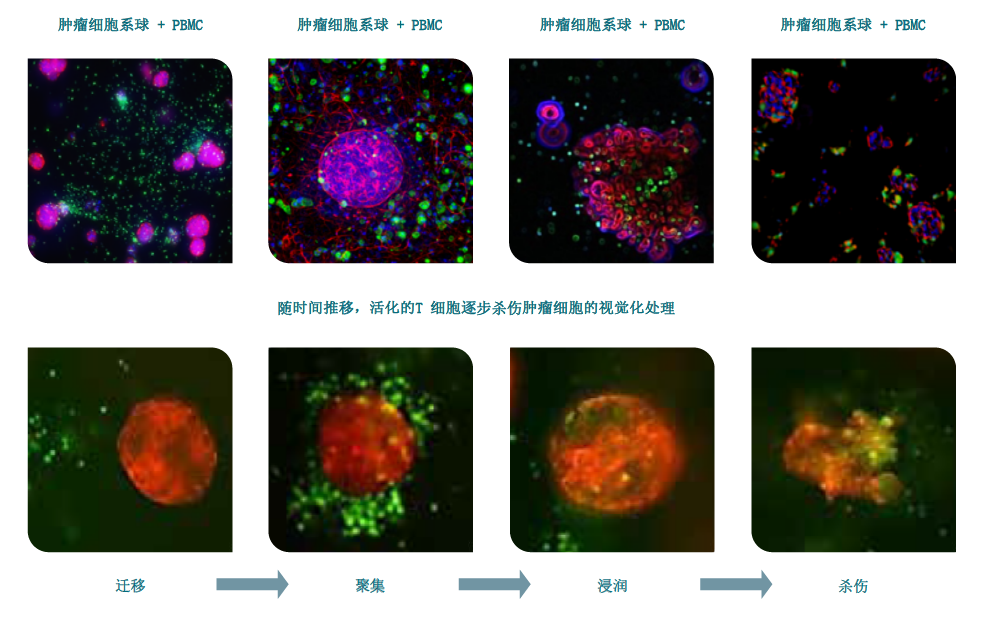
如今,用类器官进行免疫治疗的研究与验证也越来越流行。冠科生物拥有经过验证的同源肿瘤细胞模型和小鼠肿瘤同种移植模型集合,人源化基因工程小鼠模型(GEMM)的组合数量持续增长,可以帮助客户改进肿瘤免疫类候选药物。其全面的体外检验平台,涵盖了核心免疫表型分析、功能分析和肿瘤微环境调控,不但能够满足客户对下个阶段药物开发的需求,还帮助客户节省了大量摸索自配时间。比如,冠科生物建立的肿瘤类器官与PBMC中的外周免疫细胞共培养技术,可通过对T细胞的启动激活、T细胞向肿瘤的迁移、渗透以及识别、杀伤等过程的深入研究来了解肿瘤与免疫系统间的作用机制,从而进行建模研究整个肿瘤免疫周期中的特定问题。这些模型可以通过共培养产生的肿瘤反应性T细胞测试肿瘤患者在不同治疗阶段对免疫治疗的敏感性,尤其是对最初对免疫检查点疗法有反应但最终复发的患者来说,其复发前后的肿瘤活检产生的类器官与血液共培养技术或能对复发的潜在原因进行分析,重现肿瘤相关炎症和癌变过程,从而评估免疫调节结果及免疫治疗反应。
今年四月,冠科生物与HUB研究院联合发表于《Nature Cancer》上的一篇题为《Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR × LGR5 bispecific antibody with efficacy in epithelial tumors》的文章引起热议。来自冠科生物的研究人员使用癌症患者的类器官对500多个双特异型抗体进行高通量筛选,从中发现了名为MCLA-158的双特异性抗体,可以识别肿瘤干细胞表面的两个蛋白质EGFR和LGR5。EGFR的活动能促进癌细胞的生长,而LGR5则是有效生物标志物。MCLA-158的强大在于一方面能降解含有LGR5标志的癌症干细胞中的EGFR蛋白,阻断了癌症细胞的发育和生存途径;另一方面,MCLA-158抗体不会干扰健康干细胞的功能,这对组织的正常功能是至关重要的。此次长达五年的研究使用了冠科生物的高内涵筛选平台,并在其PDX模型中进行了后续体内研究。此项研究不仅标志着首次将类器官专门用于基于细胞的化合物筛选和特性鉴定,也证明了HUB类器官技术在高通量筛选和肿瘤药物发现中的有效性和应用。

来源:冠科生物
所以说,在药物研发的早期阶段使用类器官有助于筛选出对大多数患者有效或者对特定突变患者有效的药物。并且,冠科生物的类器官平台可以同时运行肿瘤和健康类器官,那么意味着可以快速识别药物对健康器官的副作用,便于早期识别药物毒性。据悉,该项研究能够将最初发现至临床试验的时间缩短至五年左右,为医药公司使用类器官进行药物研发开启了新篇章。
04
结 语
在过去十余年里,冠科生物研发了多种体外体内模型用于支持客户临床前药物开发:拥有超过500多种经过完善表征的肿瘤细胞系用于新药的体外疗效评估;拥有种类高达3000多种的体内PDX模型库,均真实的反映了人类身体内部的情况。在从体外大规模筛选到体内验证上,这些模型提供了一系列患者相关的突变和药理学特征,使得决策更科学。
如今,类器官技术作为前沿技术被引入肿瘤领域。作为拥有全球唯一最大的商业化类器官模型库且是HUB独家授权的CRO公司,冠科生物将一如既往践行“病有所医、及时医治”的企业使命,用创新的类器官技术和专业的服务精神助力客户在肿瘤药物筛选和肿瘤免疫治疗领域的临床阶段实现“踏金起步,成就不凡”。
参考资料:
1.https://www.crownbio.cn/2020-2-28/
— —
—
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


