【指南与共识】| 二甲双胍辅助治疗合并2型糖尿病的恶性肿瘤患者的专家共识(2022年版)
时间:2023-07-27 11:20:35 热度:37.1℃ 作者:网络
[摘要] 恶性肿瘤是近年来慢性非传染性疾病死亡的主要原因,也是影响人类预期寿命的最重要原因,其治疗效果差,预后不良。二甲双胍为2型糖尿病首选的降糖药物,其抗肿瘤的作用得到越来越多同行的认可。然而,目前国内外缺乏独立的临床指南、共识及大型前瞻性临床试验。本共识旨在为二甲双胍在抗肿瘤方面的临床应用提供参考。对于大多数合并2型糖尿病的恶性肿瘤患者,推荐联合使用二甲双胍治疗,可以辅助抗肿瘤及增强化疗药物敏感性,降低多种恶性肿瘤的发病率、转移率,从而降低死亡率;对于少部分合并2型糖尿病的恶性肿瘤患者,不推荐也不反对使用二甲双胍,如雌激素受体(estrogen receptor,ER)阴性或三阴性乳腺癌;对于大部分不合并糖尿病的恶性肿瘤患者,不推荐使用二甲双胍,如肺癌、结直肠癌、前列腺癌等;而对于极少部分不合并糖尿病的恶性肿瘤患者,在充分知情同意的情况下,可使用二甲双胍。
[关键词] 二甲双胍;恶性肿瘤;专家共识;辅助治疗
[Abstract] Malignant tumors are the leading causes of death from chronic non-communicable diseases and the most important factors influencing life expectancy in recent year, with poor treatment response and poor prognosis. Metformin, the preferred hypoglycemic drug for diabetes mellitus type 2, has been recognized by more and more peers for its anti-tumor effect. However, there is no independent clinical guideline, consensus and large prospective clinical trial at home and abroad. This expert guideline aimed to provide clinical practice reference for the application of metformin in anti-tumor treatment. This expert consensus recommends that metformin, used in combination for most malignancies with diabetes mellitus type 2, can assist in anti-tumor effect and enhance chemotherapeutic drug sensitivity, and reduce the morbidity and mortality of multiple malignancies. Metformin is not recommended or opposed for a small number of malignancies complicated with diabetes mellitus type 2, such as estrogen receptor (ER)-negative or triple-negative breast cancer. Metformin is not recommended for most malignant tumors without diabetes, such as lung cancer, colorectal cancer and prostate cancer. However, metformin can be used with informed consent in a very small number of malignancies without diabetes.
[Key words] Metformin; Malignant tumors; Expert consensus; Adjuvant therapy
恶性肿瘤是近年来慢性非传染性疾病死亡的主要原因,也是影响人类预期寿命的最重要原因[1]。据统计,2020年全球新发恶性肿瘤1 929万例,其中中国新发恶性肿瘤457万例,占全球的23.7%[1]。恶性肿瘤常用的治疗方式包括手术治疗、放疗、化疗、免疫治疗和靶向治疗。肿瘤治疗的效果近年来有所提高,但提高仍有限,且经济负担较重,因此临床上迫切需要建立安全、可行且经济实用的肿瘤治疗新模式。
二甲双胍问世距今已有60余年,主要用于糖尿病治疗,单药或联合用药安全、有效,耐受性好,是治疗2型糖尿病(diabetes mellitus type 2,T2DM)首选的降糖药物。二甲双胍除降糖作用之外的其他作用被逐渐认识,如改善脂代谢、减肥、抗衰老、保护大脑功能、减慢认知衰退、降低痴呆风险及抗肿瘤作用。其中,二甲双胍的基础、临床研究证实其具有辅助抗肿瘤及增强化疗药物敏感性的作用,可以降低多种恶性肿瘤的发病率及死亡率,且作用机制与其他抗肿瘤药物不同,为肿瘤的辅助治疗提供了新思路,但目前国内外尚缺乏独立的临床指南、共识及大型前瞻性临床试验为二甲双胍在糖尿病及非糖尿病患者中辅助抗肿瘤方面的应用提供参考,因此本共识旨在为二甲双胍在辅助抗肿瘤治疗方面的临床应用实践提供参考,为辅助肿瘤治疗提供一定程度上的新选择。
本共识的制定方法:
① 本共识采用德尔菲法的方式,邀请了40位全国各地熟悉二甲双胍在肿瘤中应用的肿瘤学领域专家共同探讨制定,采用线上函询和线下讨论两种方式进行,回收咨询问卷后对专家提出的意见进行整合,修订后进行第2次专家咨询,若经过分析专家意见未达到统一,需继续收集意见和反馈直到专家意见高度一致且具有较好的协调性,并将最后1次咨询结果作为最终的评价体系[2],最终得到各议题专家的一致性推荐。
② 文献检索方法:本共识临床证据采用网络检索方式进行,以“二甲双胍”“肿瘤”“癌症”等作为检索词组合,检索维普中文期刊服务平台、中国知网等数据库,以“metformin”“cancer”“tumor”等作为检索词组合,检索PubMed、Springer、中国知网等数据库,检索年限自建库起到2022年5月。
③ 本共识证据质量评价采用目前最常使用的推荐分级的评价、制定与评估(grading of recommendations assessment, development and evaluation,GRADE)系统,包括两部分:第一部分为证据评价,第二部分为推荐意见分级(表1、2)。
1 二甲双胍抗肿瘤机制
二甲双胍辅助抗肿瘤的作用机制较复杂,可以通过激活腺苷—磷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)[3],刺激细胞产生细胞自噬、凋亡及焦亡,直接抑制肿瘤的发生、发展[4-6],还可以通过参与体内多种代谢过程,抑制糖原分解和肝糖原异生,促进外周组织利用葡萄糖,增加胰岛素受体的数量和亲和力,改善胰岛素抵抗,降低胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)水平,抑制IGF-1受体(IGF-1 receptor,IGF-1R)/磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号转导通路,减少低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)修饰,间接降低肿瘤的发生风险,延缓肿瘤的发生、发展[7-10]。此外,二甲双胍还可以抑制肿瘤相关炎症[11],影响肿瘤代谢状态、肿瘤血管生成、肿瘤相关成纤维细胞(cancer-associated fibroblast,CAF)、肿瘤相关免疫细胞等肿瘤相关微环境来抑制肿瘤生长、增殖和转移,从而降低肿瘤的发生风险,延缓肿瘤进展[12-15]。

2 二甲双胍辅助抗肿瘤的临床地位和使用时机
目前,多项研究[16-17]表明,二甲双胍单药或联合放化疗可以降低多种恶性肿瘤的复发率、转移率、肿瘤相关性死亡率及全因死亡率,提高肿瘤患者的生存率,在肺癌[18]、乳腺癌[19]、结直肠癌[20]、前列腺癌[21]、胃癌[22]、肝癌[23]、胰腺癌[24]、肾癌[25]、膀胱癌[26]、卵巢癌[27]、白血病[28]、黑色素瘤[29]、子宫内膜癌[30]及神经胶质瘤[31]等多种恶性肿瘤中均有报道。同时,由于肿瘤细胞对多种化疗药物会产生多重耐药,二甲双胍可以降低或逆转肿瘤的多药耐药[32],研究[32-33]发现,二甲双胍还可以使对标准化疗药物耐药的肿瘤细胞重新敏感,在乳腺癌研究中发现二甲双胍通过AMPK/mTOR信号转导通路改变多药耐药特征,使乳腺癌细胞对5-氟尿嘧啶、阿霉素和紫杉醇重新敏感。二甲双胍还能提高癌细胞对放疗的敏感性[34]。研究[35]表明,食管鳞癌患者接受放疗和二甲双胍治疗后,预后有所改善。
二甲双胍的安全性和耐受性良好,除应用于糖尿病治疗领域外,还应用于治疗多囊卵巢综合征和肥胖,即使在非糖尿病患者中单独使用也不增加低血糖的发生风险。其胃肠道反应多为一过性,不会导致肾脏损害,长期使用不增加高乳酸血症和乳酸酸中毒的风险[36-38]。
二甲双胍可用于预防肥胖人群发生乳腺癌和子宫内膜癌[39],减少结直肠息肉患者进展为结直肠癌的风险[40]。二甲双胍可以提高恶性肿瘤对化疗药物的敏感性,减少耐药[32],二甲双胍联合化疗可以提高肿瘤化疗的敏感性[34]。中国尚未在说明书层面批准二甲双胍用于非糖尿病患者。
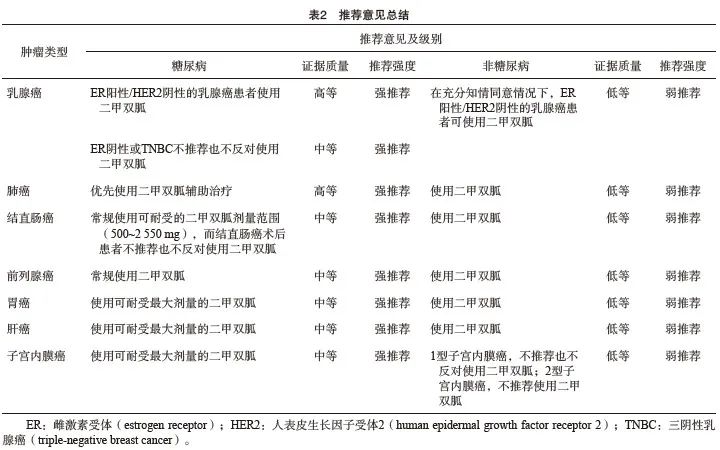
推荐意见:肿瘤患者,在明确诊断糖尿病前期(空腹血糖≥6.1 mmol/L或7.8 mmol/L≤糖负荷后2 h血糖<11.1 mmol/L)或明确诊断糖尿病时,在排除二甲双胍使用禁忌证后,推荐尽早开始二甲双胍治疗(中等质量证据,强推荐);未开始二甲双胍治疗的T2DM患者,在发现肿瘤初期,排除二甲双胍使用禁忌证后,推荐尽早开始二甲双胍治疗,已开始二甲双胍治疗的T2DM患者,在发现肿瘤初期,推荐继续使用二甲双胍治疗(中等质量证据,强推荐)。
3 二甲双胍治疗推荐和临床疗效共识
3.1 二甲双胍与恶性肿瘤
3.1.1 乳腺癌
3.1.1.1 二甲双胍与乳腺癌
乳腺癌是女性最常见的癌症类型,也是癌症导致女性死亡的主要原因之一[41]。有研究[39]评估了接受二甲双胍治疗的乳腺癌患者的癌症发病率,发现二甲双胍对乳腺癌有预防作用,将二甲双胍应用于中国肥胖的未绝经女性,与乳腺纤维化分级及病理学活检阳性的降低有关,提示生活方式联合二甲双胍可能在中国肥胖未绝经女性的乳腺癌预防方面发挥一定的作用。一项对中国台湾省T2DM女性的回顾性研究[42]显示,在285 087例非二甲双胍服药患者中,9 322例(2.10%)发生乳腺癌,而在191 195例二甲双胍服药患者中,2 412例(1.26%)发生乳腺癌,二甲双胍降低了乳腺癌的患病风险。一项基于美国监测、流行病学和最终结果(Surveillance, Epidemiology, and End Result,SEER)数据库的回顾性队列研究[43]显示,在已确诊的Ⅰ~Ⅱ期乳腺癌患者中,二甲双胍分别将二次乳腺癌事件发生风险、乳腺癌复发风险和乳腺癌死亡风险降低了28%、31%和49%。一项meta分析[44]显示,二甲双胍将乳腺癌患者的全因死亡率降低了45%。
3.1.1.2 二甲双胍与乳腺癌亚型
一项亚人群分析[45]发现,使用二甲双胍与ER阳性肿瘤和较少的HER2阴性肿瘤的发生风险降低有关。Park等[46]的病例对照研究结果显示,T2DM与TNBC发生风险增加有关(HR=1.40,95% CI:0.90~2.16),与无T2DM患者相比,使用二甲双胍的T2DM患者与总体乳腺癌发生风险无关,但与ER阳性乳腺癌发生风险降低有关(HR=0.86,95% CI:0.70~1.05),与ER阴性乳腺癌和TNBC发生风险增加有关(HR=1.25,95% CI:0.84~1.88;HR=1.74,95% CI:1.06~2.83)。一项回顾性多中心病例对照研究[47]探讨了T2DM及糖尿病药物对不同乳腺癌亚型发生风险的影响,发现T2DM的女性TNBC的发生风险增加了38%,二甲双胍的使用持续时间越长,TNBC的发生风险就越高。既往研究[48]表明,在辅助化疗期间使用二甲双胍不会显著影响糖尿病合并TNBC患者的生存结局。
推荐意见:在合并糖尿病且排除二甲双胍使用禁忌证的情况下,优先推荐ER阳性/HER2阴性的乳腺癌患者使用二甲双胍(中等质量证据,强推荐)。对于非糖尿病患者,在充分知情同意的情况下,ER阳性/HER2阴性的乳腺癌患者可使用二甲双胍(低等质量证据,弱推荐)。
3.1.2 肺癌
在全球范围内,肺癌仍是癌症死亡的主要原因[41]。二甲双胍可提高非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC)患者的生存率[49-52]。二甲双胍与肺癌发病率和死亡率呈剂量-反应关系,在二甲双胍的累积使用时间和每2年间隔累积定义的每日剂量≥547.5 mg的参与者中这些关联尤为明显,且较非糖尿病患者显著[53]。
Meta分析[54]显示,二甲双胍治疗可显著提高肺癌患者的生存率,将肺癌进行亚型分层,发现未分化癌、NSCLC和SCLC的总生存率HR分别为0.78、0.73和0.51。最近,Brancher等[55]将挪威处方数据库与2005—2014年挪威癌症登记处中确诊为肺癌的22 324例患者联系起来,使用多变量时间固定和时间依赖性COX回归估计了诊断前后二甲双胍的使用与患者总生存期(overall survival,OS)和肺癌特异性生存期(lung cancer-specific survival,LCSS)之间的关联。结果显示,在鳞状细胞癌和区域性鳞状细胞癌患者中,诊断前使用二甲双胍与更长的LCSS相关。所有肺癌患者,特别是鳞状细胞癌、区域性肺癌和区域性鳞状细胞癌患者,诊断后使用二甲双胍与LCSS改善相关,OS也得到了类似结果。累积使用分析发现,所有患者、腺癌和鳞癌患者以及区域性和转移性肺癌患者之间均存在剂量-反应关系。临床研究及流行病学调查结果[54-55]均提
示二甲双胍可以降低肺癌的发病率。
推荐意见:在合并糖尿病且排除二甲双胍使用禁忌证的情况下,推荐肺癌患者可优先使用二甲双胍辅助治疗(中等质量证据,强推荐)。对于非糖尿病和高血糖的情况,尚不推荐应用于肺癌人群中(低等质量证据,弱推荐)。
3.1.3 结直肠癌
结直肠癌的发病率在恶性肿瘤中排名第三,死亡率排名第二[41]。二甲双胍可使结直肠癌缩小,抑制其增殖。一项在47 351例糖尿病患者中进行的队列研究[56]证明,长期使用二甲双胍与结直肠癌的发生风险呈负相关,特别是在男性患者中的发生风险更低。在一项Ⅲ期随机临床试验[40]中,1年的小剂量二甲双胍(250 mg/d)治疗可减少息肉切除术后无糖尿病患者的结直肠癌癌前病变的数量和患病率,如息肉和腺瘤。在放疗期间对结直肠癌患者使用二甲双胍可以增强放疗效果[57]。近期,Xie等[58]研究发现,与其他降糖药联合标准治疗的KRAS突变的转移性结直肠癌合并糖尿病患者相比,二甲双胍选择性抑制KRAS突变的转移性结直肠癌,该组患者的中位生存时间延长了37.8个月,这一显著效应在人源肿瘤异种移植(patient-derived xenograft,PDX)模型和突变细胞模型中得到了进一步证实,该研究证实了使用二甲双胍治疗KRAS突变的转移性结直肠癌患者的可能性。虽然大量证据表明,二甲双胍可能在结直肠癌的发展中具有化学预防作用,但关于手术后二甲双胍和其他结直肠癌治疗可能产生的影响尚不确定。研究[59]发现,在接受手术治疗的结直肠癌患者中,二甲双胍的使用与无复发或无病生存期(disease-free survival,DFS)之间没有关联。来自英国的一项基于大量人群的分析结果也不支持诊断后二甲双胍和伴有T2DM的结直肠癌患者队列生存之间的保护关系[60]。因此,二甲双胍对术后接受化疗的结直肠癌患者的OS和DFS的影响仍不确定。
推荐意见:在合并糖尿病且排除二甲双胍使用禁忌证的情况下,推荐结直肠息肉切除术后使用可耐受的最大剂量二甲双胍(中等质量证据,强推荐);糖尿病合并结直肠癌患者,推荐常规使用可耐受的二甲双胍最大剂量(中等质量证据,强推荐),而结直肠癌术后患者不推荐也不反对使用二甲双胍(低等质量证据,强推荐)。对于非糖尿病和高血糖的情况,尚不推荐对结直肠癌人群使用二甲双胍(低等质量证据,强推荐)。
3.1.4 前列腺癌
前列腺癌是男性第二大常见恶性肿瘤和第五大恶性肿瘤死亡原因[41]。二甲双胍与前列腺癌风险之间的关系存在争议,meta分析[61]发现,T2DM患者前列腺癌的发病率更低,可能与在未控制的糖尿病中,患者睾酮水平更低有关。而二甲双胍治疗T2DM可能逆转了抑制雄激素水平的代谢条件,从而使更高水平的雄激素刺激肿瘤的发生、生长和增殖[62]。最新研究[63]也认为二甲双胍会增加前列腺癌风险,这可能与二甲双胍代谢途径的遗传变异有关。然而,更多的研究认为二甲双胍可以降低前列腺癌风险。2013年,一项以人群为基础的回顾性队列研究[64]显示,二甲双胍治疗可以使前列腺癌的疾病特异性死亡率和全因死亡率下降。另一项回顾性队列研究[65]表明,中国台湾省T2DM男性患者使用二甲双胍可降低前列腺癌的发生风险。Yang等[66]在体外研究中发现,雄激素阻断疗法后加入二甲双胍能够诱导前列腺癌细胞凋亡,减弱雄激素阻断疗法对mTOR的激活,减少体外衰老细胞数量,并抑制前列腺癌细胞PDX模型中的肿瘤生长。二甲双胍具有作为传统治疗及内分泌治疗、放疗、手术治疗的辅助治疗的潜力[62]。
推荐意见:不建议在非糖尿病和高血糖前列腺癌患者尝试使用二甲双胍(低等质量证据,强推荐),而对于前列腺癌合并T2DM的患者,若无二甲双胍使用禁忌证,推荐常规使用二甲双胍(中等质量证据,强推荐)。
3.1.5 胃癌
胃癌是全世界第五大常见恶性肿瘤和第四大恶性肿瘤死亡原因[41]。研究发现,接受二甲双胍治疗的T2DM患者胃癌风险低于未接受二甲双胍治疗的T2DM患者[67];二甲双胍可以显著降低胃癌风险,特别是当病程超过两年的患者[68]。在根除幽门螺杆菌的糖尿病患者中,二甲双胍治疗与较低的胃癌风险有持续时间和剂量依赖性[69]。Lee等[70]将1 974例接受根治性胃切除术的胃癌患者分为接受二甲双胍治疗的糖尿病组、未接受二甲双胍治疗的糖尿病组和非糖尿病组并进行比较,结果显示,在接受胃切除术的胃癌合并糖尿病患者中,增加二甲双胍的干预时间可以降低胃癌的致死率、复发率及全因死亡率。2020年,一项二甲双胍与糖尿病患者患胃癌风险的回顾性研究[71]显示,不服用二甲双胍的胃癌累积发生率最高,而使用二甲双胍的非糖尿病组则最低,使用二甲双胍的糖尿病患者患胃癌的风险较低。这些临床研究均证明二甲双胍可以降低胃癌发病风险。
推荐意见:在合并T2DM且排除二甲双胍使用禁忌证的情况下,推荐在胃癌治疗常规方式如根治性手术、姑息性手术、化疗、靶向治疗、放射治疗、介入治疗、射频治疗等治疗效果欠佳的时候,联合可耐受最大剂量的二甲双胍辅助治疗(中等质量证据,强推荐)。对于非糖尿病和高血糖的情况,尚不推荐对胃癌人群使用二甲双胍(低等质量证据,强推荐)。
3.1.6 肝癌
肝癌是全世界第三大恶性肿瘤死亡原因[41,43]。服用二甲双胍的T2DM患者的原发性肝癌风险降低[72-73]。一项前瞻性队列研究[74]发现,与其他降糖药物相比,二甲双胍可降低原发性肝癌风险。
二甲双胍联合放疗可延长原发性肝癌的OS[74]。经过二甲双胍治疗的T2DM患者肝癌的发病率显著下降,但二甲双胍对非糖尿病的肝病患者中肝癌预防的影响探索极少。Shankaraiah等[75]通过四氯化碳处理miR-221过表达的转基因小鼠构建肝硬化背景的肝癌小鼠模型,每天给予二甲双胍250 mg/kg(相当于糖尿病患者1 500 mg/d)干预,结果发现,二甲双胍可以改善该模型小鼠的肝功能,抑制肝星状细胞激活,减少肝纤维化,减少肝细胞中的脂质积累,延缓失代偿性肝硬化进展,并可改善该模型小鼠发展为原发性肝癌的结局。该研究推测二甲双胍可能有助于改善非糖尿病患者的肝硬化程度和发展为肝癌的结局,但今后尚需临床研究予以证实。
推荐意见:在合并糖尿病且排除二甲双胍使用禁忌证的情况下,推荐肝癌患者常规使用可耐受最大剂量的二甲双胍(中等质量证据,强推荐),不推荐非糖尿病的肝癌患者常规使用二甲双胍(低等质量证据,强推荐)。
3.1.7 子宫内膜癌
子宫内膜癌是女性第五大常见恶性肿瘤[76],而1型子宫内膜癌比2型子宫内膜癌更常见,预后更好,2型子宫内膜癌分化较差,侵袭能力强,转移快[77]。二甲双胍对子宫内膜癌的发生率、临床结局和生存期有潜在的益处[78],二甲双胍治疗可降低子宫内膜癌患者的死亡风险[79-80],提高合并糖尿病的子宫内膜癌患者的生存率[81],同时还可以辅助化疗[82]。有回顾性研究[83-84]表明,使用二甲双胍的T2DM患者患子宫内膜癌的风险未下降,二甲双胍的使用与子宫内膜癌的OS和无进展生存期(progression-free survival,PFS)无关。
有meta分析[85]显示,二甲双胍辅助治疗有助于逆转子宫内膜非典型增生(atypical endometrial hyperplasia,AEH)为正常子宫内膜组织,减少与肿瘤进展相关的细胞增殖生物标志物,延长子宫内膜癌患者的OS。孕激素治疗是AEH或早期子宫内膜癌的育龄女性中推荐的保留生育能力的治疗方式,二甲双胍联合黄体酮治疗的女性患者比单独使用黄体酮上述疾病复发率更低,但缓解率、临床妊娠率及活产率差异无统计学意义[86]。一项保留生育能力治疗的随机对照试验[87]评估了150例AEH和分化良好的子宫内膜样癌患者的临床获益,结果发现,治疗16周后,二甲双胍+甲孕酮组的完全缓解率高于甲孕酮组,但差异无统计学意义(34.3% vs 20.7%, P=0.09),而且在AEH患者中差异有统计学意义(39.6% vs 20.4%,P=0.04),提示在AEH患者中,二甲双胍联合甲孕酮与单用甲孕酮相比早期缓解率更高。一项纳入8项研究、共6 911例患者的meta分析显示,对T2DM患者,二甲双胍能显著改善OS和PFS。然而,使用二甲双胍的糖尿病患者与非糖尿病患者的OS和PFS差异无统计学意义[88]。
推荐意见:在排除二甲双胍使用禁忌证后,子宫内膜癌合并T2DM患者,推荐使用可耐受最大剂量的二甲双胍(中等质量证据,强推荐);对于AEH或早期子宫内膜癌的育龄女性,无论是否合并糖尿病,在孕激素治疗的同时,排除二甲双胍使用禁忌证后,在充分知情同意的情况下,推荐联合使用可耐受最大剂量的二甲双胍(中等质量证据,弱推荐)。对于非糖尿病的1型子宫内膜癌患者,不推荐也不反对使用二甲双胍(低等质量证据,弱推荐),对于非糖尿病2型子宫内膜癌患者,不推荐使用二甲双胍(低等质量证据,弱推荐)。
3.1.8 其他恶性肿瘤
近年来,许多研究[18-31]证实了二甲双胍在T2DM合并胰腺癌、肾癌、膀胱癌、卵巢癌、白血病、黑色素瘤等其他恶性肿瘤中的确切疗效,提示二甲双胍可以抑制恶性肿瘤的发生、发展。此外,二甲双胍还可以降低胆管癌的发病风险,预防糖尿病患者胆管癌的发生,但对OS无影响[89]。二甲双胍是一种相对安全的药物,大多数患者耐受性好,不良反应小,主要表现为恶心、呕吐、腹泻等胃肠道反应[90-91]。乳酸酸中毒是其较严重的并发症之一,但较罕见,主要发生于合并器官损伤的患者中[92-93],且在大剂量应用时发生率增加,而在标准的降糖剂量中则较少发生[94]。在大多数关于二甲双胍抗肿瘤作用的基础研究[95-97]中,使用的剂量均高于标准的抗糖尿病治疗。这使受试动物面临更大的不良反应风险,包括乳酸酸中毒。因此,目前正在研究减少二甲双胍的剂量,同时保持抗癌效果的疗法。有meta分析发现,二甲双胍降低T2DM患者的癌症风险度和延长其癌症发病时间的程度取决于二甲双胍的剂量,无论二甲双胍单独使用还是与其他降糖药联合使用[98]。目前大多数恶性肿瘤研究基于糖尿病人群,对非糖尿病人群缺乏大型临床研究。
推荐意见:糖尿病合并恶性肿瘤患者常规使用可耐受的最大剂量二甲双胍,成人普通片可用的最大剂量为2 550 mg/d,缓释剂型推荐最大用量为2 000 mg/d[99](中等质量证据,强推荐)。不推荐也不反对非糖尿病患者使用二甲双胍(低等质量证据,弱推荐)。
3.2 二甲双胍联合治疗
3.2.1 二甲双胍联合化疗
肿瘤细胞经常对使用的多种化疗药物产生多重耐药,二甲双胍可通过多种机制在联合治疗中增强化疗药物的疗效[100-102],显著提高化疗药物敏感性,并克服对化疗药物的耐药性[103-104]。一项Ⅱ期单臂临床试验[105]显示,患者口服二甲双胍2 500 mg/d+静脉注射伊立替康治疗后,二甲双胍联合伊立替康治疗患者的PFS延长,且安全性良好,这可能与二甲双胍提高了伊立替康敏感性有关。二甲双胍也可能使癌细胞对一些最初敏感的标准化疗药物重新敏感。在乳腺癌中,二甲双胍通过AMPK/mTOR信号转导通路改变多药耐药特征,使肿瘤细胞对5-氟尿嘧啶、阿霉素和紫杉醇重新敏感[32-33]。二甲双胍也阻断了烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)再生的途径[106],导致NAD的消耗并最终诱导肿瘤细胞死亡。
推荐意见:推荐恶性肿瘤合并糖尿病患者化疗时联合小剂量起始二甲双胍治疗,同时密切监测肝肾功能和不良反应(中等质量证据,强推荐)。
3.2.2 二甲双胍联合放疗
放疗是针对恶性肿瘤的一种基本治疗方式,可在治疗过程的各个阶段实施。Rao等[34]研究发现,二甲双胍可以提高癌细胞对放疗的敏感性。Storozhuk等[107]研究发现,二甲双胍能增加体外对NSCLC的放射敏感性。食管鳞癌患者在接受放疗和二甲双胍治疗后,预后有所改善[35]。在Ⅲ~Ⅳ期头颈部鳞状细胞癌患者中,二甲双胍与顺铂联合外照射治疗也正在进行Ⅰ/Ⅱ期临床试验,阶段数据报告[108]显示,其可通过阻断细胞生长所需的关键酶,诱导肿瘤细胞死亡,缩小肿瘤病灶。目前未见大型随机对照试验直接研究二甲双胍与放疗关系的报道。
推荐意见:恶性肿瘤合并糖尿病患者放疗时联合最大可耐受剂量的二甲双胍,同时密切监测肝肾功能和不良反应(中等质量证据,强推荐)。
4 安全性
4.1 二甲双胍使用禁忌证
二甲双胍使用禁忌证包括:① 中度和严重肾衰竭或肾功能不全[肌酐清除率(creatinine clearance rate,CrCl)<45 mL/min或估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)<45 mL/(min · 1.73 m2)];② 可造成组织缺氧的疾病(尤其是急性或慢性疾病的恶化),如失代偿性心力衰竭、呼吸衰竭、近期发作的心肌梗死、休克;③ 严重感染和外伤、外科大手术、低血压等;④ 已知对盐酸二甲双胍过敏者;⑤ 急性或慢性代谢性酸中毒,包括有或无昏迷的酮症酸中毒(需用胰岛素治疗);⑥ 酗酒者;⑦ 接受血管内注射碘化造影剂者,可暂时停用本品;⑧ 维生素B12、叶酸缺乏未纠正者。
4.2 二甲双胍常见不良反应
二甲双胍常见不良反应包括腹泻、恶心、呕吐、胃胀、乏力、消化不良、腹部不适及头痛,多发生于治疗早期,多数患者可耐受。随着治疗时间的延长,上述不良反应可基本消失。小剂量开始,逐渐增加剂量或改用二甲双胍缓释制剂是减少不良反应的有效方法。
利益冲突声明:所有作者均声明不存在利益冲突。
致谢:由衷感谢AME出版社学术总监张开平博士和其他对本共识提供建议和帮助的专家。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] 刘师佺, 周玉碧, 李啟恩, 等. 基于德尔菲法的藏药“蒂达”药用资源和临床应用专家共识[J]. 中国药房, 2021, 32(12): 1416-1420.
LIU S Q, ZHOU Y B, LI Q E, et al. Expert consensus on the medicinal resources and clinical application of Tibetan medicine "dida" based on Delphi method[J]. China Pharm, 2021, 32(12): 1416-1420.
[3] PODHORECKA M, IBANEZ B, DMOSZYŃSKA A. Metforminits potential anti-cancer and anti-aging effects[J]. Postepy Hig Med Dosw (Online), 2017, 71(0): 170-175.
[4] ZHENG Z D, BIAN Y, ZHANG Y, et al. Metformin activates AMPK/SIRT1/NF-κB pathway and induces mitochondrial dysfunction to drive caspase3/GSDME-mediated cancer cell
pyroptosis[J]. Cell Cycle, 2020, 19(10): 1089-1104.
[5] GWINN D M, SHACKELFORD D B, EGAN D F, et al. AMPK phosphorylation of raptor mediates a metabolic checkpoint[J]. Mol Cell, 2008, 30(2): 214-226.
[6] YENMIŞ G, BEŞLI N, YAPRAK SARAÇ E, et al. Metformin promotes apoptosis in primary breast cancer cells by downregulation of cyclin D1 and upregulation of P53 through an AMPK-alpha independent mechanism[J]. Turk J Med Sci, 2021, 51(2): 826-834.
[7] SUI X B, XU Y H, WANG X, et al. Metformin: a novel but controversial drug in cancer prevention and treatment[J]. Mol Pharm, 2015, 12(11): 3783-3791.
[8] LI M, HU X W, XU Y Q, et al. A possible mechanism of metformin in improving insulin resistance in diabetic rat models[J]. Int J Endocrinol, 2019, 2019: 3248527.
[9] SUN R, ZHAI R, MA C, et al. Combination of aloin and metformin enhances the antitumor effect by inhibiting the growth and invasion and inducing apoptosis and autophagy in hepatocellular carcinoma through PI3K/AKT/mTOR pathway[J]. Cancer Med, 2020, 9(3): 1141-1151.
[10] LV Z Q, GUO Y J. Metformin and its benefits for various diseases[J]. Front Endocrinol (Lausanne), 2020, 11: 191.
[11] LIU Q L, TONG D L, LIU G L, et al. Metformin inhibits prostate cancer progression by targeting tumor-associated inflammatory infiltration[J]. Clin Cancer Res, 2018, 24(22): 5622-5634.
[12] KURELAC I, UMESH GANESH N, IORIO M, et al. The multifaceted effects of metformin on tumor microenvironment[J]. Semin Cell Dev Biol, 2020, 98: 90-97.
[13] YE J , CHEN K , QI L , et al. Metformin suppresses hypoxia‑induced migration via the HIF‑1α/VEGF pathway in gallbladder cancer in vitro and in vivo[J]. Oncol Rep, 2018, 40(6): 3501-3510.
[14] ORECCHIONI S, REGGIANI F, TALARICO G, et al. The biguanides metformin and phenformin inhibit angiogenesis, local and metastatic growth of breast cancer by targeting both neoplastic and microenvironment cells[J]. Int J Cancer, 2015, 136(6): E534-E544.
[15] ZHOU X K, CHEN J T, YI G, et al. Metformin suppresses hypoxia-induced stabilization of HIF-1α through reprogramming of oxygen metabolism in hepatocellular carcinoma[J]. Oncotarget, 2016, 7(1): 873-884.
[16] AHMED Z S O, GOLOVOY M, ABDULLAH Y, et al. Repurposing of metformin for cancer therapy: updated patent and literature review[J]. Recent Pat Anticancer Drug Discov, 2021, 16(2): 161-186.
[17] MALLIK R, CHOWDHURY T A. Metformin in cancer[J]. Diabetes Res Clin Pract, 2018, 143: 409-419.
[18] ROOS J F, QUDSI M, SAMARA A, et al. Metformin for lung cancer prevention and improved survival: a novel approach[J]. Eur J Cancer Prev, 2019, 28(4): 311-315.
[19] CEJUELA M, MARTIN-CASTILLO B, MENENDEZ J A, et al. Metformin and breast cancer: where are we now? [J]. Int J Mol Sci, 2022, 23(5): 2705.
[20] NG C A W, JIANG A A, TOH E M S, et al. Metformin and colorectal cancer: a systematic review, meta-analysis and metaregression[J]. Int J Colorectal Dis, 2020, 35(8): 1501-1512.
[21] ZAIDI S, GANDHI J, JOSHI G, et al. The anticancer potential of metformin on prostate cancer[J]. Prostate Cancer Prostatic Dis, 2019, 22(3): 351-361.
[22] COURTOIS S, LEHOURS P, BESSÈDE E. The therapeutic potential of metformin in gastric cancer[J]. Gastric Cancer, 2019, 22(4): 653-662.
[23] MA S J, ZHENG Y X, ZHOU P C, et al. Metformin use improves survival of diabetic liver cancer patients: systematic review and meta-analysis[J]. Oncotarget, 2016, 7(40): 66202-66211.
[24] LENG W, JIANG J, CHEN B, et al. Metformin and malignant tumors: not over the hill[J]. Diabetes Metab Syndr Obes, 2021, 14: 3673-3689.
[25] LI Y, HU L Y, XIA Q H, et al. The impact of metformin use on survival in kidney cancer patients with diabetes: a metaanalysis[J]. Int Urol Nephrol, 2017, 49(6): 975-981.
[26] LIU C Q, SUN J X, XU J Z, et al. Metformin use on incidence and oncologic outcomes of bladder cancer patients with T2DM: an updated meta-analysis[J]. Front Pharmacol, 2022, 13: 865988.
[27] AHMED M F, KANAAN G, MOSTAFA J A. The role of metformin in ovarian cancer: does metformin increase survival in ovarian neoplasm?[J]. Cureus, 2021, 13(2): e13100.
[28] BIONDANI G, PEYRON J F. Metformin, an anti-diabetic drug to target leukemia[J]. Front Endocrinol (Lausanne), 2018, 9:446.
[29] JAUNE E, ROCCHI S. Metformin: focus on melanoma[J]. Front Endocrinol (Lausanne), 2018, 9: 472.
[30] MU N, XU T, GAO M, et al.Therapeutic effect of metformin in the treatment of endometrial cancer[J]. Oncol Lett, 2020, 20(5): 156.
[31] MAZUREK M, LITAK J, KAMIENIAK P, et al. Metformin as potential therapy for high-grade glioma[J]. Cancers (Basel), 2020, 12(1): E210.
[32] LIU B L, FAN Z Y, EDGERTON S M, et al. Potent antiproliferative effects of metformin on trastuzumab-resistant breast cancer cells via inhibition of erbB2/IGF-1 receptor interactions[J]. Cell Cycle, 2011, 10(17): 2959-2966.
[33] QU C, ZHANG W, ZHENG G, et al. Metformin reverses multidrug resistance and epithelial-mesenchymal transition (EMT) via activating AMP-activated protein kinase (AMPK) in human breast cancer cells[J]. Mol Cell Biochem, 2014, 386(1/2): 63-71.
[34] RAO M Y, GAO C L, GUO M, et al. Effects of metformin treatment on radiotherapy efficacy in patients with cancer and diabetes: a systematic review and meta-analysis[J]. Cancer Manag Res, 2018, 10: 4881-4890.
[35] SAMSURI N A B, LEECH M, MARIGNOL L. Metformin and improved treatment outcomes in radiation therapy-a review[J]. Cancer Treat Rev, 2017, 55: 150-162.
[36] WRIGHT A D, CULL C A, MACLEOD K M, et al. Hypoglycemia in type 2 diabetic patients randomized to and maintained on monotherapy with diet, sulfonylurea, metformin, or insulin for 6 years from diagnosis: UKPDS73[J]. J Diabetes Complications, 2006, 20(6): 395-401.
[37] MCCREIGHT L J, STAGE T B, CONNELLY P, et al. Pharmacokinetics of metformin in patients with gastrointestinal intolerance[J]. Diabetes Obes Metab, 2018, 20(7): 1593-1601.
[38] SOUKAS A A, HAO H B, WU L F. Metformin as anti-aging therapy: is it for everyone?[J]. Trends Endocrinol Metab, 2019, 30(10): 745-755.
[39] LENG W L, PU D L, JIANG J, et al. Effect of metformin on breast density in overweight/obese premenopausal women[J]. Diabetes Metab Syndr Obes, 2021, 14: 4423-4432.
[40]HIGURASHI T, HOSONO K, TAKAHASHI H, et al. Metformin for chemoprevention of metachronous colorectal adenoma or polyps in post-polypectomy patients without diabetes: a multicentre double-blind, placebo-controlled, randomised phase 3 trial[J]. Lancet Oncol, 2016, 17(4): 475-483.
[41] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[42] TSENG C H. Metformin may reduce breast cancer risk in Taiwanese women with type 2 diabetes[J]. Breast Cancer Res Treat, 2014, 145(3): 785-790.
[43] CHEN L, CHUBAK J, BOUDREAU D M, et al. Diabetes treatments and risks of adverse breast cancer outcomes among early-stage breast cancer patients: a SEER-medicare analysis[J]. Cancer Res, 2017, 77(21): 6033-6041.
[44] TANG G H, SATKUNAM M, POND G R, et al. Association of metformin with breast cancer incidence and mortality in patients with type Ⅱ diabetes: a GRADE-assessed systematic review and meta-analysis[J]. Cancer Epidemiol Biomark Prev, 2018, 27(6): 627-635.
[45] CHLEBOWSKI R T, MCTIERNAN A, WACTAWSKIWENDE J, et al. Diabetes, metformin, and breast cancer in postmenopausal women[J]. J Clin Oncol, 2012, 30(23): 2844-52.
[46] PARK Y M M, BOOKWALTER D B, O’BRIEN K M, et al. A prospective study of type 2 diabetes, metformin use, and risk of breast cancer[J]. Ann Oncol, 2021, 32(3): 351-359.
[47] CHEN H J, COOK L S, TANG M C, et al. Relationship between diabetes and diabetes medications and risk of different molecular subtypes of breast cancer[J]. Cancer Epidemiol
Biomarkers Prev, 2019, 28(11): 1802-1808.
[48] BAYRAKTAR S, HERNADEZ-AYA L F, LEI X D, et al. Effect of metformin on survival outcomes in diabetic patients with triple receptor-negative breast cancer[J]. Cancer, 2012, 118(5): 1202-1211.
[49] DHILLON S S, GROMAN A, MEAGHER A, et al. Metformin and not diabetes influences the survival of resected early stage NSCLC patients[J]. J Cancer Sci Ther, 2014, 6(7): 217-222.
[50] XU T B, LI D S, HE Y, et al. Prognostic value of metformin for non-small cell lung cancer patients with diabetes[J]. World J Surg Oncol, 2018, 16(1): 60.
[51] XU T, LIANG G, YANG L, et al. Prognosis of small cell lung cancer patients with diabetes treated with metformin[J]. Clin Transl Oncol, 2015, 17(10): 819-824.
[52] KONG F M, GAO F F, LIU H G, et al. Metformin use improves the survival of diabetic combined small-cell lung cancer patients[J]. Tumour Biol, 2015, 36(10): 8101-8106.
[53] KANG J H, JEONG S M, SHIN D W, et al. The associations of aspirin, statins, and metformin with lung cancer risk and related mortality: a time-dependent analysis of population-based nationally representative data[J]. J Thorac Oncol, 2021, 16(1): 76-88.
[54] ZENG S, GAN H X, XU J X, et al. Metformin improves survival in lung cancer patients with type 2 diabetes mellitus: a metaanalysis[J]. Med Clin (Barc), 2019, 152(8): 291-297.
[55] BRANCHER S, STØER N C, WEIDERPASS E, et al. Metformin use and lung cancer survival: a population-based study in Norway[J]. Br J Cancer, 2021, 124(5): 1018-1025.
[56] BRADLEY M C, FERRARA A, ACHACOSO N, et al. A cohort study of metformin and colorectal cancer risk among patients with diabetes mellitus[J]. Cancer Epidemiol Biomarkers Prev, 2018, 27(5): 525-530.
[57] FERNANDES J M, JANDREY E H F, KOYAMA F C, et al. Metformin as an alternative radiosensitizing agent to 5-fluorouracil during neoadjuvant treatment for rectal cancer[J]. Dis Colon Rectum, 2020, 63(7): 918-926.
[58] XIE J Y, XIA L P, XIANG W, et al. Metformin selectively inhibits metastatic colorectal cancer with the KRAS mutation by intracellular accumulation through silencing MATE1[J]. Proc Natl Acad Sci USA, 2020, 117(23): 13012-13022.
[59] FRANSGAARD T, THYGESEN L C, GÖGENUR I. Association between metformin use after surgery for colorectal cancer and oncological outcomes: a nationwide register-based study[J]. Int J Cancer, 2018, 143(1): 63-72.
[60] MC MENAMIN Ú C, MURRAY L J, HUGHES C M, et al. Metformin use and survival after colorectal cancer: a population-based cohort study[J]. Int J Cancer, 2016, 138(2): 369-379.
[61] KASPER J S, GIOVANNUCCI E. A meta-analysis of diabetes mellitus and the risk of prostate cancer[J]. Cancer Epidemiol Biomarkers Prev, 2006, 15(11): 2056-2062.
[62] HANKINSON S J, FAM M, PATEL N N. A review for clinicians: prostate cancer and the antineoplastic properties of metformin[J]. Urol Oncol, 2017, 35(1): 21-29.
[63] LEE M J, JAYALATH V H, XU W, et al. Association between metformin medication, genetic variation and prostate cancer risk[J]. Prostate Cancer Prostatic Dis, 2021, 24(1): 96-105.
[64] MARGEL D, URBACH D R, LIPSCOMBE L L, et al. Metformin use and all-cause and prostate cancer-specific mortality among men with diabetes[J]. J Clin Oncol, 2013, 31(25): 3069-3075.
[65] TSENG C H. Metformin significantly reduces incident prostate cancer risk in Taiwanese men with type 2 diabetes mellitus[J]. Eur J Cancer, 2014, 50(16): 2831-2837.
[66] YANG B, DAMODARAN S, KHEMEES T A, et al. Synthetic lethal metabolic targeting of androgen-deprived prostate cancer cells with metformin[J]. Mol Cancer Ther, 2020, 19(11): 2278-2287.
[67] ZHOU X L, XUE W H, DING X F, et al. Association between metformin and the risk of gastric cancer in patients with type 2 diabetes mellitus: a meta-analysis of cohort studies[J]. Oncotarget, 2017, 8(33): 55622-55631.
[68] TSENG C H. Metformin reduces gastric cancer risk in patients with type 2 diabetes mellitus[J]. Aging (Albany NY), 2016, 8(8): 1636-1649.
[69] CHEUNG K S, CHAN E W, WONG A Y S, et al. Metformin use and gastric cancer risk in diabetic patients after helicobacter pylori eradication[J]. J Natl Cancer Inst, 2019, 111(5): 484-489.
[70] LEE C K, JUNG M, JUNG I, et al. Cumulative metformin use and its impact on survival in gastric cancer patients after gastrectomy[J]. Ann Surg, 2016, 263(1): 96-102.
[71] KIM J, HYUN H J, CHOI E A, et al. Metformin use reduced the risk of stomach cancer in diabetic patients in Korea: an analysis of Korean NHIS-HEALS database[J]. Gastric Cancer, 2020, 23(6): 1075-1083.
[72] DONADON V, BALBI M, GHERSETTI M, et al. Antidiabetic therapy and increased risk of hepatocellular carcinoma in chronic liver disease[J]. World J Gastroenterol, 2009, 15(20): 2506-2511.
[73] DONADON V, BALBI M, MAS M D, et al. Metformin and reduced risk of hepatocellular carcinoma in diabetic patients with chronic liver disease[J]. Liver Int, 2010, 30(5): 750-758.
[74] LEE M S, HSU C C, WAHLQVIST M L, et al. Type 2 diabetes increases and metformin reduces total, colorectal, liver and pancreatic cancer incidences in Taiwanese: a representative population prospective cohort study of 800 000 individuals[J]. BMC Cancer, 2011, 11: 20.
[75]SHANKARAIAH R C, CALLEGARI E, GUERRIERO P, et al. Metformin prevents liver tumourigenesis by attenuating fibrosis in a transgenic mouse model of hepatocellular carcinoma[J].
Oncogene, 2019, 38(45): 7035-7045.
[76] FERLAY J, COLOMBET M, SOERJOMATARAM I, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods[J]. Int J Cancer, 2019, 144(8): 1941-1953.
[77] BOKHMAN J V. Two pathogenetic types of endometrial carcinoma[J]. Gynecol Oncol, 1983, 15(1): 10-17.
[78] LEE T Y, MARTINEZ-OUTSCHOORN U E, SCHILDER R J, et al. Metformin as a therapeutic target in endometrial cancers[J]. Front Oncol, 2018, 8: 341.
[79] WU J W, BOUDREAU D M, PARK Y, et al. Commonly used diabetes and cardiovascular medications and cancer recurrence and cancer-specific mortality: a review of the literature[J]. Expert Opin Drug Saf, 2014, 13(8): 1071-1099.
[80] ZHANG Z J, LI S. The prognostic value of metformin for cancer patients with concurrent diabetes: a systematic review and meta-analysis[J]. Diabetes Obes Metab, 2014, 16(8): 707-710.
[81] KO E M, WALTER P, JACKSON A, et al. Metformin is associated with improved survival in endometrial cancer[J]. Gynecol Oncol, 2014, 132(2): 438-442.
[82] HANNA R K, ZHOU C X, MALLOY K M, et al. Metformin potentiates the effects of paclitaxel in endometrial cancer cells through inhibition of cell proliferation and modulation of the mTOR pathway[J]. Gynecol Oncol, 2012, 125(2): 458-469.
[83] ARIMA R, MARTTILA M, HAUTAKOSKI A, et al. Antidiabetic medication, statins and the risk and prognosis of non-endometrioid endometrial cancer in women with type 2 diabetes[J]. Anticancer Res, 2018, 38(7): 4169-4178.
[84] URPILAINEN E, ARIMA R, KARIHTALA P, et al. Metformin associates with aggressive features of endometrial cancer in women with type 2 diabetes[J]. Anticancer Res, 2021, 41(2): 821-828.
[85] MEIRELES C G, PEREIRA S A, VALADARES L P, et al. Effects of metformin on endometrial cancer: Systematic review and meta-analysis[J]. Gynecol Oncol, 2017, 147(1): 167-180.
[86] CHAE-KIM J, GARG G, GAVRILOVA-JORDAN L, et al. Outcomes of women treated with progestin and metformin for atypical endometrial hyperplasia and early endometrial cancer: a systematic review and meta-analysis[J]. Int J Gynecol Cancer, 2021, 31(12): 1499-1505.
[87] YANG B Y, GULINAZI Y, DU Y, et al. Metformin plus megestrol acetate compared with megestrol acetate alone as fertility-sparing treatment in patients with atypical endometrial hyperplasia and well-differentiated endometrial cancer: a randomised controlled trial[J]. BJOG, 2020, 127(7): 848-857.
[88] GONG H, CHEN Y, ZHOU D C. Prognostic significance of metformin treatment in endometrial cancer: a meta-analysis[J]. Pharmazie, 2020, 75(8): 401-406.
[89] TSENG C H. Metformin and biliary tract cancer in patients with type 2 diabetes[J]. Front Oncol, 2020, 10: 587666.
[90] BOLEN S, FELDMAN L, VASSY J, et al. Systematic review: comparative effectiveness and safety of oral medications for type 2 diabetes mellitus[J]. Ann Intern Med, 2007, 147(6): 386-399.
[91] FUJITA Y, INAGAKI N. Metformin: new preparations and nonglycemic benefits[J]. Curr Diab Rep, 2017, 17(1): 5.
[92] KHURANA R, MALIK I S. Metformin: safety in cardiac patients[J]. Postgrad Med J, 2010, 86(1016): 371-373.
[93] NATHAN D M, BUSE J B, DAVIDSON M B, et al. Medical management of hyperglycaemia in type 2 diabetes mellitus: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement from the American Diabetes Association and the European Association for the study of diabetes[J].Diabetologia, 2009, 52(1): 17-30.
[94] TEALE K F, DEVINE A, STEWART H, et al. The management of metformin overdose[J]. Anaesthesia, 1998, 53(7): 698-701.
[95] SELIGER C, MEYER A L, RENNER K, et al. Metformin inhibits proliferation and migration of glioblastoma cells independently of TGF-β2[J]. Cell Cycle, 2016, 15(13): 1755-1766.
[96] YU Z Y, ZHAO G, XIE G F, et al. Metformin and temozolomide act synergistically to inhibit growth of glioma cells and glioma stem cells in vitro and in vivo[J]. Oncotarget, 2015, 6(32): 32930-32943.
[97] SELIGER C, RENNER K, KREUTZ M, et al. p17.39 turn old into new: metformin as antineoplastic agent in glioblastoma[J]. Neuro-Oncology, 2014, 16(suppl 2): ii96.
[98] LIN H C, KACHINGWE B H, LIN H L, et al. Effects of metformin dose on cancer risk reduction in patients with type 2 diabetes mellitus: a 6-year follow-up study[J]. Pharmacotherapy, 2014, 34(1): 36-45.
[99] Metformin: a practical guide to optimising outcomes round-table discussion held in Edinburgh[J]. Br J Diabetes Vasc Dis, 2008, 8: 153-155.
[100] HIRSCH H A, ILIOPOULOS D, TSICHLIS P N, et al. Metformin selectively targets cancer stem cells, and acts together with chemotherapy to block tumor growth and prolong remission[J]. Cancer Res, 2009, 69(19): 7507-7511.
[101] ILIOPOULOS D, HIRSCH H A, STRUHL K. Metformin decreases the dose of chemotherapy for prolonging tumor remission in mouse xenografts involving multiple cancer cell types[J]. Cancer Res, 2011, 71(9): 3196-3201.
[102] LIU H Y, SCHOLZ C, ZANG C B, et al. Metformin and the mTOR inhibitor everolimus (RAD001) sensitize breast cancer cells to the cytotoxic effect of chemotherapeutic drugs in vitro[J]. Anticancer Res, 2012, 32(5): 1627-1637.
[103] CHATTERJEE S, THAKER N, DE A. Combined 2-deoxy glucose and metformin improves therapeutic efficacy of sodiumiodide symporter-mediated targeted radioiodine therapy in breast cancer cells[J]. Breast Cancer (Dove Med Press), 2015, 7: 251-265.
[104] PENG M, DARKO K O, TAO T, et al. Combination of metformin with chemotherapeutic drugs via different molecular mechanisms[J]. Cancer Treat Rev, 2017, 54: 24-33.
[105] BRAGAGNOLI A C, ARAUJO R L C, FERRAZ M W, et al. Metformin plus lrinotecan in patients with refractory colorectal cancer: a phase 2 clinical trial[J]. Br J Cancer, 2021, 124(6):
1072-1078.
[106] ROSHAN M H K, SHING Y K, PACE N P. Metformin as an adjuvant in breast cancer treatment[J]. SAGE Open Med, 2019, 7: 2050312119865114.
[107] STOROZHUK Y, HOPMANS SN, SANLI T, et al. Metformin inhibits growth and enhances radiation response of non-small cell lung cancer (NSCLC) through ATM and AMPK[J]. Br J Cancer, 2013, 108(10): 2021-2032.
[108] GULATI S, DESAI J, PALACKDHARRY S M, et al. Phase 1 dose-finding study of metformin in combination with concurrent cisplatin and radiotherapy in patients with locally advanced head and neck squamous cell cancer[J]. Cancer, 2020, 126(2): 354-362.


