CHRS 2023:心肌病室速的治疗:临床实践与探索
时间:2023-08-01 11:24:58 热度:37.1℃ 作者:网络
第23届心律学大会(CHRS2023)于2023年7月21日至23日在广州顺利召开,本次大会由中国生物医学工程学会主办,中国生物医学工程学会心律分会承办。会议主题为“齐心协律、创新竞进”,旨在加强学术交流和医疗技术创新,推进心律失常领域的发展。大会将邀请国内知名专家学者作主旨报告、分会场报告以及病例讨论等同时还将继续举办心律失常青年术者大赛、经典手术联播、前沿学术讲座和创新技术交流等活动。
本次会议上,来自西安交通大学第二附属医院的郑强荪教授,以《心肌病室速的治疗:临床实践与探索》为题为大家做精彩演讲,小编整理重点,供大家参考学习。

心肌病室速的病理基础及机制
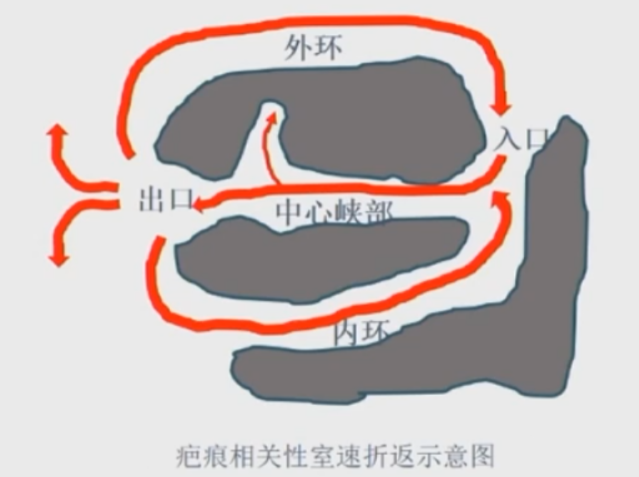
心肌病室速又称器质性室速,疤痕相关性室速,是由于正常心肌被不具备传导功能的组织所取代,围绕心肌疤痕组织/解剖屏障(瓣环) 引起折返类型的心动过速,约占90%左右。
心肌病的影像检出手段
MRI扫描-延迟增强显影显示缺血区域;
TEE—测量射血分数 (EF) 并显示室壁运动异常;
CT扫描确定是否存在冠脉疾病及心脏机构异常;
ICE—辅助穿间隔,定位导管,实施评估消融效果。
心肌病室速分类:缺血性和非缺血性心肌病
缺血性心肌病室速:
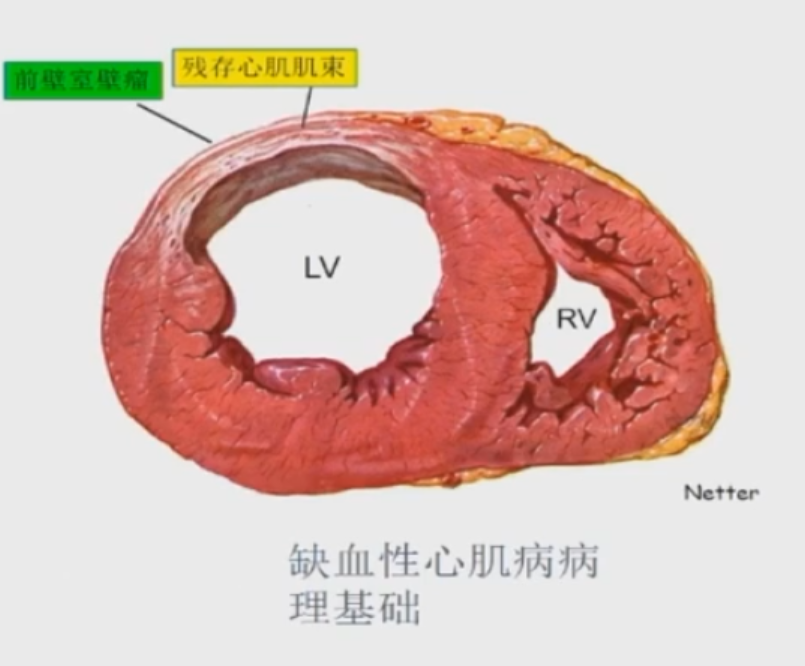
由于冠脉阻塞或痉挛引起供血的心肌发生缺血坏死后被无传导功能的纤维瘀痕取代。
由于疤痕没有收缩能力,梗死区收缩能力减弱或发生矛盾运动,超声通过观察室壁运动可以看到室壁瘤。
核素检查延迟显影可以看到坏死区较正常区域延迟增强。
2008ESC心肌病分型 (非缺血性心肌病):
心肌病包括:肥厚型心肌病(HCM)、扩张型心肌病(DCM)、致心律失常右室心肌病(ARVC)、限制型心肌病(RCM)、未分类心肌病。
非缺血性心肌病代表——ARVC
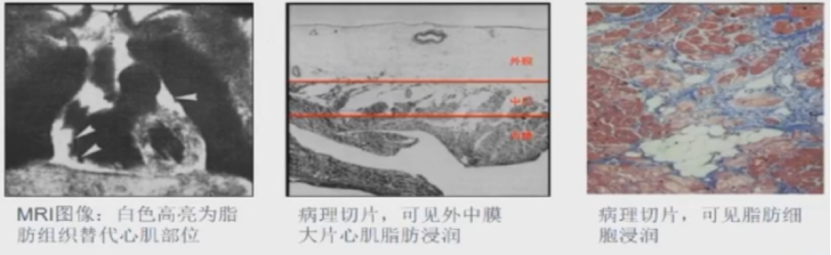
ARVC是由于右室心肌细胞被脂肪和纤维细胞替代,常呈现家族性发病特点,与常染色体显性遗传有关。
ARVC临床以室性心律失常,尤其是多形性室速为主要表现,多见于男性和年轻患者,是引起猝死的重要原因之一。
病变严重时可引起右室扩大,室壁瘤及心功能不全。
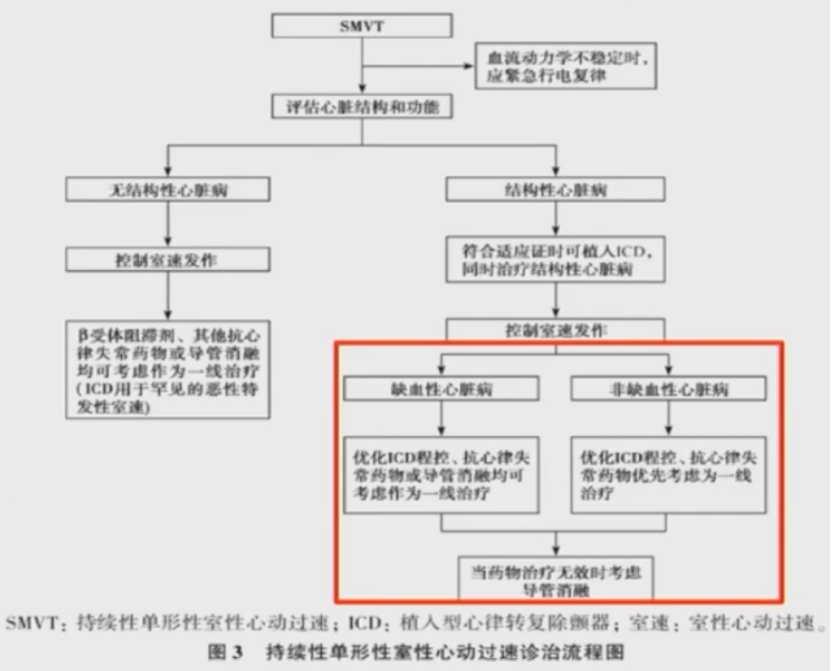
2022室性心律失常中国专家共识中指出,ICM,导管消融可作为一线治疗:,NICM,药物无效时考虑导管消融。
PAUSE-SC 心肌病室速导管消融多中心随机对照研究
PAUSE-SCD研究在11家中心,共纳入180例合并单形性室速、有ICD植入指征的心肌病患者。
其中121例患者平均年龄为55岁,左室射血分数为40%,81%为男性,以1:1的比例随机分入实验组和传统药物治疗组 (对照组)。其中,ICM占35%,NICM占30%,ARVC占35%。
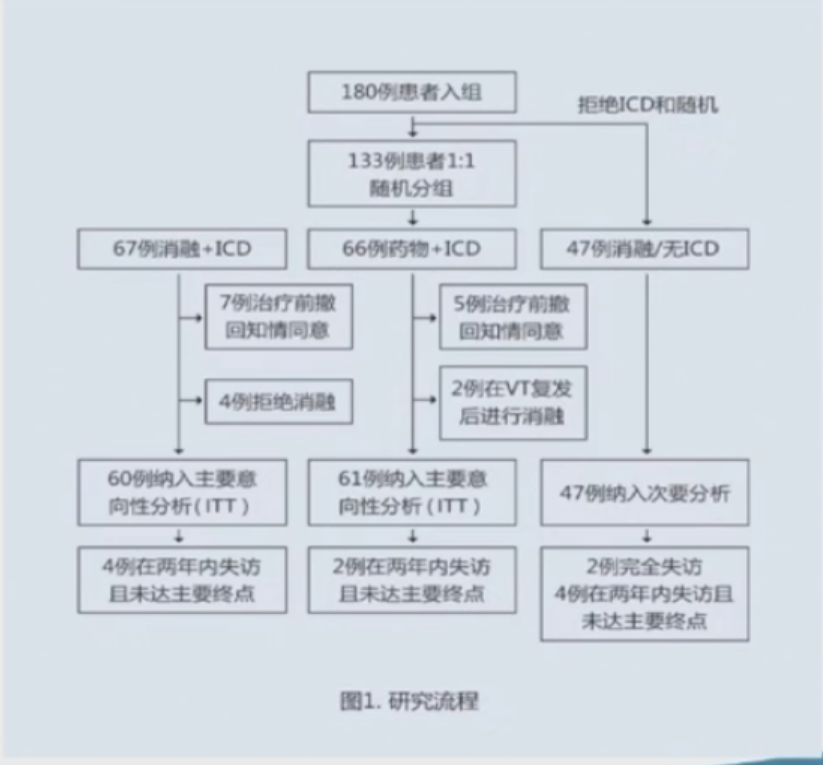
研究结果
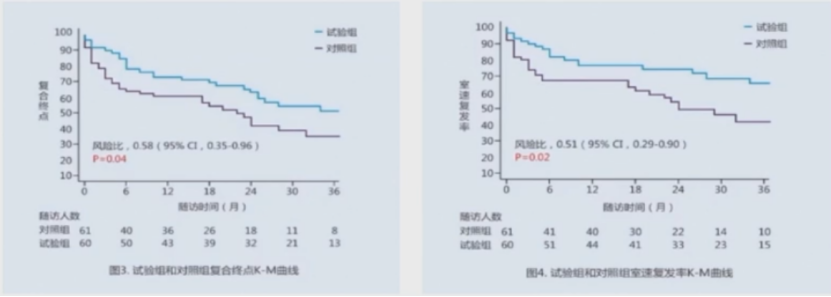
1、在复合终点,VT复发,ICD放电比例等结局上,导管消融组明显更优;
2、两组患者的心血管相关住院(32.0% vs 33.7%)及死亡率(8.9%vs 8.8%)无显著差异;
3、导管消融组有8.3%的患者出现消融相关并发症。
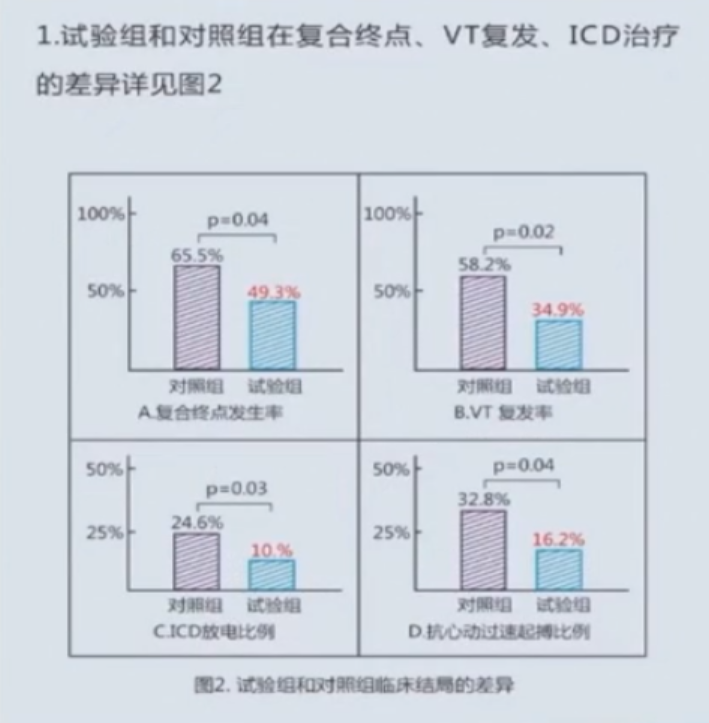
在不同病因的心肌病患者中,植入ICD的同时进行早期导管消融可以显著降低室性心动过速心律失常复发,改善远期心血管相关住院或死亡的复合终点,并减少ICD的治疗需求。
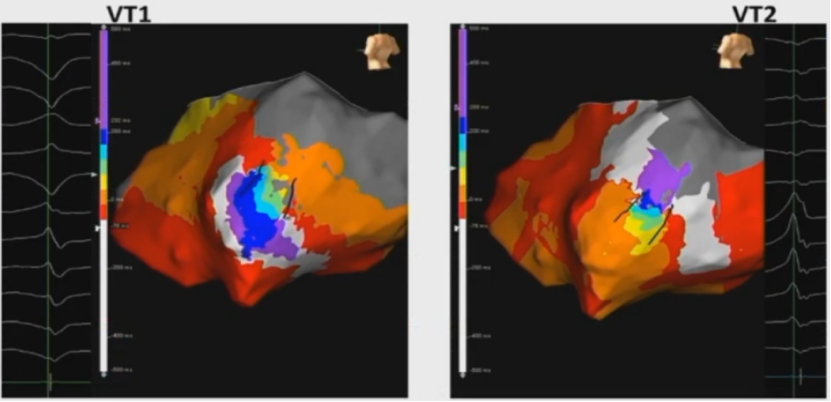
心肌病室速的标测和消融策略
室速下折返环标测:激动标测、拖带标测
窦律基质标测:电压标测、异常电位标测、心室缓慢传导区标测
室速下高密度标测出折返环
对于血流动力学稳定的病人,可以进行心动过速下激动标测,完整标出折返环,对关键通道进行消融。

多种形态的心动过速可共享一个峡部。多种心动过速,往往只是出口不一样或者峡部传导方向不一样。
拖带标测
通过拖带的不同反应可以判断起搏点在外环、内环、中心通道旁观。
S-QRS 指刺激起搏钉到夺获的QRS波起始的间期,S-QRS占TCL的比例可以判定起搏点在入口、中心通道、还是出口。
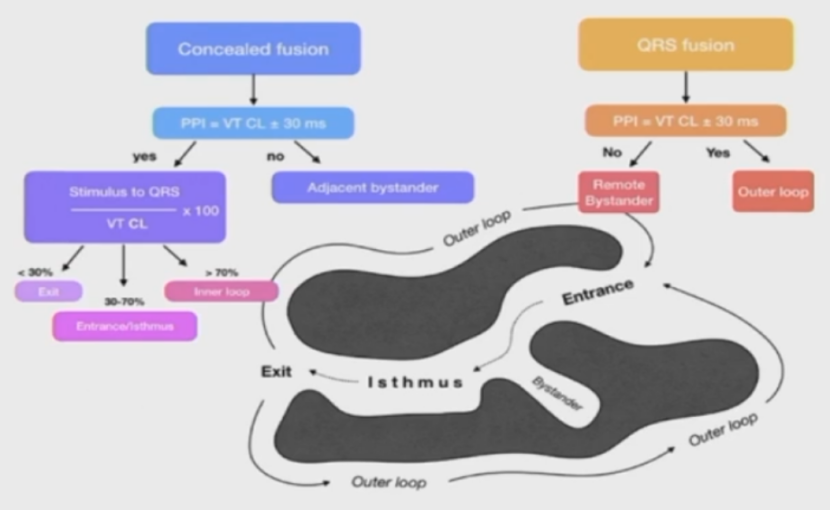
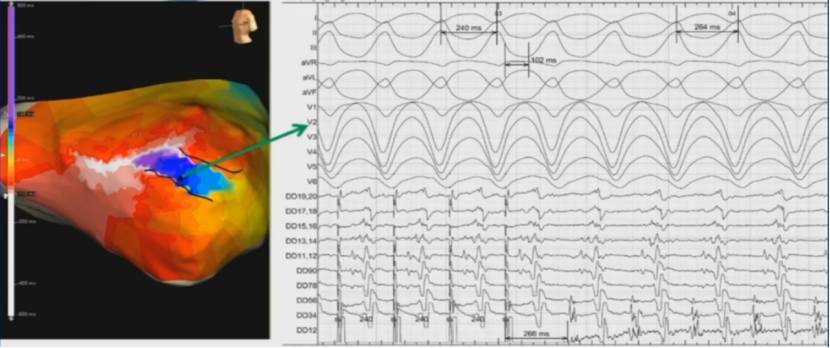
峡部拖带
隐匿拖带,TCL=264ms,PPI=266ms,S-QRS=102ms,S-QRS/TCL=38%,在峡部。
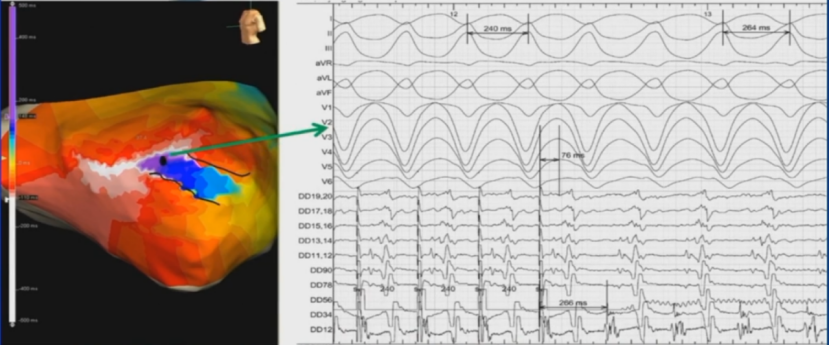
峡部出口拖带
隐匿拖带,TCL=264ms.PPI=266ms,S-QRS=76ms,S-QRS/TCL<30%,在出口。
心肌病室速的标测策略: 窦律基质标测
所谓的基质标测,就是对VT形成环境的标测。心肌的器质性变化,或瘀痕的存在,在心肌电压、电位和激动传导上会有特征性的表现。标测基质可以揭示VT形成的机制。
基质标测优势:无需诱发VT,在窦律下就可进行。
VT的基质标测:心室电压标测、特殊电位标测、心室缓慢传导区标测
心肌病室速的基质标测——电压标测消融
心肌的器质性病变,或瘢痕产生,会使心肌细胞的电活动减弱或丧失。高密度标测心室电压,可以揭示低电压区和瘢痕区,针对这些区域进行基质改良消融,可以消融VT产生的条件。
诵常,心室电压设置为: 低于0.5 mV为瘢痕坏死区;0.5-1.5mV之间为低电压区 (移行区),代表不健康心肌;1.5 mV以上为正常电压,代表健康心肌。
电压标测对VT相关通道识别无特异性,需要消融的范围大,时间长。
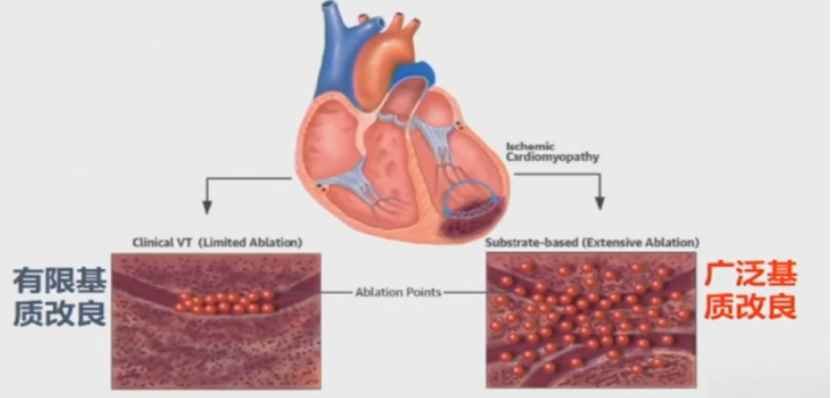
1、有限基质改良:针对临床VT,通过拖带和起搏寻找可能的传导通道,并线性消融阻断通道。
2、广泛的瘢痕均质化消融:在所有异常电压的区域均进行消融使之成为均质化的瘢痕。
消融线设计符合以下标准之一:
①消融线要穿过低电压区的边界;②消融线从最低电压区延伸至正常电压区;③消融线穿过起搏VT形态与临床相近的移行区。
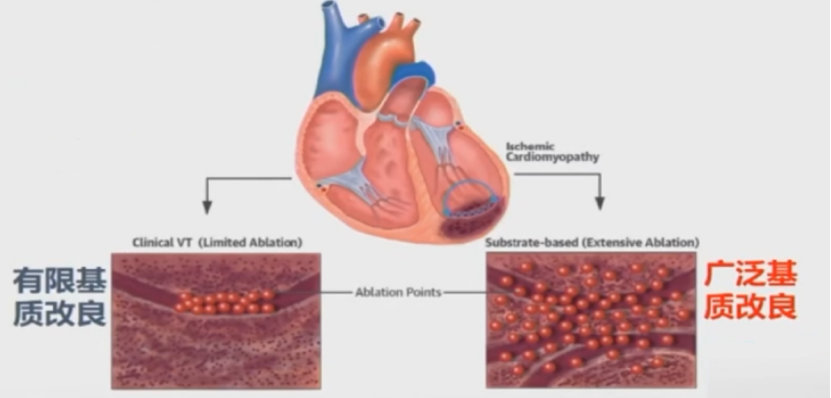
一项研究表明,增强消融效果可能更好。
12个月随访VT复发率广泛消融组: 15.4%,标准消融组: 48.3%
NICM基质标测的挑战1: 更多心外膜基质参与
NICM患者的心内膜上可能有瘢痕区域,但通常比ICM患者更加碎片化,且多发于左心室基底部。
高达20%-60%的NICM患者可能完全没有心内膜上的瘢痕;Hsia等报道,NICM患者心外膜存在可诱发室速的基质通常比心内膜更常见。
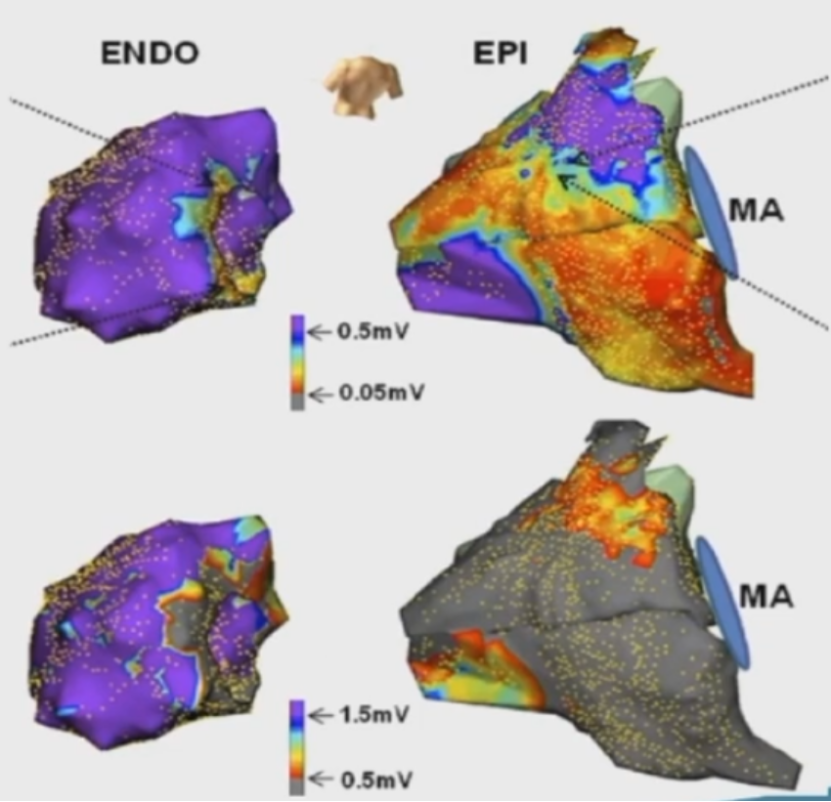
NICM基质标测的挑战2:双极电压标测不能准确反映疤心外膜痕区
心外膜标测因脂肪垫或导管不良贴靠都可能影像对瘢痕区域的影影响。
只有当同时满足下列两个条件时,才可能明确真正的心外膜瘢痕:①心外膜低电压区大于心内膜低电压区;②腔内局部电图较宽 (>80ms)、碎裂、或表现出晚电位。
由于②条件在NICM患者心外膜标测中很少见,所以操作者可能错误的判断瘢痕区。
心内膜单极电压标测可作为一种寻找心肌中层和心外膜瘢痕的方法。Hutchinson等提出,心内膜面积>2cm2的交界区如果单极电压<8.3mV,平均5.5mV,则该区域与心外膜及心肌中层的瘢痕区相关。
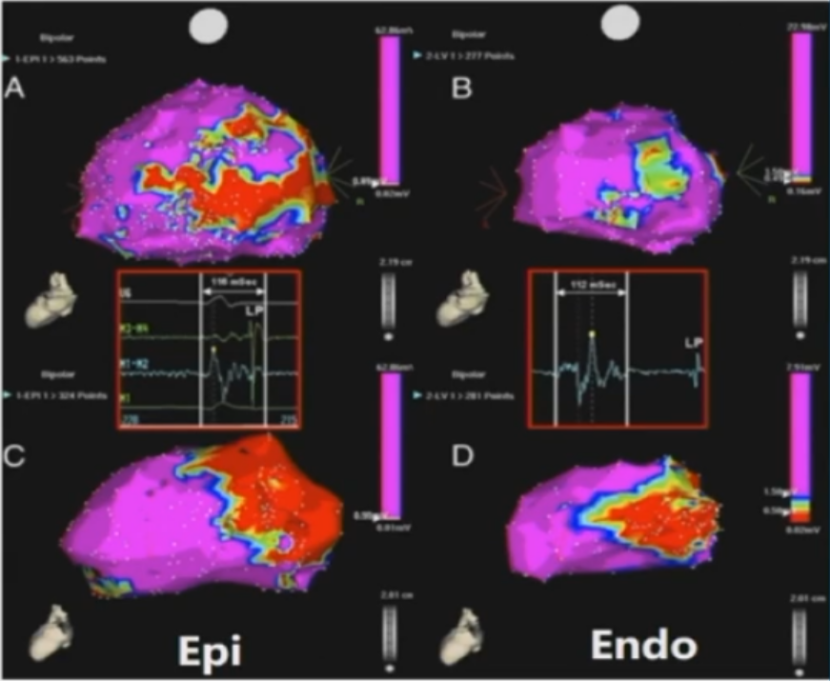
心内膜单极电压标测与心外膜双极电压标测的瘢痕之间存在相关性。而心外膜双极电压标测的瘢痕区域明显比心内膜单极电压标测的瘢痕区域大。
心肌病室速的基质标测——特殊电位标测
晚电位 (Late Potential, LP):局部电位发生于体表QRS结束后,可以表现为IDP或碎裂电位;
局部心室异常电位 (Local Abnormal Ventricular Activity,LAVA电位);
孤立舒张期电位 (IDP) :孤立电位的发生时间在体表QRS结束后;
碎裂电位:振幅小于0.5mV,时程>130ms,没有等电位线的连续电位;
孤立电位 (IP):第二个及后续电位与V波主波有超过20ms的等电位线(上至50ms)。
晚电位的形成和意义
晚电位表示窦律下的缓慢传导导致的局部心肌的延迟激动。
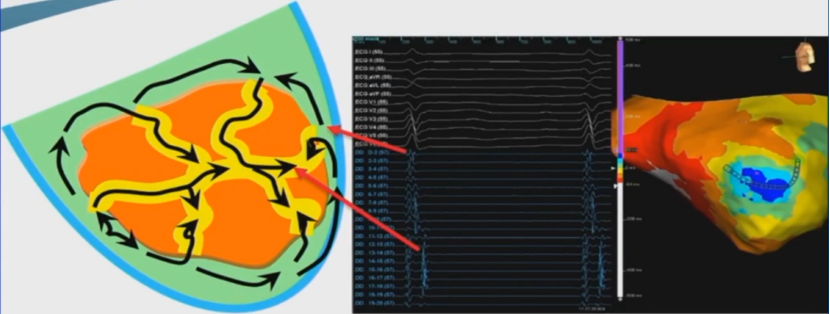
窦律下晚电位可能成为VT下折返环的电生理峡部。
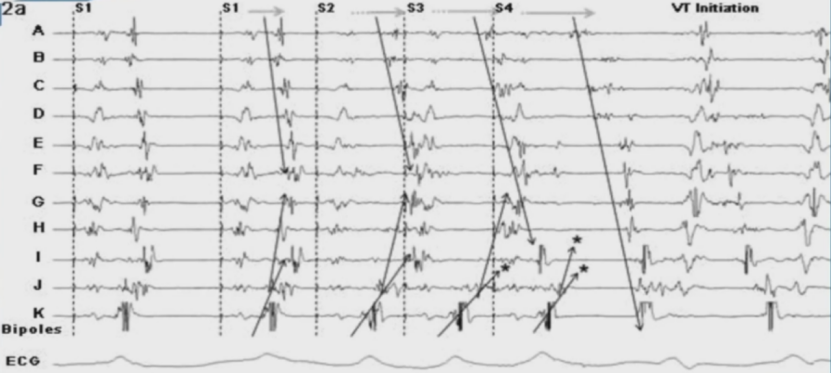
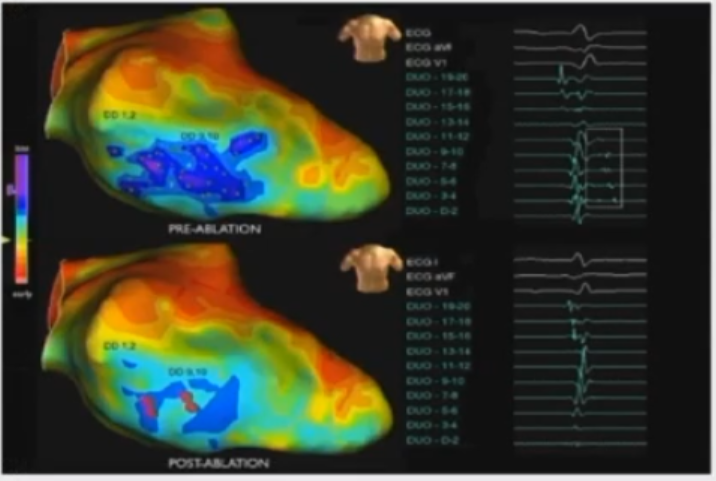
消融融策略:晚电位消除
研究发现50例患者中,84%患者可达完全LP消除。平均12个月随访,完全LP消除组可达90.5%的无复发率,显著高于不完全消除组 (25%)。LP消除是室速消融的有效终点。
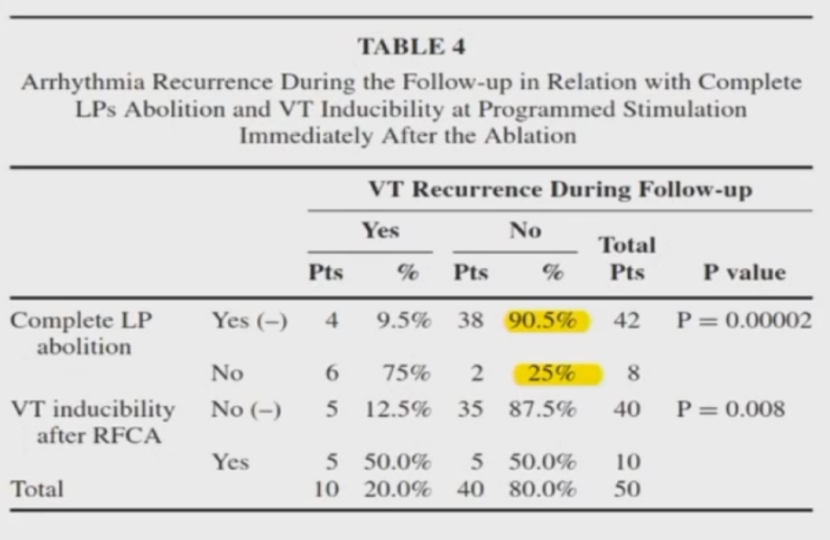
现行技术难以到达完全消除所有晚电位
消融策略: 消除较早的晚电位
疤痕内的通道经常是相互连接的;消融可以改变损伤灶以外瘢痕区的电传导。
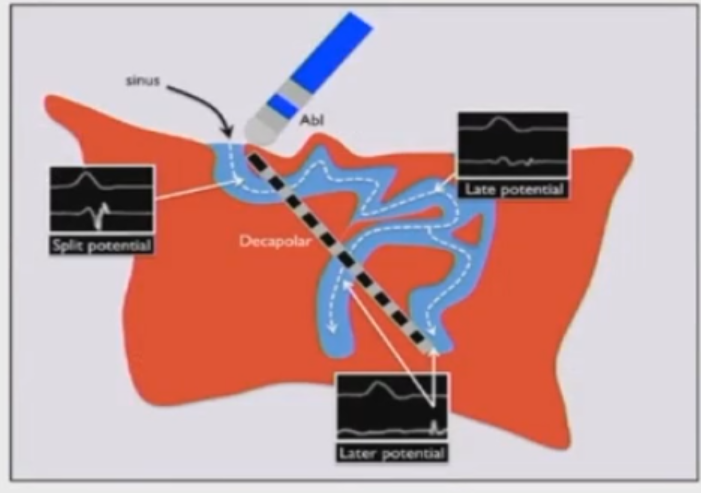
以相对较早的LPs为靶点,可以加速疤痕同质化,而不需要对所有LPS都进行消融。
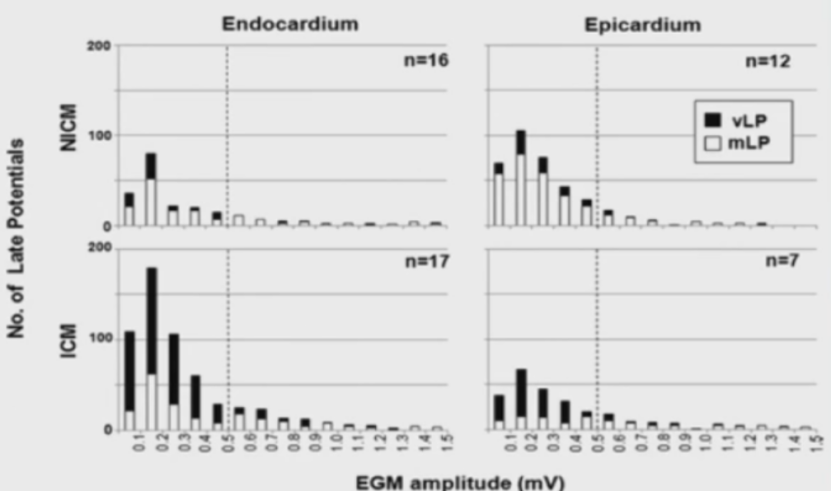
NICM患者晚电位标测的局限: 发生概率低,且不可靠
NICM患者室速消融时,其晚电位相比于ICM患者不仅出现概率低,且常常不可靠。
Nakahara等研究发现NICM患者室速消融时,中晚期和超晚期的LP无论在心内膜还是心外膜的发生率都显著低于ICM患者。
NICM患者单纯在LP指导下消融治疗成功率比ICM患者要低得多 (50% vs.82%)。
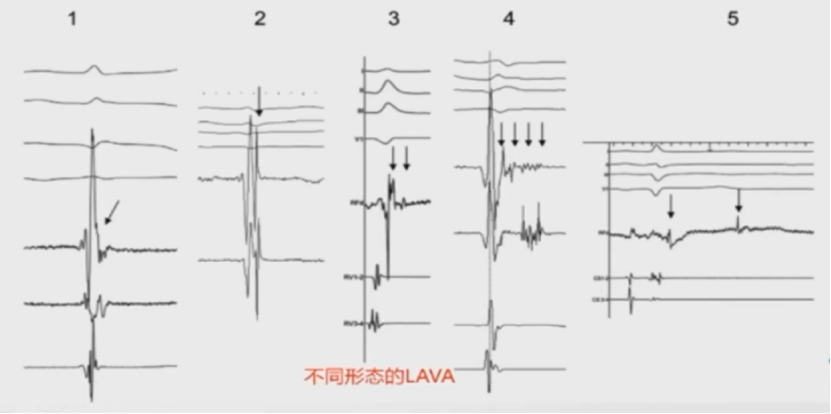
心肌病室速的基质标测——LAVA电位标测消
LAVA(Local Abnormal Ventricular Activities):高频、低幅心室电位;窦律时与心室远场电位分开,在心室远场电位后或之中;VT时在心室远场电位之前并与之分开呈碎裂、或双电位、或多种成份。
LAVA被认为是病变组织的局部电活动。
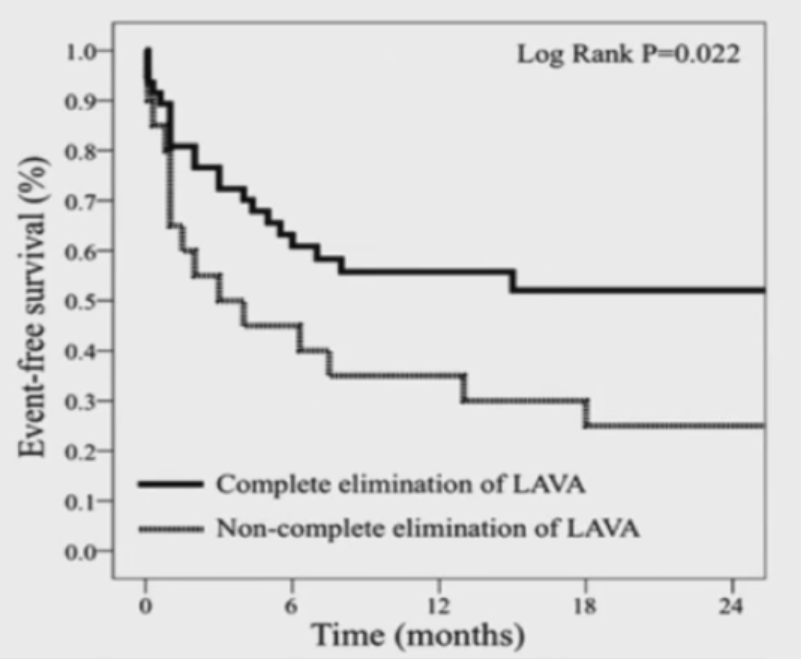
70名患者中,32位 (46%) VT复发;其中,LAVA完全消除的患者中32%复发VT:而未完全消除LAVA的患者中,75%复发VT。
单变量Cox回归分析表明: 消除LAVA是防治VT复发或死亡的独立影响因素。
心肌病室速的基质标测——窦律下的心室缓慢传导区标测
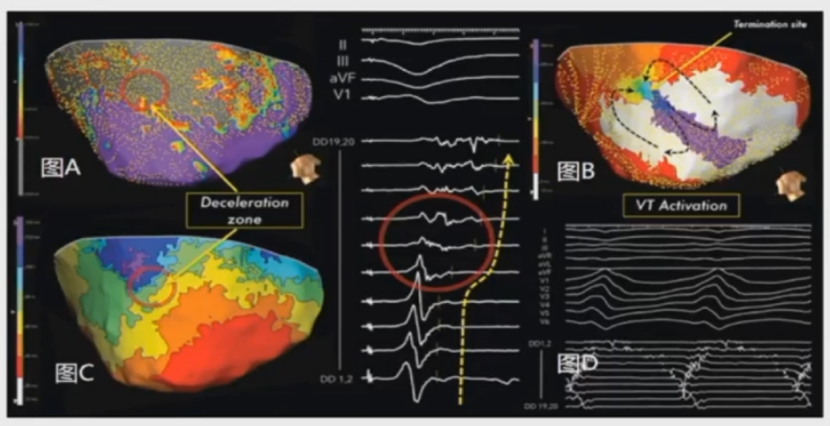
窦律下标测心室激动顺序: 色带越窄的地方传导越缓慢。
小于5mm的区域内集中了50%以上的色带,这块区域跟室速峡部的吻合度非常高。因此窦律下消融该区域即刻消除VT产生的条件。
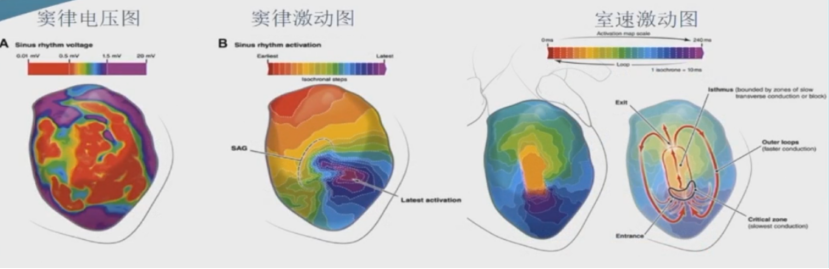
对比图A和图B: 电压图不能反映VT传导通道;对比图C和图B:窦律心室激动揭示的缓慢传导区于VT通道吻合。
图A:心室电压图:图B: VT激动顺序图:图C:窦律心室激动顺序图
Roderick Tung等对120名VT患者 (平均年龄65岁,15%女性),总共进行了144次疤痕相关VT的消融。
窦律下高密度标测,平均识别2±1个DZ,95%的病例中与VT成功终止点吻合。
总消融时间的中位数是29min,18%消融在低电压区。
术后12±10个月,70%无VT复发,总存活率87%。
结论:窦律下的缓慢传导区可以预测VT消融终止区;证明缓慢传导区与室速高度相关,是折返的关键通道。
NICM患者VT消的长期预后

方法
共282位非缺血性扩张型心肌病VT患者 (年龄59±15,80%男性)。
标测方式:
对可耐受VT: 激动标测、拖带标测;对不可标测VT:起搏标测,特殊电位标测。
心外膜标测条件:
①12导联VT体表ECG提示心外膜来源
②影像检查提示心外膜基质变化
③心内双极电压无异常的区域标测到单极电压异常 (<8.3 m v)
④心内膜消融无效
最终9 0 (3 2%)位患者接受心外膜消融。
消融靶点:对可耐受VT,消融关键峡部;对不可耐受VT,窦律下改良基质。
消融终点: 消除所有临床VT、可标测的非临床VT,可诱发的CL>250ms的VT。
随访时间:平均随访19-67个月,中位数48个月。
导管消融结果:60个月无VT复发概率69 %。

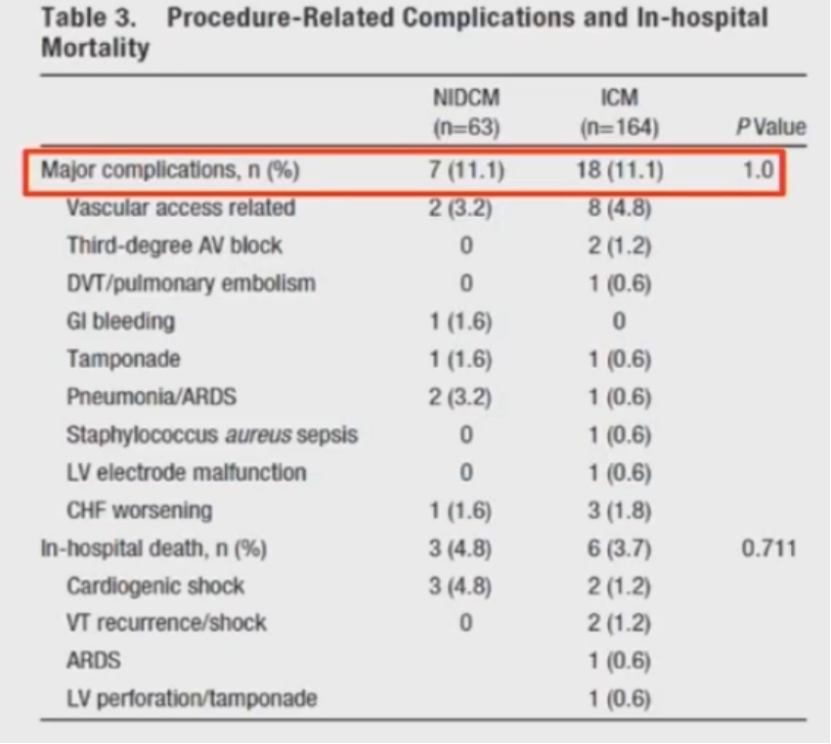
并发症
442次手术中,出现19 (4%)例并发症。

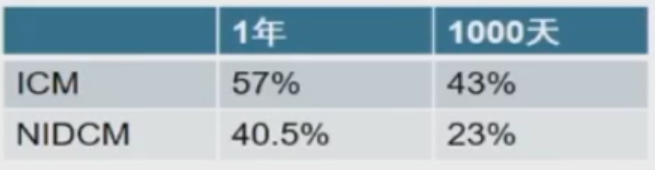
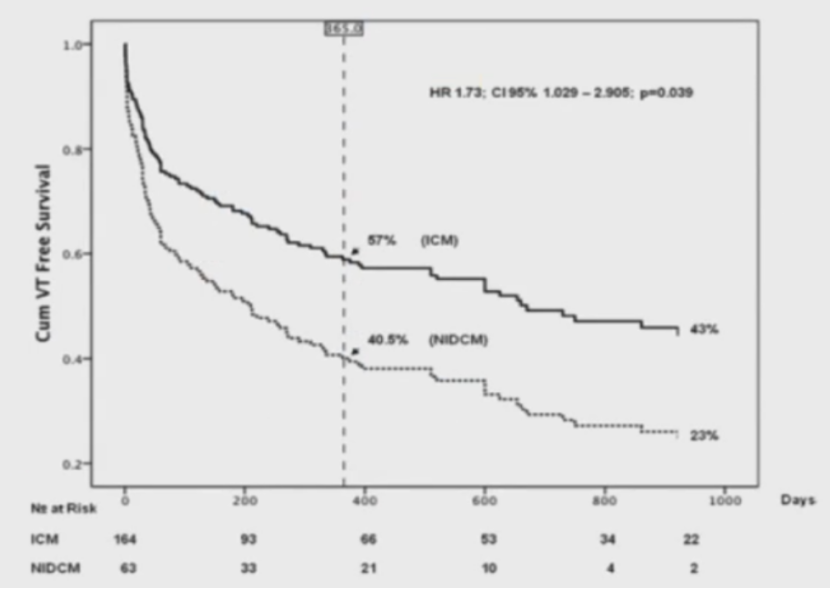
导管消融结果比较:扩张型非缺血性心肌病室速vs缺血性心肌病室速

方法
共227位患者:NIDCM 63位,ICM 164位
心外膜标测条件:体表ECG提示心外膜起源;心内膜消融无效;心内膜未标测到连续的致密疤痕。
标测方法:可耐受VT,激动标测+拖带标测确定传导峡部;不可耐受VT,基质标测+有限的激动标测+起搏标测。
基质标测电压设定: 0.5-1.5mv。心外膜电位>80ms、碎裂或晚电位。
手术终点:不能诱发任何临床或非临床VT。
消融结果:即刻成功率无显著差异
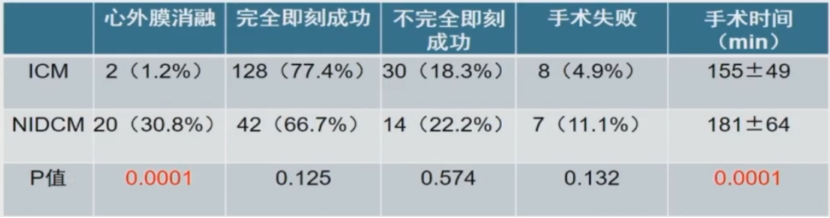
完全即刻成功:不能诱发任何VT
部分即刻成功:仅消融临床室速
并发症发生率无显著差异。
远期成功率,NIDCM远低于ICM。
心肌病室速导管消融局限
心肌病室速导管消融远期成功率不尽人意的原因:
心肌病是进展性疾病,心肌疤痕会随着时间扩展,产生新的的室速基质;
NICM室速常常涉及心外膜疤痕参与,心外膜覆盖厚厚的脂肪层使得导管消融能量无法到达目标心肌;
有时心外膜靶点靠近冠脉,导管消融风险太高,无法消融;
NICM室速折返环有可能包含心肌中层疤痕,或者室速的起源就是在心肌深层,导管消融能量无法到达。
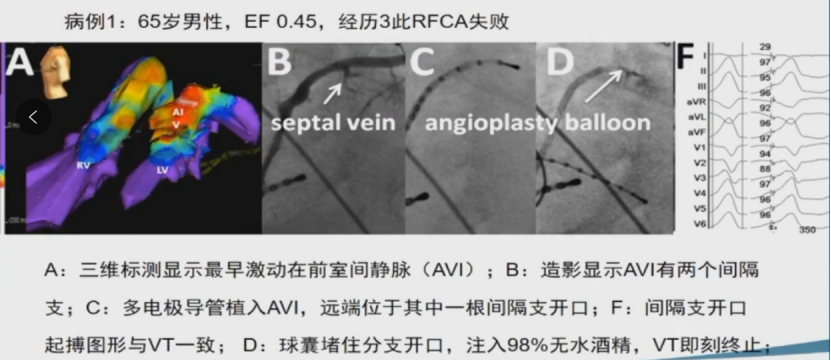
酒精化学消融有时可作为补充消融手段。
酒精化学消融机制
高浓度乙醇 (CH3CH2OH) 可溶解细胞膜并改变蛋白质三级结构,从而破坏细胞。这就是其能够成功消融心律失常的机制。需要通过使用造影球囊向为心律失常基质供血的冠脉分支注射乙醇。
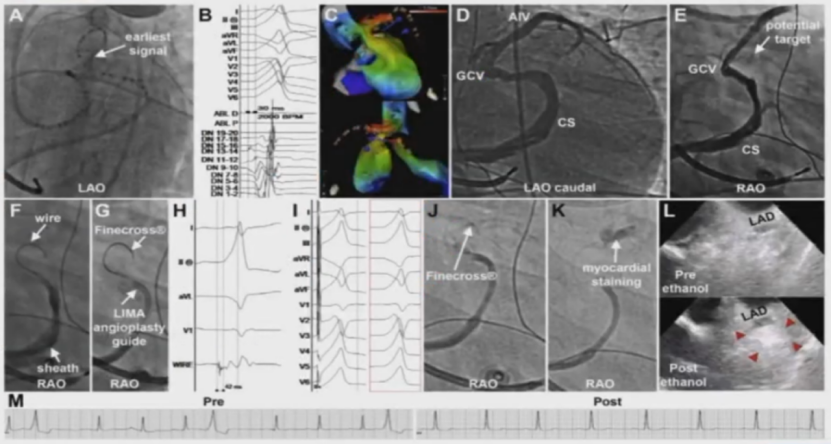
逆行冠状静脉酒精消融(RCVEA)
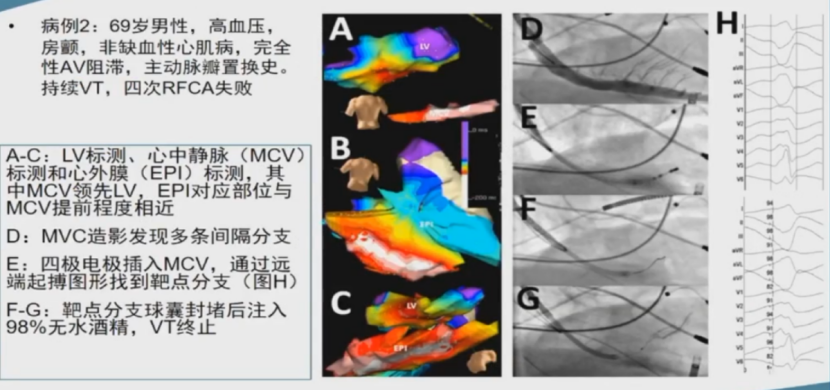
RCVEA——左室summit(LVS)区域的应用
总结
心肌病室速的治疗,导管消融可以显著降低室性心动过速心律失常复发,改善远期心血管相关住院或死亡的复合终点,并减少ICD的治疗需求。
对不同的心肌病室速病人应灵活采用多种标测和消融策略。
NICM VT患者因以下原因,其远期成功率比ICM显著降低:
①更离散的疤痕分布;
②进展性的基质恶化;
③更多涉及心外膜基质变化;
④双极电压图不能准确反映心外膜和中层心肌基质
⑤VT机制更多样。


