Cell子刊:金钢/高栋/陈洛南/杨巍维/尹慧勇发现化疗耐药胰腺癌的治疗新靶点
时间:2023-08-21 11:39:13 热度:37.1℃ 作者:网络
代谢重编程被认为是一种新的化疗耐药机制,但胰腺导管腺癌(PADCs)的代谢特征仍不清楚。
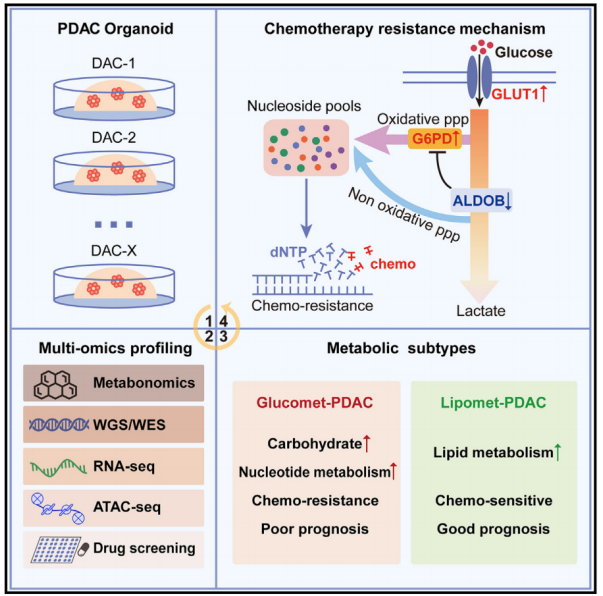
2023年8月18日,海军军医大学金钢、中国科学院分子细胞科学卓越创新中心高栋、陈洛南、杨巍维及中国科学院上海营养与健康研究所尹慧勇共同通讯在Cell Reports Medicine 在线发表题为“Metabolic classification suggests the GLUT1/ALDOB/G6PD axis as a therapeutic target in chemotherapy-resistant pancreatic cancer”的研究论文,该研究描述了PDAC类器官的代谢组学特征,并将它们分为glucomet-PDAC(高糖代谢水平)和lipomet-PDAC(高脂代谢水平)。glucomet-PDACs比lipomet-PDACs对化疗的抵抗力更强,葡萄糖醛PDAC患者的预后更差。综合分析表明,GLUT1/醛缩酶B(ALDOB)/葡萄糖-6-磷酸脱氢酶(G6PD)轴通过重塑葡萄糖代谢诱导化疗耐药性。
在具有高GLUT6和低ALDOB表达的glucomet-PDAC中鉴定出糖酵解通量增加,G1PD活性和嘧啶生物合成增加,这些表型可以通过抑制GLUT1表达或增加ALDOB表达来逆转。GLUT1或G6PD的药理学抑制增强了glucomet-PDAC的化疗反应。该研究揭示了与PDAC化疗敏感性差异相关的潜在代谢异质性,并通过化疗和GLUT1 / ALDOB / G6PD轴抑制剂的组合为化疗耐药性glucomet-PDAC患者开发了一种有希望的药理学策略。

胰腺导管腺癌(PDAC)是最致命的恶性肿瘤之一,其5年生存率为11%。化疗可显著延长PDAC患者的生存期,但由于耐药机制复杂且不明确,PDAC患者的化疗有效率仍然较低。尽管许多研究都集中在基于基因组和转录组特征的PDAC分类上,但目前定义的PDAC特征并不能指示化疗敏感性或指导治疗决策。代谢重编程被认为是一种新兴的治疗耐药机制,并为癌症治疗提供了机会。然而,由于大量基质细胞的存在,很少有研究检测PDAC的代谢失调和异质性,这使得获取精确的肿瘤特异性代谢物信息变得困难。因此,系统地表征PDAC的代谢和基因组图谱可能揭示化疗敏感性的潜在分子细节,并促进靶向治疗的发展,以预防或逆转化疗耐药。
由于代谢改变是癌症的标志之一,因此人们对代谢(特别是葡萄糖代谢)与PDAC启动,进展和治疗耐药性之间的关系越来越感兴趣。先前的研究已经在糖酵解、脂肪生成和氧化还原途径中具有不同代谢物水平的PDAC细胞系中进行,这些细胞系对多种代谢抑制剂表现出明显的敏感性。此外,个体PDAC肿瘤内的代谢异质性已被确定有助于OXPHOS抑制剂的治疗耐药在小鼠模型中,KRAS突变和缺氧是已知的PDAC糖酵解途径的诱导剂。
在小鼠模型中,通过条件性失活Nsdhl或他汀类药物治疗破坏远端胆固醇生物合成可将经典表型转换为基础表型。根据糖酵解和胆固醇生成基因的中位标准化表达,鉴定出四种代谢表达亚型,糖酵解肿瘤的中位生存期最短。这些研究强调了表征代谢特征和确定PDAC细胞存活和化疗耐药的基本途径的必要性,这可能提供一个治疗窗口。
机理模式图(图源自Cell Reports Medicine)
患者来源的癌症类器官已经成为一种研究模型,并且在再现原发肿瘤的特征方面已被证明优于传统细胞系。该研究建立了一个大型的PDAC类器官生物库,并通过多组学整合分析对这些类器官进行了表征。在这里,作者表征了PDAC类器官的代谢特征,并确定了两种代谢亚型,称为glucomet-PDAC(高糖代谢)和lipomet-PDAC(高脂代谢)。作者发现GLUT1/醛缩酶B (ALDOB)/葡萄糖-6-磷酸脱氢酶(G6PD)轴调节葡萄糖代谢重编程并赋予glucomet-PDAC化疗耐药。此外,该研究提出了一种潜在的药理学策略,包括靶向GLUT1/ALDOB/G6PD轴,以增强glucomet-PDAC的治疗敏感性。
原文链接:
https://doi.org/10.1016/j.xcrm.2023.101162


