Science:抗肿瘤免疫的线粒体代谢机制
时间:2023-09-24 08:15:23 热度:37.1℃ 作者:网络
肿瘤是由异常增生的细胞组成的,它们需要能量来生长和繁殖。线粒体电子传递链(ETC)是一种生物化学过程,产生了细胞内的能量,通常用于满足这些能量需求。电子传递链由多个复合组成,其中复合I(CI)和复合II(CII)是其中两个重要的组件,它们在启动电子流传递中起到关键作用。
2023年9月21日,美国Salk生物学研究所Susan M. Kaech和Gerald S. Shadel合作,发现失去CII会导致通过丙酸盐(succinate)介导的转录和表观遗传学活化,增加了主要组织相容性复合物-抗原处理和呈递(MHC-APP)基因的表达。这会增强抗原呈递和T细胞介导的杀伤,有助于免疫系统更有效地攻击肿瘤。相关论文以Manipulating mitochondrial electron flow enhances tumor immunogenicity为题,发表在Science期刊上。共同第一作者是美国Salk生物学研究所的Kailash Chandra Mangalhara和Siva Karthik Varanasi。

同期科隆大学医学院Christian Frezza和Andromachi Pouikli在Science发表了题目为“Metabolic control of antitumor immunity”的评论,评论指出这项研究发现了线粒体代谢和免疫原性之间的关联,为免疫学和以丙酸盐积累为特征的疾病研究提供了广泛的启示。

【降低线粒体CII活性增强抗肿瘤免疫反应】
研究使用小鼠黑色素瘤细胞模型,分别删除了CI或CII的亚基,并将这些细胞移植到小鼠中观察其影响。结果显示,CII的删除显著减缓了肿瘤生长速度,并增加了免疫细胞,尤其是CD8+ T细胞的浸润。这说明CII的缺失可以通过增强抗原呈递,引发更强烈的抗肿瘤免疫反应。与之相反,CI的删除对肿瘤生长没有影响。
值得注意的是,尽管CII的功能丧失可能在人类中促使一些罕见肿瘤的发生,但这是因为大多数致癌性CII突变是遗传性的,并且存在于特定肿瘤类型中。因此,在这些情况下,CII的丧失在肿瘤形成的早期起作用。然而,该研究表明,CII的减少通过增加抗原呈递减缓了肿瘤的生长,这是由于免疫系统的攻击导致的。因此,这些研究结果强调了CII在肿瘤免疫中的重要作用,为了解肿瘤发展和免疫反应之间的关系提供了重要见解。
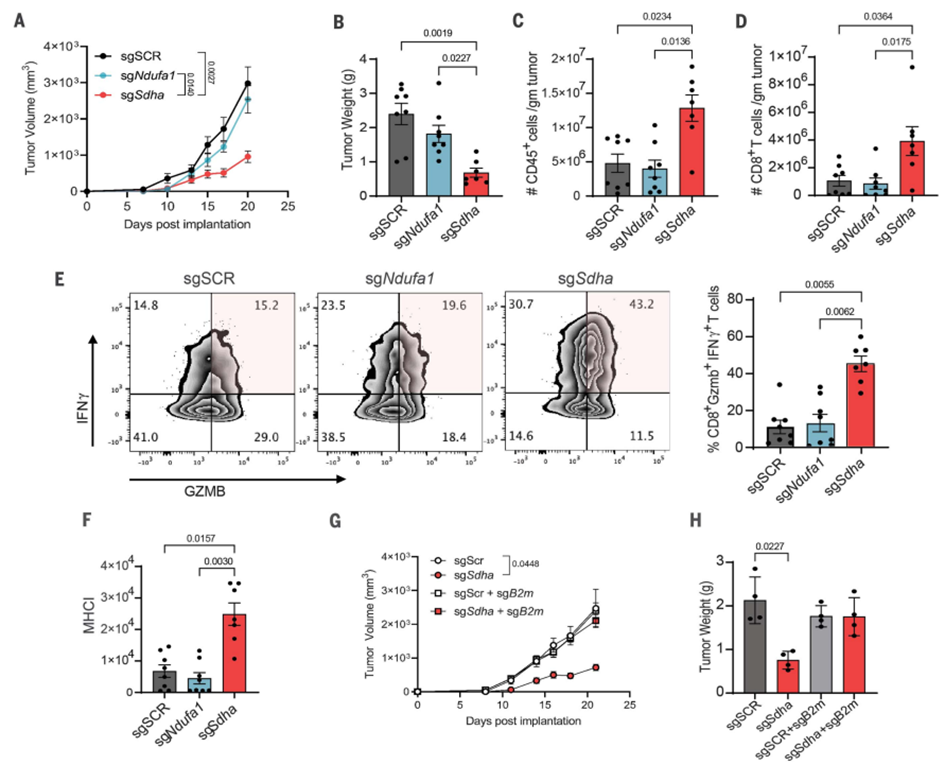
图1 线粒体CII抑制通过增加MHC-I增强抗肿瘤免疫。
【线粒体丙酸盐增加肿瘤抗原呈递,独立于IFN信号通路】
研究发现,CII(复合II)的缺失或抑制会导致肿瘤细胞表面MHC-I(主要组织相容性复合物类I)的表达增加,这有助于提高抗原的呈递。这个效应不仅仅出现在特定细胞系(如YUMM1.7、4T1等)中,而且还在多种小鼠肿瘤细胞和纤维母细胞中观察到。研究还发现,CII的抑制增加了多个主要组织相容性复合物-抗原处理和呈递(MHC-APP)基因的转录,这是MHC-I的组成部分。通过将线粒体CII抑制物的作用转移到携带模型抗原的细胞中,研究还证实CII抑制增加了抗原的呈递。
进一步研究表明,线粒体CII抑制通过促使丙酸盐积累来驱动MHC-APP基因的转录。丙酸盐是CII的底物之一,它在CII抑制的细胞中大量积累。当细胞暴露于可渗透的丙酸盐时,也会增加MHC-I的表达和MHC-APP基因的转录。此外,将细胞置于缺乏谷氨酸的环境中可以减少CII抑制引起的丙酸盐积累以及MHC-I和MHC-APP基因的表达。最后,通过减小CII敲除细胞中2-氧戊二酸脱氢酶的表达,也可以降低丙酸盐水平和MHC-I的表达。
值得注意的是,这项研究发现,CII抑制通过增加丙酸盐积累来提高MHC-APP基因的表达,而不依赖于IFN信号通路。这对于那些通过降低MHC-APP基因表达或不响应IFN-g来逃避免疫系统的癌细胞具有重要的治疗意义。这个发现有望为开发新的肿瘤免疫治疗方法提供启示。
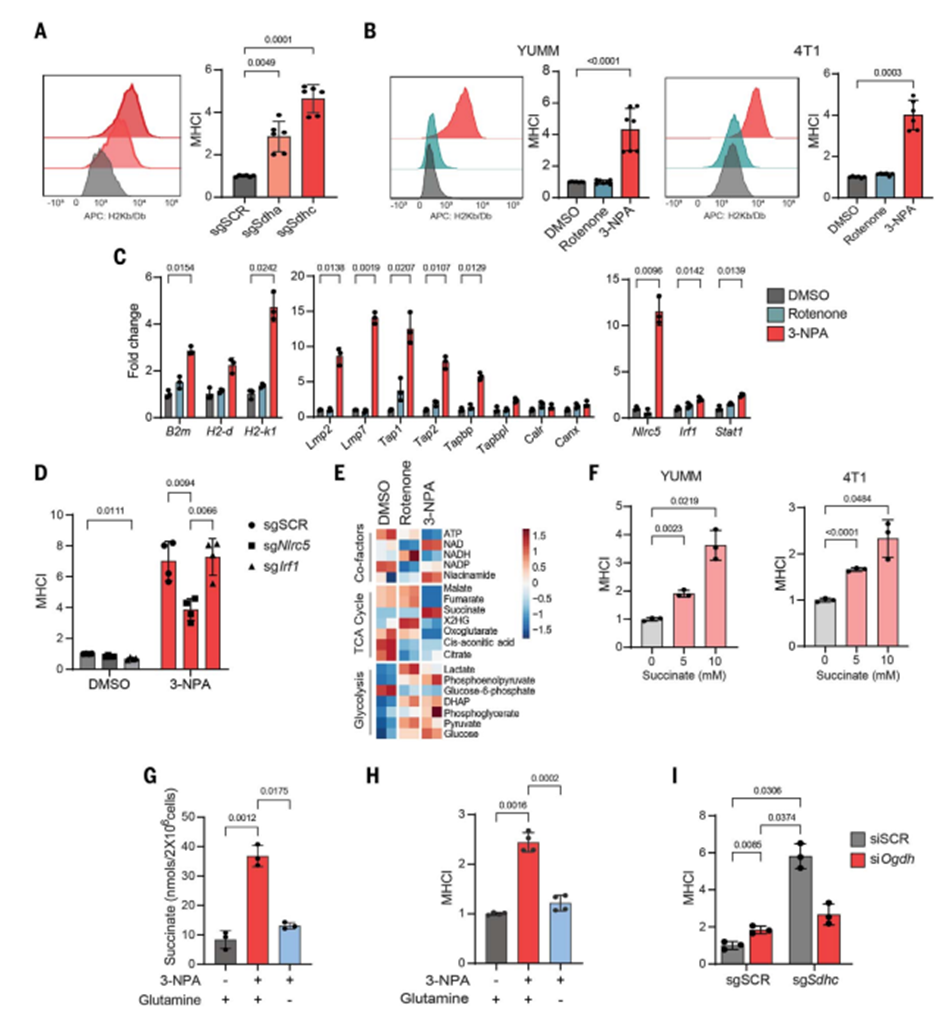
图2 线粒体丙酸盐在CII抑制时驱动MHC-I的表面和基因表达。
【线粒体丙酸盐通过抑制组蛋白去甲基化酶和调节肿瘤表观遗传景观,增加了MHC-APP基因的转录】
研究发现,线粒体CII(复合II)的抑制或丙酸盐的添加可以显著降低细胞内α-酮戊二酸(aKG)/丙酸盐比值,进而增加与调控转录有关的组蛋白H3上的多个赖氨酸残基的三甲基化水平。这些改变导致MHC-APP基因的转录上调,有助于增强抗原的呈递。
研究还发现,丙酸盐通过抑制KDMs(特别是KDM4和KDM5家族的H3K4me3去甲基化酶)的活性,改变了组蛋白去甲基化修饰和甲基转移酶之间的平衡。这导致了组蛋白的增甲基化,尤其是H3K4me3和H3K36me3,这两者与抗原呈递相关。
研究还进行了染色质免疫共沉淀测序(ChIP-seq)实验,以研究线粒体CII抑制对整体表观遗传重编程的影响。结果显示,在YUMM1.7细胞中,CII抑制显著增加了H3K4me3和H3K36me3的信号,表明这种改变在全基因组范围内发生。这些改变可以通过添加α-酮戊二酸来逆转,进一步验证了丙酸盐介导的CII抑制对组蛋白修饰和基因转录的影响。
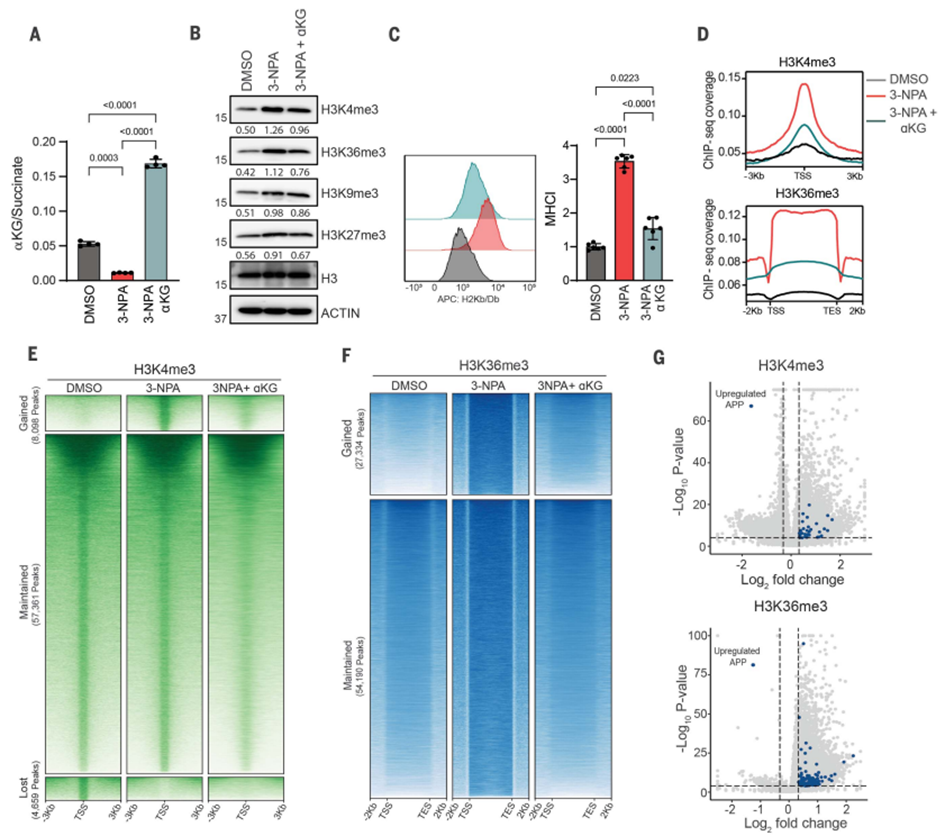
图3 线粒体丙酸盐通过改变组蛋白甲基化调节抗原呈递。
【增加通过线粒体CI的相对电子流增强了肿瘤的免疫原性和T细胞受体(TCR)多样性】
通过调整线粒体电子传递链(ETC)以减少CII活性,使丙酸盐在肿瘤细胞内积累,从而增加抗原呈递并激活T细胞介导的杀伤作用。研究团队考虑了重构ETC以促使电子流从CI流向CIII的超复合物的形成。通过敲除线粒体内膜上的内源性CI互作蛋白MCJ,可以增加CI活性,形成超复合物,减少CII的贡献,从而增加丙酸盐的积累。结果表明,MCJ敲除(Mcj-KO)导致肿瘤细胞内丙酸盐水平升高,增加了抗原呈递、MHC-APP基因表达以及MHC-I的水平。
进一步的研究发现,在MCJ-KO肿瘤中,CD8+T淋巴细胞的数量增加,这些细胞表现出更高的抗原信号和表达MHC-I,这有助于控制肿瘤生长。单细胞转录组学和TCR测序的结果表明,MCJ-KO肿瘤中的CD8+T细胞具有更高的多样性和更广泛的抗原特异性,这些细胞在肿瘤免疫应答中起到了关键作用。
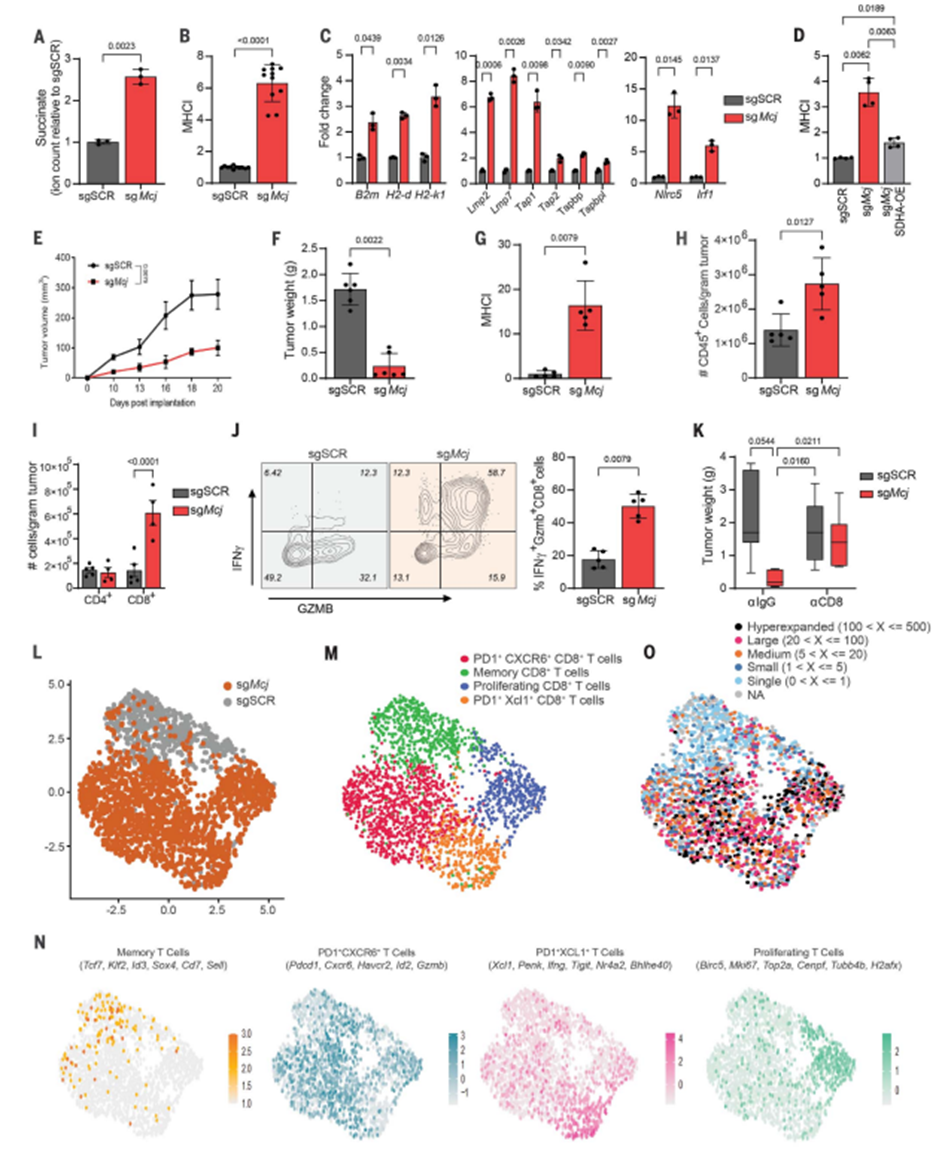
图4 线粒体CI抑制物MCJ的敲除重构了ETC以增强肿瘤免疫原性,而不降低氧化磷酸化:治疗概念的验证。
【小结】
总之,研究发现在肿瘤生长过程中,线粒体电子传递链(ETC)的复合I(CI)和复合II(CII)对于启动电子流的相对贡献有着不同的作用。研究结果显示,失去CII(但不是CI)会通过增强抗原呈递和T细胞介导的杀伤来减少黑色素瘤肿瘤的生长。这一效应是通过丙酸盐介导的转录和表观遗传学激活主要组织相容性抗原-抗原处理和呈递(MHC-APP)基因实现的,而这一过程与干扰素信号独立。此外,通过敲除甲基化受控的J蛋白(MCJ),以促使电子首选通过CI进入,为通过重构ETC以实现抗肿瘤反应提供了概念验证。这一方法可以在不影响非癌细胞的线粒体呼吸的整体减少的副作用下实现抗肿瘤效应。这一研究结果为那些MHC-APP表达降低的肿瘤提供了潜在的治疗可能性,因为MHC-APP表达降低是癌症免疫逃避的常见机制。
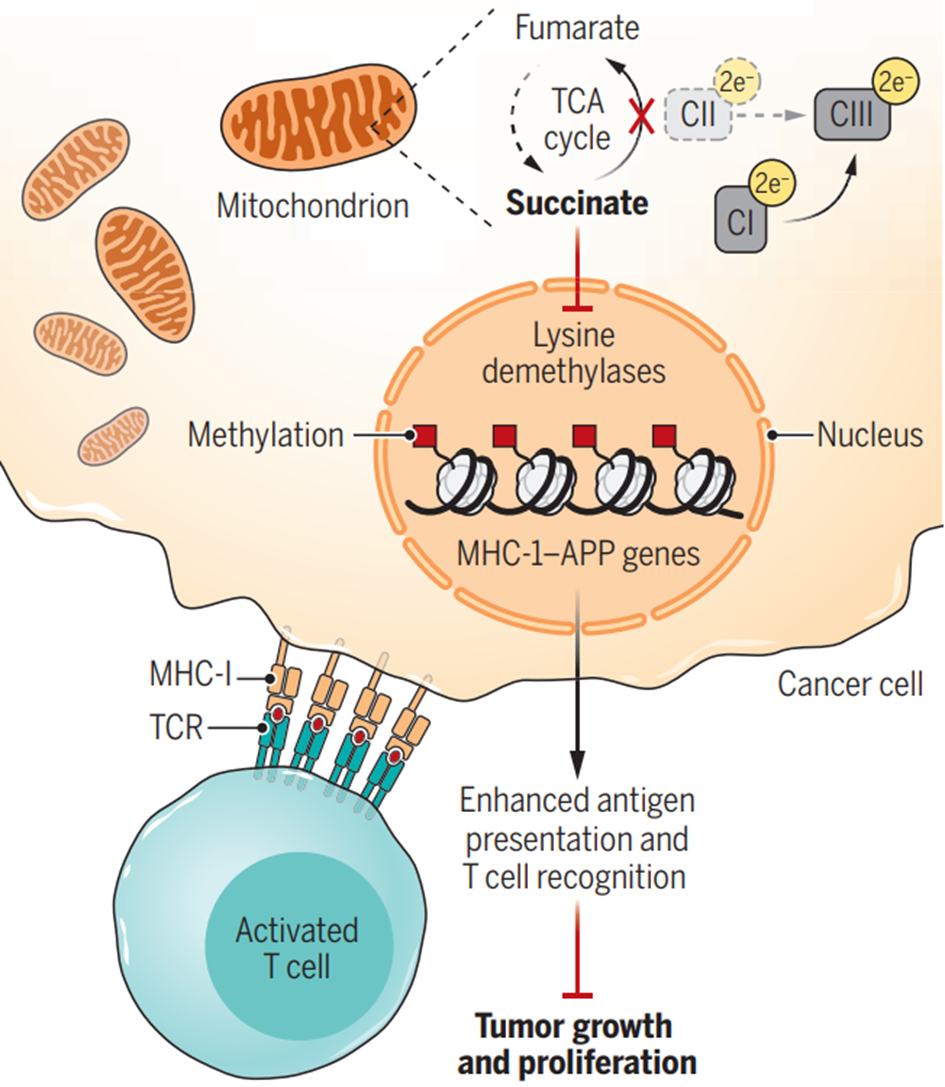
图5 新陈代谢变化停止了肿瘤生长。线粒体中复合II活性的丧失以及随之而来的丙酸盐的积累抑制了细胞核中的赖氨酸去甲基化酶。这导致组蛋白甲基化增加,尤其是在MHC-1-APP基因上,从而诱导它们的转录。由此产生的增强抗原呈递和T细胞活性阻止了黑色素瘤的生长。
原文链接:
https://doi.org/10.1126/science.abq1053
https://doi.org/10.1126/science.adk1785


