复旦大学附属中山医院葛均波院士团队《STTT》:肠道菌群依赖的色氨酸代谢产物吲哚3甲醛在动脉粥样硬化进展中的作用
时间:2023-10-11 11:30:24 热度:37.1℃ 作者:网络
动脉粥样硬化是多因素驱动的慢性炎症性疾病,血管炎症伴随着动脉粥样硬化的发生、发展直至其斑块破裂的整个过程。众多研究表明“饮食营养-肠道菌群-代谢物”轴密切参与动脉粥样硬化的发生发展,靶向干预“饮食营养-肠道菌群-代谢物”轴,为预防和延缓动脉粥样硬化进展,减少心血管疾病死亡提供新的治疗靶点。

2023年10月4日,复旦大学附属中山医院葛均波/张书宁和孙爱军团队于《Signal Transduction and Targeted Therapy》杂志在线发表了题为“Gut microbe-derived metabolite indole-3-carboxaldehyde alleviates atherosclerosis”的论文。该研究揭示了肠道菌群代谢物吲哚3甲醛(ICA)可延缓动脉粥样硬化发展。
在本研究中,葛均波团队人员发现动脉粥样硬化患者相比健康个体血浆ICA浓度较低,而色氨酸水平没有差异(图1a-d)。肠道菌群已被证实参与色氨酸代谢,研究人员利用宏基因组学发现动脉粥样硬化小鼠肠道内拟杆菌科和乳酸杆菌科丰度显著降低(图1e-f),而上述菌种被证明参与降解色氨酸。特定的肠道菌群缺失阻碍色氨酸向ICA的代谢。
长期饮食干预ICA可显著缓解小鼠主动脉的斑块面积(图1g-h)。体外水平上,ICA降低了血管细胞粘附分子(VCAM)、C-C基序趋化因子配体2 (CCL2)和白细胞介素- 6 (IL6)的基因表达(图1i),并缓解细胞内氧化应激水平(图1j)。
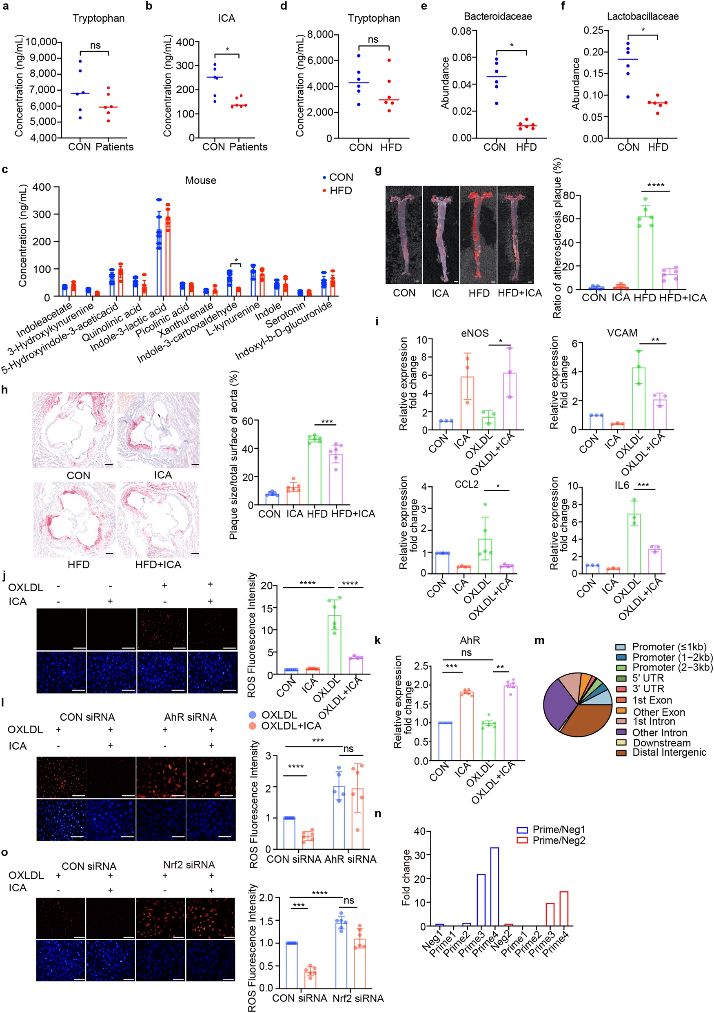
图1. 肠道菌群代谢物ICA缓解动脉粥样硬化发展
(图源:Lu et al., Signal Transduction and Targeted Therapy. 2023)
ICA含有芳香烃化学结构,通过激活芳香烃受体(AhR)从而抑制内皮细胞内炎症因子的表达及降低氧化应激水平(图1k,l)。敲低AhR后, VCAM CCL2和IL6基因表达增加,而eNOS转录水平降低。ICAM和ET-1水平未见差异。此外,ICA不再控制ROS水平(图2)。
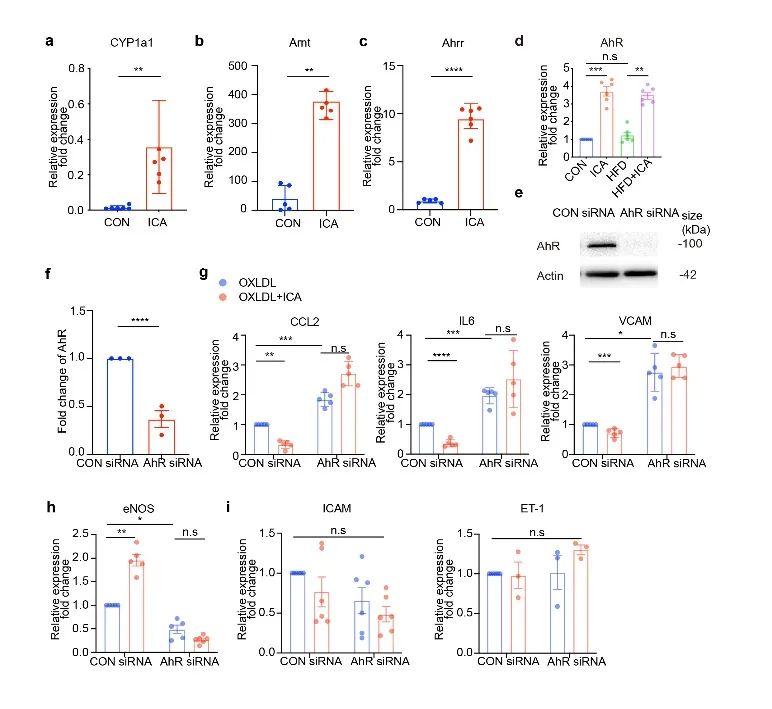
图2. ICA激活AHR缓解内皮细胞炎症水平
(图源:Lu et al., Signal Transduction and Targeted Therapy. 2023)
为进一步探究ICA如何降低ROS水平,研究人员通过CUT&TAG实验筛选AhR 调控的下游基因,同时又利用了 ChIP-qPCR 和双荧光素酶报告基因等实验证实了AHR 能与核因子红细胞系 2 相关因子 2(Nrf2)的启动子区域结合并调控其及下游基因血红素加氧酶(HO-1)的转录和表达(图1m,n和图3),从而实现其介导的抗炎症及抗氧化反应(图1o和图4)。
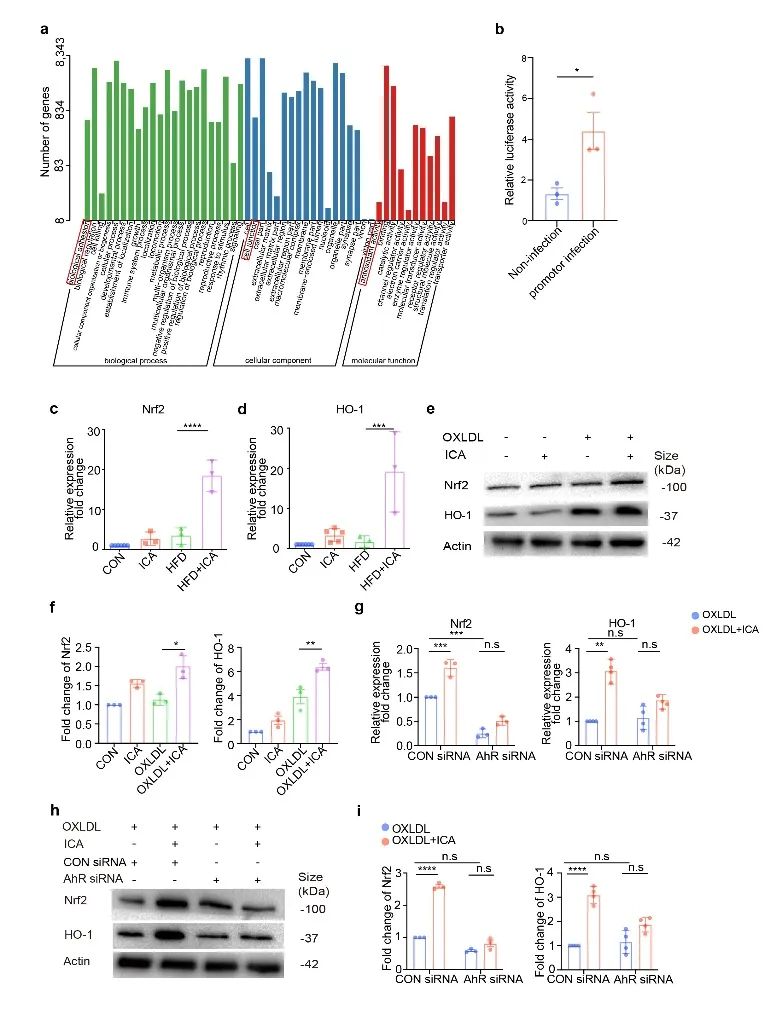
图3. AhR被激活后调控Nrf2转录表达
(图源:Lu et al., Signal Transduction and Targeted Therapy. 2023)
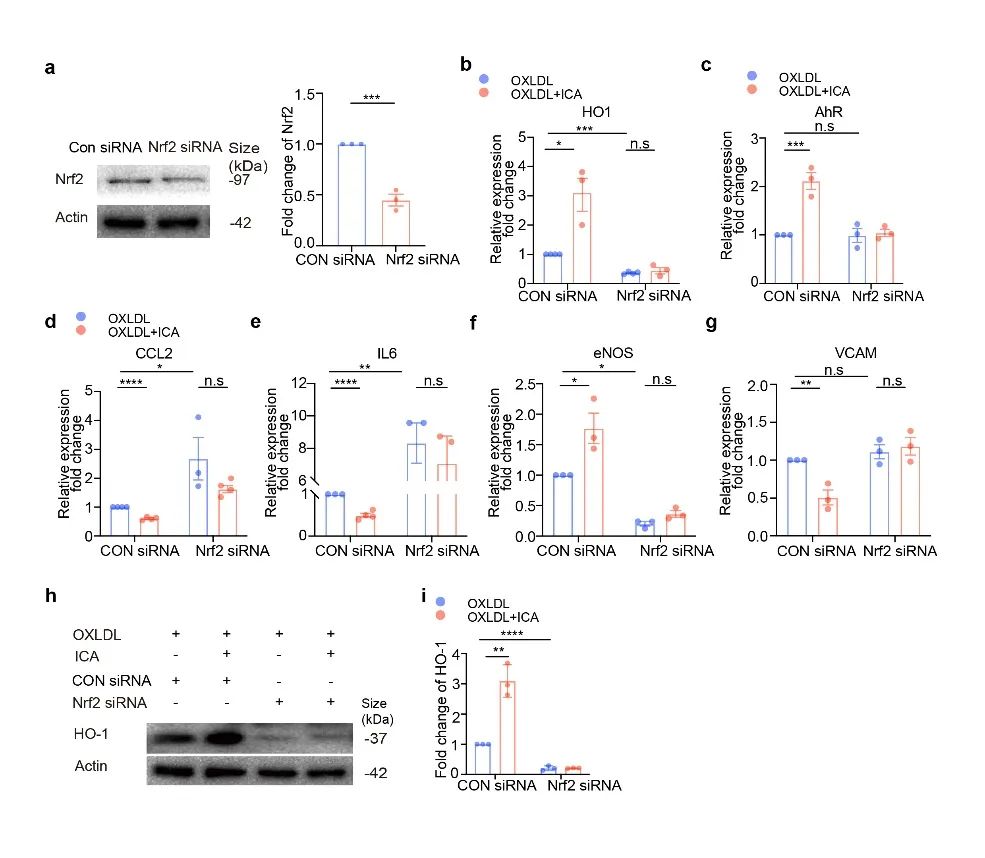
图4. AhR调控Nrf2改善内皮炎症及ROS水平
(图源:Lu et al., Signal Transduction and Targeted Therapy. 2023)
在体内实验中发现,ICA不仅降低主动脉瓣膜的过氧化物聚集,还可缓解肝脏内的氧化应激水平。后续的实验进一步证实了ICA降低小鼠炎症因子ccl2水平,并激活主动脉内皮细胞中AHR-NRF2通路(图5)。
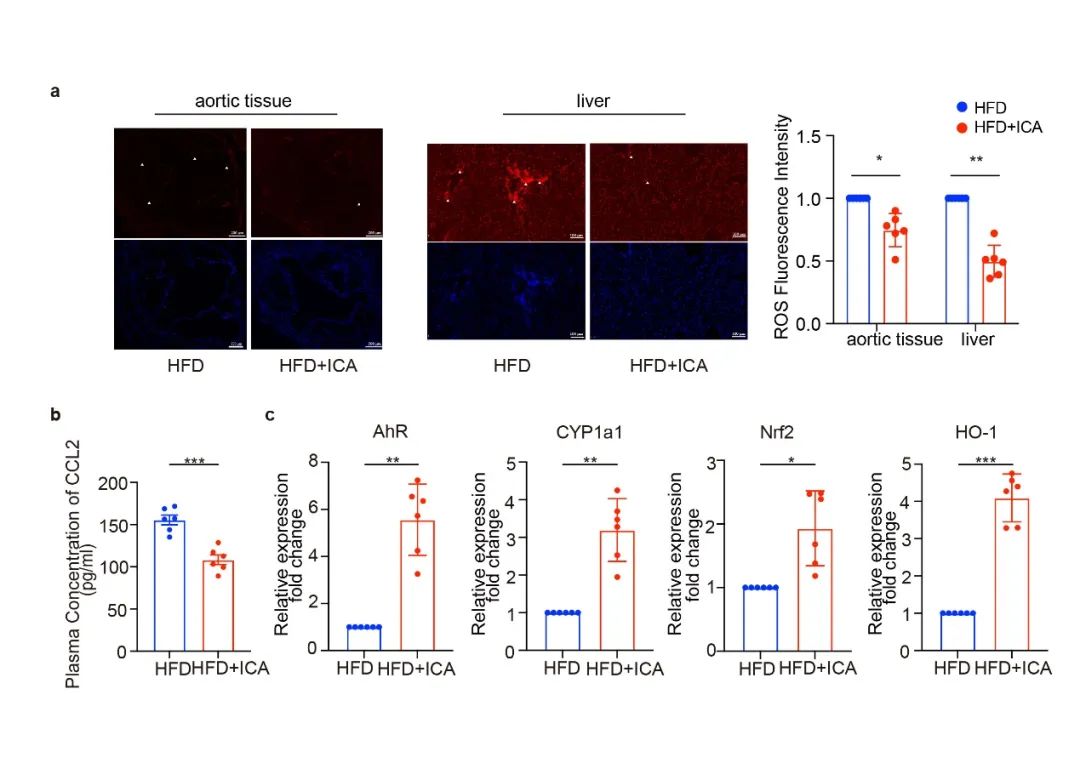
图5.体内验证 ICA抗氧化作用
(图源:Lu et al., Signal Transduction and Targeted Therapy. 2023)
综上所述,肠道菌群参与色氨酸代谢,当Bacteroidaceae或Lactobacillacea 缺失时,色氨酸肠道菌群代谢途径受损。通过饮食干预补充ICA可延缓动脉粥样硬化发展。机制上,ICA作用于内皮细胞,激活AhR后,AhR进入细胞核与Nrf2启动子区域结合从而上调Nrf2和HO-1转路和表达。ICA激活AhR-Nrf2-HO-1通路后,降低细胞内氧化应激水平,并减少促炎细胞因子的释放。研究还表明,ICA或是潜在的体内系统性的抗氧化剂,能降低主动脉组织和肝脏组织的氧化应激水平。
总之,该研究揭示了ICA通过降低内皮细胞中的ROS水平和炎症因子表达,在动脉粥样硬化中发挥了保护作用。这项工作提供了一个重要的证据,证明肠道微生物是动脉粥样硬化的潜在靶点之一。
原文链接:
https://www.nature.com/articles/s41392-023-01613-2


