文献荐读|胡兴胜教授:罕见肺癌靶向治疗的现状、挑战及前景
时间:2023-10-18 17:31:20 热度:37.1℃ 作者:网络
01 研究背景
肺癌是全世界癌症相关死亡人数最多的疾病,约占癌症相关死因的五分之一。近年来,基因测序和免疫组化技术的蓬勃发展揭示了许多罕见肺癌的独特分子特征,开启了肺癌的个体化治疗新时代。罕见肺癌亚群约占肺癌总数的10%,每年发病超过200,000 人,且其不同组织学类型具有独特的临床特征。在缺乏标准治疗的情况下,罕见肺癌患者的治疗主要遵循非小细胞肺癌(NSCLC)患者的治疗指南,但肿瘤间异质性可能导致其临床疗效不佳。随着罕见肺癌分子图谱内容不断丰富,遗传改变和免疫检查点成为了高效的靶点。
02 研究内容
一 组织病理学、流行病学特征和常见突变
大细胞癌(LCC)约占NSCLC的3.2%,在排除任何明确的形态学或免疫组化分化后的肿瘤组织中得以诊断。超过70%的LCC患者就诊时已是III/IV期,其远处转移倾向和对放化疗相对不敏感导致其预后比其他NSCLC更差。12.0%-31.6%的LCCs存在KRAS突变,以G12C突变为主;约52%的LCCs存在RTK/RAS/RAF突变。LCC患者的PD-L1阳性率为44.4% ~ 80.0%,其中27.8%~40.0%存在≥50%的肿瘤细胞染色,PD-L1抑制剂可能对LCC患者有益。
肺腺鳞癌(LASC) 为含有LUAD和LUSC混合成分的肿瘤,每种成分至少占肿瘤的10%。根据两组分的比例不同,可将LASC分为三组:腺性为主型 (LUAD >60%)、鳞状为主型 (LUSC >60%)和混合型 (各组分在40%~60%之间)。LASC多见于有吸烟史的老年男性,侵袭性强,预后差。EGFR是LASC的截断突变之一,东亚人群发生率高于西方人群,故EGFR-TKIs可能是有希望的治疗选择。此外,39.2%-70.6%的LASC患者可检测到PD-L1表达,鳞状成分表达高于腺状成分。一项回顾性研究表明,基于ICI的治疗ORR为28%,中位PFS 为6.0个月,总生存期(OS)为24.7个月。
肺淋巴上皮癌(LEC)占所有肺癌的不足1%,与EB病毒感染密切相关。其病理特征为基质中有大量淋巴细胞、浆细胞浸润。多数患者为亚洲人,平均年龄为51-57岁,无明显的性别差异。约半数患者可在早期诊断,接受手术治疗,故肺LEC的5年生存率相对较高。然而,此类肿瘤缺乏可靶向的驱动基因,即使携带致敏EGFR突变的患者也存在EGFR-TKI抵抗。此类患者PD-L1阳性率高,回顾性研究提示免疫治疗的疗效优于化疗,化疗联合免疫治疗可能是此类患者最佳的一线治疗选择。
肺睾丸中线癌(NMC)仅占所有肺癌的0.6%,是一种由NUT重排导致的高侵袭性低分化癌症,对放化疗不敏感,预后极差,中位总生存期仅2.2-2.75月。肺NMC很少有经典癌基因突变(如EGFR、KRAS、BRAF),单核苷酸变异(SNVs)为其主要突变类型,表明体细胞突变在很大程度上是乘客突变。
肺肉瘤样癌(PSC)约占所有肺癌的0.5%,包括多形性癌(PC)、梭形细胞癌、巨细胞癌、癌肉瘤和肺母细胞瘤。PSC侵袭性高,对常规全身治疗抵抗,多数患者确诊时为IV期,预后不佳。PSC患者的EGFR突变率为5.0%-22.6%,中国患者携带敏感突变的概率更高。一名携带EGFR L858R的晚期PSC患者接受厄洛替尼治疗的PFS为6个月。MET外显子14跳跃突变在2.0%~31.8%的PSC中检测到,几项针对此类患者的回顾性研究显示一线克唑替尼有部分应答。2期研究提示赛沃替尼在PSC患者中显示出良好的抗肿瘤活性,ORR为40.0%,中位PFS为5.5个月,已在我国被批准用于治疗NSCLC。此外,患者PD-L1表达阳性率较高,许多回顾性研究和病例报告证实了免疫治疗对PSC患者的疗效,且肿瘤PD-L1高表达与免疫治疗反应良好相关。
肺涎腺型肿瘤(肺SGT)仅占所有肺癌的0.1%–0.2%,包括黏液表皮样癌 (MEC),腺样囊性癌(ACC)和四种罕见亚型。患者年龄分布广泛,以中年为主,无明显的性别差异。多数肺SGT是低级别肿瘤,侵袭性弱,患者生存期相对长。此类患者多存在MAML2重排,EGFR突变率较低。细胞系研究提示非致敏EGFR突变患者的MAML2重排可能预测吉非替尼的疗效。野生型EGFR的肺MEC对EGFR-TKIs有部分应答。
二 FDA批准的靶向治疗
罕见肺癌没有标准治疗方法,也很少被纳入靶向治疗相关的临床研究。在临床实践中,通过对患者生物标志物的检测匹配可能获益的靶向治疗更为可行。目前FDA批准的NSCLC靶点包括:致敏性表皮生长因子受体(EGFR)、MET14外显子跳跃突变、KRAS点突变、血管内皮生长因子(VEGF)突变、BRAF V600E点突变、ALK融合、ROS1基因融合、神经营养蛋白酪氨酸激酶(NTRK)基因融合、RET重排和免疫检查点等。
EGFR基因编码HER/erbB受体酪氨酸激酶(RTK)家族的跨膜蛋白。突变的EGFR可触发胞内级联信号通路,促进细胞增殖、转移和血管生成,并抑制肿瘤凋亡。至今,多代EGFR酪氨酸激酶抑制剂(TKIs)已获得FDA批准,NSCLC患者已显示出相当大的生存获益。
MET的改变可以表现为外显子14跳跃突变、基因拷贝数扩增、蛋白过表达、MET基因融合等,其中MET外显子14跳跃突变是导致酪氨酸激酶过度激活的主要原因。目前已开发相关靶向药物,包括I型(如卡马替尼和赛沃替尼)和II型(如卡博替尼和格来替尼)抑制剂。新型药物如谷美替尼和伯瑞替尼已被FDA批准用于罕见病治疗,并且都正在进行II期临床试验。通常认为MET扩增是EGFR-TKIs和ALK抑制剂的一种耐药机制,近年来受到越来越多的关注。
KRAS基因是RAS基因家族(包括HRAS、KRAS和NRAS)中最常见的突变亚群,编码KRAS蛋白,介导肿瘤细胞的增殖、凋亡和分化。常见的G12C突变的靶向药物索拖拉西布和阿达格拉西布已被FDA批准用于治疗KRAS G12C突变的NSCLC患者。
VEGF基因位于6号染色体上,编码的VEGF蛋白在血管生成和内皮细胞分化中起关键作用。贝伐珠单抗和雷莫芦单抗分别是针对VEGF和 VEGFR的单克隆抗体,已被FDA批准用于NSCLC。多靶点TKIs如安罗替尼和阿帕替尼也在临床试验中得以评估。由于血管生成是癌症的标志之一,因此抗血管生成药物可以在没有特定VEGF基因突变的情况下应用。
免疫检查点指T细胞表面传递抑制信号的一组分子,包括PD-1、CTLA-4、TIM3、LAG3、TIGIT等。免疫检查点抑制剂(ICIs)可有效刺激抗肿瘤免疫,几种抑制PD-1/PD-L1和CTLA-4的ICIs已经用于NSCLC患者并取得了良好的成效。

三 潜在治疗靶点
蓬勃发展的基因检测技术加速了罕见肺癌基因组图谱的探索进程,进一步加深了人们对致癌机制的理解,有助于发现潜在治疗靶点。靶向在致癌过程中起辅助作用的分子或信号通路可能在联合治疗中有一定价值。因此,尽管匹配的靶向药物在罕见的肺癌中探索较少,以下潜在靶点值得我们关注。
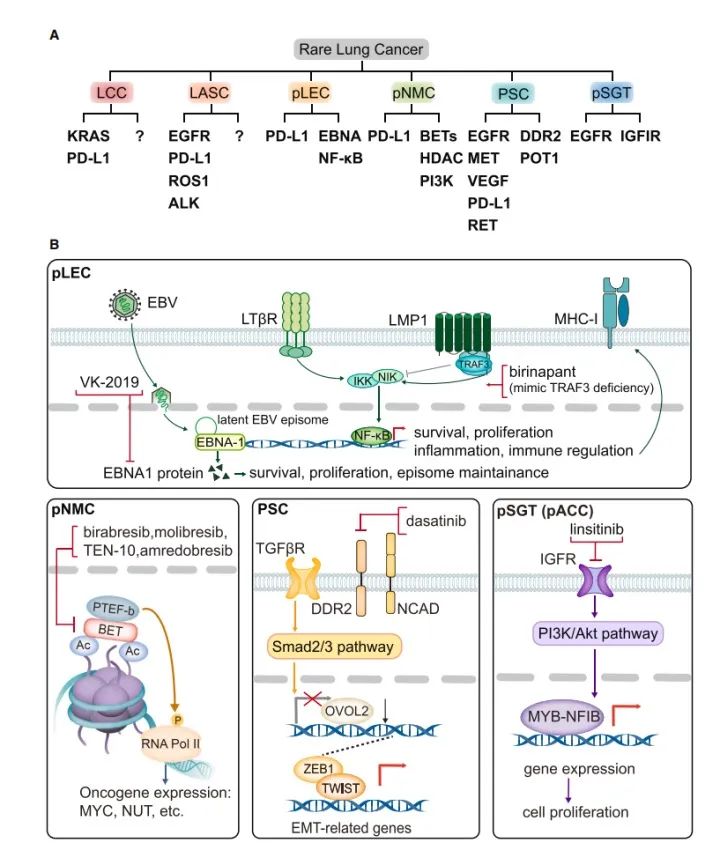
四 挑战与前景
随着先进的测序技术的发展,靶向治疗在罕见肺癌患者中得到了越来越多的探索,并显示出良好的疗效。作者将过去研究数据的突变情况进行可视化,以帮助我们探索新的治疗靶点。在未来,每一种罕见肺癌的靶向治疗方向均不同,但鉴于其罕见性共同的特点,也需要共同的解决方案。

主编评语
总而言之,近年来罕见肺癌的靶向治疗取得了长足进展,但仍有很大的发展空间。目前,罕见肺癌靶向治疗的总体原则可以用“求同存异”来描述,即我们在关注靶向治疗疗效的同时也要关注罕见肺癌是否存在与常见亚型不同的遗传或致癌特征,从而更加个体化地治疗。值得注意的是,遗传改变与组织学特征间的相关性仍需进一步明确,如进行基因组特征的对比或机制验证。未来,罕见肺癌类型可能会根据分子特征或以治疗为导向的诊断系统重新定义,从而实现更为个体化的精准治疗。


