病理干货 | 肿瘤与免疫之战:肿瘤的免疫过程与免疫治疗
时间:2023-11-18 21:21:08 热度:37.1℃ 作者:网络
免疫治疗(IO,immuno-oncology)已成为肿瘤治疗领域焦点,在多种肿瘤中展示出强大的抗肿瘤活性。肿瘤免疫过程是免疫治疗的基础,也是治疗策略和药物研发的关键。
肿瘤最初是一小团均一的上皮细胞,然后一部分细胞的极性开始消失,获得干性,胞间连接消失,紧接着上皮-间质转化(EMT)发生。与此同时,肿瘤内血管开始生长,一堆细胞浸润到肿瘤里,他们分泌乱七八糟的细胞因子和趋化因子,还被自己和其他细胞分泌的因子影响不断变化,这“一锅粥”充满了暴力黑暗和不确定性。免疫系统的免疫细胞时刻监视着其周围的细胞,一旦发现“异己”就立即发动免疫机制来清除这些“坏细胞”,然而狡猾的癌细胞在某些情况下能够通过多种机制逃避机体的免疫监视,在体内不断的增殖,最终形成肿瘤组织,至此,肿瘤建立了免疫抑制环境(肿瘤免疫微环境 TIME)[1]。
肿瘤免疫过程就像肿瘤细胞与免疫系统的战争。肿瘤免疫过程中,主要的参战部队如下[2](图1):
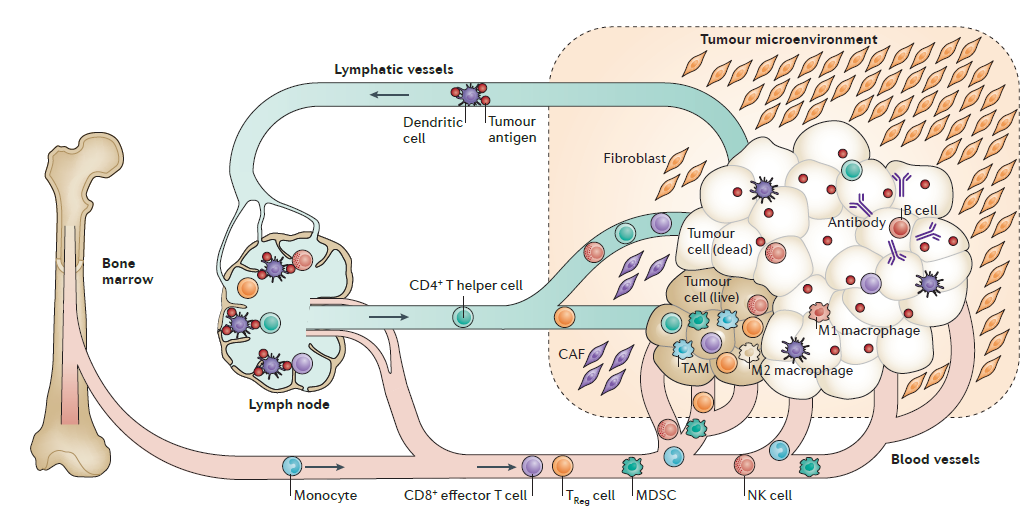
图1 肿瘤微环境及主要细胞(https:// doi:10.1038/nrd4596)
(1)NK细胞:第一轮的先天免疫反应,吞噬肿瘤细胞。
(2)树突状细胞:侵入肿瘤,吞噬肿瘤细胞,并将肿瘤抗原呈递给各种类型的T细胞(CD4+辅助性T细胞、CD8+效应性T细胞、调节性T(TReg)细胞、自然杀伤(NK)细胞),以便肿瘤引流淋巴结中激活T细胞。
(3)活化的CD4+和CD8+效应T细胞:启动肿瘤抗原。
(4)Treg细胞:抑制效应T细胞和NK细胞的杀伤效率,以防止明显的炎症和邻近的正常组织损伤。
(5)MDSCs:参与免疫抑制调节,但间接促进肿瘤的存活和生长。
(6)B细胞:产生针对肿瘤抗原的抗体,从而有助于消除肿瘤。
(7)巨噬细胞:分泌各种细胞因子,侵入并分化为肿瘤抑制(M1)和肿瘤促进(M2)谱系。
(8)成纤维细胞:帮肿瘤修工事的民工,构建肿瘤微环境,还可以分泌各种免疫抑制剂,对抗免疫部队。
(9)肿瘤细胞:最狡猾的敌人。
了解了敌我的主要人物,下面我们看看这战斗怎么打
肿瘤细胞能逐步脱离免疫系统的监视而继续生长,而免疫治疗通过增强免疫应答,打破肿瘤的免疫耐受,从而发挥抗肿瘤作用,总体可以分为四种:肿瘤疫苗(主动进攻),细胞治疗(被动免疫),免疫检查点抑制剂(免疫调控)和细胞免疫因子治疗(强化武器)。免疫疗法相继在临床中得到应用,无数患者取得了显著疗效,但仍有一部分患者对免疫疗法没有响应,人类“盲人摸象”般寻求各种各样新的治疗方案,下面小编带大家一起来简要了解下主要的治疗方法。
01 肿瘤疫苗(主动进攻)
肿瘤疫苗特异性强,安全性相对较高,并能诱导免疫系统的抗肿瘤免疫记忆而发挥持久抗肿瘤作用,根据用途的不同可分为预防性疫苗和治疗性疫苗,前者可控制肿瘤的发生,后者用于术后的辅助治疗。预防性疫苗如HBV乙肝疫苗、HPV宫颈癌疫苗已经得到广泛应用。治疗性疫苗是肿瘤疫苗最主要的方向,截至2022.3.22,clinicaltrials网站上肿瘤疫苗相关临床研究登记,共1341项。走到III期临床试验的肿瘤疫苗,多数针对适应症为非小细胞肺癌、黑色素瘤、乳腺癌等,目前仅有125项,绝大多数肿瘤疫苗临床试验以未见总体生存期改善而失败。

图2 clinicaltrial网站上肿瘤疫苗相关临床研究登记(https://www.clinicaltrials.gov)
02 细胞治疗(被动免疫)
细胞治疗目前被广泛应用于血液肿瘤中,是一种非常有前景的癌症治疗方法,通过培养和激活大量效应细胞,增强对抗肿瘤的免疫应答,是治疗很多癌症类型的非常有前景的方法,尤其在大部分晚期肿瘤上。细胞治疗主要包括TIL、CAR、LAK、DC、CIK、TCR、CAR、NK、TCR-T和CAR-T几大类。近年来,大部分临床焦点集中在自适应T细胞,现在有越来越多的证据表明,先天免疫细胞具有许多适应性免疫的特征,NK细胞、细胞因子诱导的杀伤细胞(CIK)、树突状细胞(DC)、自然杀伤T细胞(NKT),成为癌症免疫反应中的“中流砥柱”[3]。
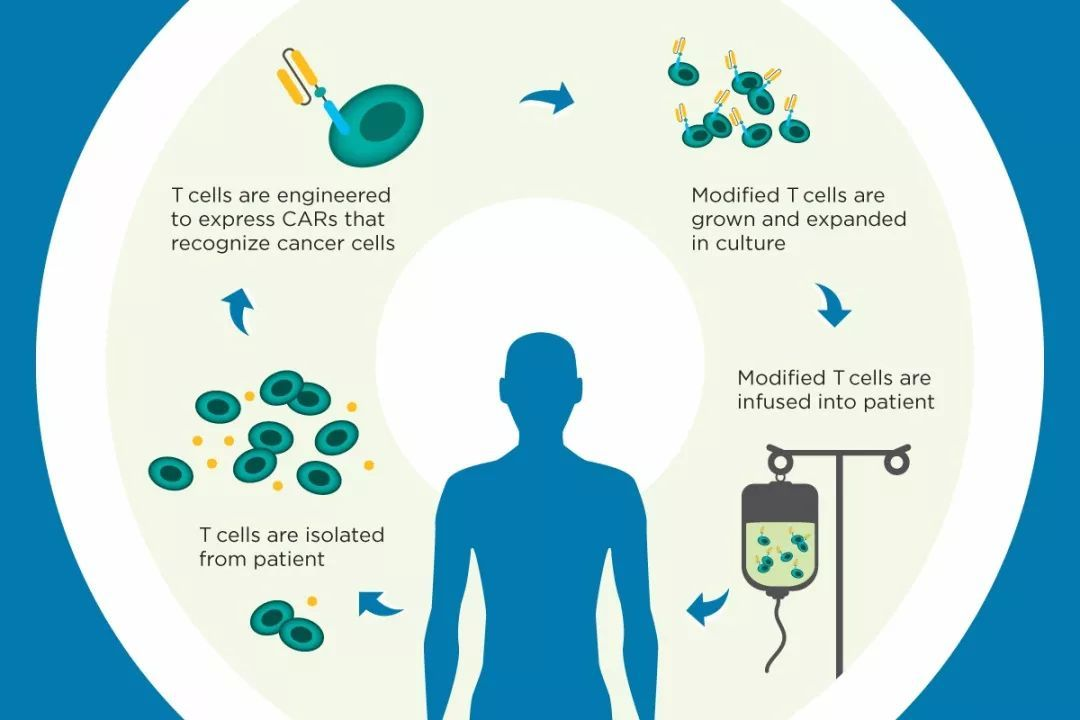
CAR-T细胞疗法(Memorial Sloan Kettering Cancer Center)
03 免疫检查点抑制剂(免疫调控)
免疫细胞会产生调节自身免疫功能的蛋白小分子,它们调节了免疫反应的强度和广度,从而避免正常组织的损伤和破坏,在肿瘤的发生、发展过程中,免疫检查点成为免疫耐受的主要原因之一,与肿瘤的免疫逃逸密切相关。
免疫检查点就好像是一个关卡,告诉免疫系统是该继续杀,还是“下班休息”。肿瘤细胞正是利用了免疫检查点的指挥功能,让机体的免疫系统一直处于“下班休息”的状态,不能正常工作。免疫检查点抑制剂正是通过抑制肿瘤细胞发出的“下班休息”的信号,恢复免疫系统的正常工作,进而对肿瘤细胞发动进攻。
程序性死亡1受体(PD1)和细胞毒性T淋巴细胞抗原4(CTLA-4) 抑制剂已被开发为抗肿瘤药物,在多种实体瘤患者中具有令人印象深刻的临床价值[4,5]。然而,在新发或获得性耐药性方面、治疗缺乏响应以及免疫相关不良事件(IRAE)仍有不足。免疫检查点,如淋巴细胞激活基因-3(LAG-3)、T细胞免疫球蛋白和ITIM结构域(TIGIT)、T细胞免疫球蛋白和含粘蛋白结构域-3(TIM-3)、T细胞激活V结构域免疫球蛋白抑制物(VISTA)、B7同源3蛋白(B7-H3)、诱导性T细胞共刺激(ICOS),B和T淋巴细胞衰减器(BTLA)是治疗肿瘤的可行且有希望的选择[6],主要概述见表1。
04 细胞免疫因子(强化武器)
细胞免疫因子是免疫系统的武器和调节信号,细胞免疫因子或其受体的抗体(小分子抑制剂)已在抗炎,抗病毒和抗肿瘤中得到应用。淋巴细胞产生的淋巴因子、单核细胞产生的单核因子、各种生长因子等,如白细胞介素(IL)、干扰素(IFN)、集落刺激因子(CSF)、肿瘤坏死因子(TNF)、红细胞生成素(EPO)等。然而,这些因子调控非常复杂,不好控制,失败的案例不记其数,目前在研的有GMCSF, IL7, IL12, IL15, IL18, IL21等。随着基础研究的日益深入,我们将更好地了解这些武器。
图3 细胞因子示意图
然而,有一个事实—人体免疫系统如同其它组织/器官一样,随着年龄的增长会不断地衰老和功能减退。2021年6月Nature Immunology上发表了一篇里程碑综述长文Hallmarks of T cell aging,介绍了T细胞衰老的十大特征[7]。
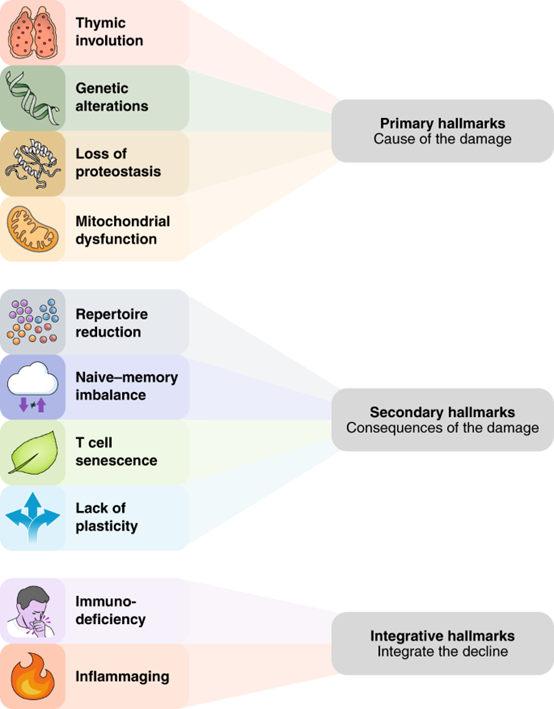
图4 T细胞衰老的十大特征(https://doi.org/10.1038/s41590-021-00927-z)
胸腺退化、线粒体功能障碍、遗传和表观遗传改变以及蛋白质稳态失衡,这四个主要特征导致了最初的损伤。TCR的减少、记忆库的扩大、效应细胞可塑性丧失和T细胞衰老这四个次要特征是四个主要特征的结果,而免疫缺陷和慢性炎症直接造成免疫衰退。
结语:
现代免疫学突破了感染免疫学的束缚,确认了淋巴细胞系在免疫反应中的地位,从分子水平对免疫球蛋白的多样性、类别转化等进行有益的探讨,对免疫系统中细胞因子、粘附分子等进行了大量研究,在许多方面取得了突破性成就。随着对免疫功能的深入研究,免疫检查点抑制剂的出现,肿瘤免疫疗法取得了突破性进展。但是,我们对免疫系统的了解还只是冰山一角,肿瘤的免疫治疗依然问题多于答案,这条路依然是星辰大海……
参考文献:
[1] Binnewies M, Roberts EW, Kersten K, Chan V, Fearon DF, Merad M, et al. Understanding the tumor immune microenvironment (TIME) for efective therapy. Nat Med. 2018;24(5):541–50.
[2] Jerry L. Adams, James Smothers, et al Big opportunities for small molecules in immuno-oncology. Nature Reviews Drug Discovery. 2015:31; doi:10.1038/nrd4596.
[3] Sabry M, Lowdell MW. Killers at the crossroads: The use of innate immune cells in adoptive cellular therapy of cancer. Stem Cells Transl Med. doi:10.1002/sctm.19-0423
[4] Yaghoubi N, Soltani A, Ghazvini K, Hassanian SM, Hashemy SI. PD-1/PD-L1 blockade as a novel treatment for colorectal cancer. Biomed Pharmacother.2019;110:312–8.
[5] Duraiswamy J, Kaluza KM, Freeman GJ, Coukos G. Dual blockade of PD-1and CTLA-4 combined with tumor vaccine effectively restores T-cellrejection function in tumors. Cancer Res. 2013;73(12):3591–603.
[6] Jii Bum Lee1, Sang-Jun Ha, et al. Clinical insights into novelimmune checkpoint inhibitors. Frontiers in pharmacology. 06 May 2021:12
[7] Mittelbrunn, M., & Kroemer, G. Hallmarks of T cell aging. Nature Immunology, 22(6), 687–698.doi:10.1038/s41590-021-00927-z


