SABCS 2023:EGFR x HER3 双特异性抗体偶联药物BL-B01D1在局部晚期或转移性乳腺癌展示良好的潜力
时间:2023-12-12 06:39:19 热度:37.1℃ 作者:网络
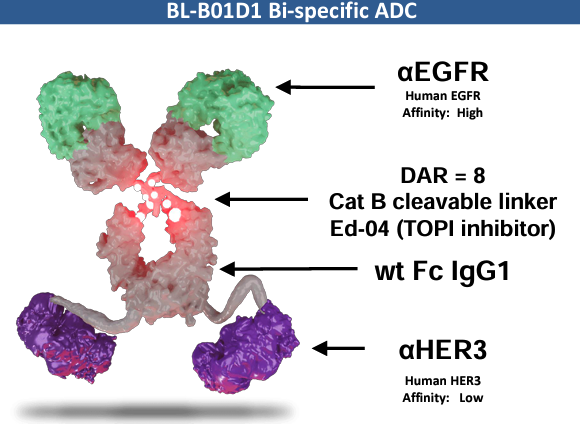
BL-B01D1 同样是由我国企业自主研发的抗癌创新药,且属于双特异性抗体与抗体偶联药物(ADC)概念的结合,即以 EGFRxHER3 双特异性抗体作为载体,用新型连接子搭载 TOP-I 抑制剂作为载荷。
BL-B01D1 是具有抗肿瘤活性的重组人源化双特异性抗体药物偶联药物,一方面可同时结合肿瘤细胞上的 EGFR 和 HER3,实现对两个肿瘤相关靶点的同时阻断,以此获得靶向性和增强的抗肿瘤活性;另一方面,BL-B01D1 分子经 EGFR、HER3 的结合、内吞作用后进入细胞内部,由水解酶酶切释放小分子毒素 ED04(拓扑异构酶抑制剂),阻止肿瘤细胞的 DNA 复制和 RNA 合成,并破坏 DNA结构,从而进一步杀伤肿瘤细胞。
此前 BL-B01D1 治疗非小细胞肺癌(NSCLC)等实体瘤的初步疗效数据,已登上美国临床肿瘤学会(ASCO)年会、欧洲肿瘤内科学会(ESMO)年会等顶级学术会议,本次 SABCS 则公布了 BL-B01D1 临床 I 期研究中治疗乳腺癌患者的疗效和安全性数据。本项研究由复旦大学附属肿瘤医院吴炅教授开发。
根据首个治疗实体瘤患者的人体研究数据,BL-B01D1 用于局部晚期或转移性乳腺癌患者的给药方法为:每 3 周为 1 个用药周期,2.5 mg/kg D1D8 Q3W 或 5.0 mg/kg D1 Q3W 静脉给药。截至 2023 年 6 月 26 日,有 42 名患者(41 例为乳腺癌;8 例入组剂量递增阶段、34 例入组剂量扩展阶段)被纳入研究,并接受了至少一剂 BL-B01D1。目前最大耐受剂量(MTD)尚未达到,而剂量扩展阶段的给药方案为 2.5 mg/kg D1D8 Q3W。
共有 24 名患者接受了至少 1 次疗效评估,包括 11 例 TNBC 患者、9 例 HR+/HER2 低表达或零表达患者、8 例 HER2 阳性患者,BL-B01D1 在上述三组患者中的治疗 ORR 分别为 45.5%、33.3% 和 25.0%,DCR 分别为 100%、88.9% 和 87.5%,展现了良好的初步抗肿瘤活性。
安全性结果显示,BL-B01D1 最常见的 TRAEs(>10%,下文括号中数据为所有级别/≥3 级事件发生率)为白细胞减少(67%/24%),中性粒细胞减少(55%/33%),贫血(55%/26%),血小板减少(60%/24%),恶心(38%/0%),呕吐(38%/0%),口腔炎(31%/2%),乏力(29%/0%),低钾血症(21%/5%),天冬氨酸氨基转移酶增高(19%/0%),丙氨酸氨基转移酶增高(19%/0%),食欲减退(19%/0%),高甘油三酯血症(19%/0%),高血糖(19%/0%),体重减轻(14%/0%),腹泻(12%/0%),鼻衄(12%/0%),高胆固醇血症(12%/0%);BL-B01D1 治疗整体安全可耐受,且未观察到 ADC 相关的间质性肺病(ILD)。
此前在NSCLC的研究中,截至 2023 年 8 月 17 日,共有 102 例接受至少一剂 BL-B01D1 治疗且疗效可评价的 NSCLC 患者,其中包括 40 例 EGFR 突变型和 62 例 EGFR 野生型患者。数据显示,EGFR 突变型和野生型 NSCLC 患者的 DoR 分别为 8.5 个月(95% CI: 2.8-NR)和未达到(95% CI: 5.6-NR),mPFS 分别为 5.6 个月(95% CI: 3.9-9.7)和 5.4 个月(95% CI: 4.0-6.8)。在 EGFR 突变型患者中,13 例患者没有中枢神经系统(CNS)转移或经过 CNS 治疗,BL-B01D1 治疗的 ORR 为 69.2%,cORR 为 61.5%,中位缓解持续时间为 12.3 个月(95% CI:2.7-NR),mPFS 为 15 个月(95% CI:4.3-NR)。对于 EGFR 野生型且为二线治疗的患者,BL-B01D1 治疗的 ORR 为 50.0%,cORR 为 38.5%,中位缓解持续时间尚未达到,mPFS 为 6.7 个月(95% CI:2.7-NR),这表明 BL-B01D1 治疗能够有效诱导持久的疾病缓解。


