NKp30——癌症免疫治疗中NK细胞的潜在靶点
时间:2023-12-16 08:54:06 热度:37.1℃ 作者:网络
自然杀伤 (NK) 细胞是先天免疫系统的重要组成部分,具有细胞毒性和免疫调节双重功能。
NK细胞的免疫活性是由大量的细胞表面受体介导的,这些受体识别不同的配体并介导不同的信号通路。
在目前已知的四种天然细胞毒性受体(NCR)中,三种在NK细胞中组成型表达(NKp30、NKp46和NKp80),而NKp44仅存在于活化的NK细胞表面。这些受体与其配体的结合向细胞传递强烈的激活信号。NCR 的信号转导通过相关蛋白 DAP12、NKp44 中的 ITAM 基序、NKp30 和 NKp46 中的 FcεRIγ 和 CD3δ 进行(图1)。
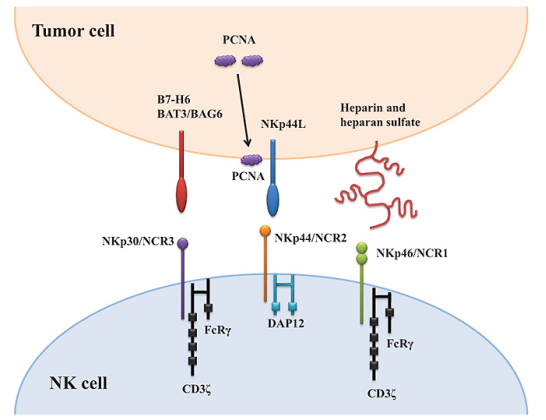
图1. NK细胞表达的NCRs与肿瘤相关配体的作用示意图
NKp30
NKp30 的质量为 30 kDa,包含一个138 个氨基酸长的Ig 样胞外结构域、一个 19 个氨基酸的跨膜 (TM) 结构域和一个 33 个氨基酸的胞质尾。
NKp30的胞外域包含Ig样折叠,通过短柄结构域与跨膜α螺旋(红色)连接。Ig 样结构域由8个β链组成,形成两个反向平行的β片层(黄色),通过Cys39和Cys108之间的二硫键连接(图2)。胞外结构域包含两个参与配体结合的N连接糖基化的潜在位点。
TM结构域包含带正电荷的精氨酸残基,与ITAM接头分子CD3ζ和FCεRIγ的 TM 结构域中带负电荷的天冬氨酸结合。这也是其他 NK 细胞激活受体的共同特征。
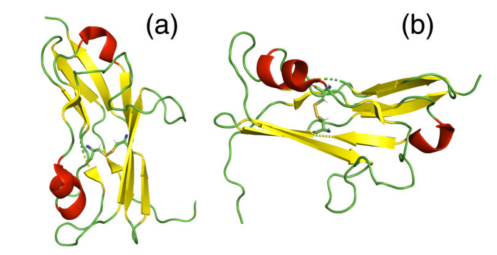
图2.NKp30结构
NKp30在几乎所有人类的NK细胞上都有表达,是免疫球蛋白超家族的I型跨膜激活受体。NKp30 介导的反应由特定配体(例如肿瘤细胞衍生的B7-H6)的结合触发,并引发细胞毒性介质TNF-α、IFN-γ、穿孔素和颗粒酶的分泌。
当NKp30与激动剂抗体或配体结合后,会将强烈的激活信号转导给细胞,该NCR的信号转导通过NKp30中的FcεRIγ和CD3ζ的ITAM基序发生(图3)。NKp30激活可诱导NK细胞的细胞毒作用和细胞因子分泌功能,在抗肿瘤、抗病毒和抗寄生虫感染中发挥着重要的作用。

图3. NKp30信号通路
NKp30配体
NKp30 受体可能与多种配体类型结合。痘病毒血凝素 (HA),与NKp30结合充当拮抗剂;人巨细胞病毒外皮蛋白 pp65 (HCMV pp65) 也能够阻断 NKp30 参与的触发信号;恶性疟原虫红细胞膜蛋白1 (PfEMP-1) 被鉴定为 NKp30 和 NKp46 的强激活配体,一旦结合,就会导致受感染细胞裂解。
肿瘤相关的NKp30配体
-
配体BAT3
-
配体B7-H6
NKp30配体B7-H6在正常组织和细胞中几乎不表达或低表达,当细胞发生癌变或感染时,B7-H6分子表达上调。
与其他 B7 家族蛋白不同,在稳态条件下,B7-H6 不会在正常人体组织中表达,但在炎性应激下会被诱导表达。相应地,B7-H6 已被证明会在各种不同的肿瘤组织上表达。B7-H6 会与自然杀伤细胞上的 NKp30 激活受体结合,诱导细胞毒性,从而促进抗肿瘤免疫应答。与此相对的是,研究还显示可溶性 B7-H6(可由 ADAM 介导的胞外域脱落产生)与某些癌症中的 NKp30 表达减少和自然杀伤细胞功能障碍相关,这表明B7-H6 在某些条件下可能负向调节免疫应答。此外,在利用人乳腺癌或神经胶质瘤细胞系开展的研究中发现,B7-H6 可促进肿瘤细胞增殖并抑制细胞凋亡,这进一步表明 B7-H6 可能参与了肿瘤发生。同样,B7-H6 在人卵巢癌中的高水平表达与肿瘤进展和转移呈正相关。
原始出处:
In-depth characterization of NK cell markers from CML patients who discontinued tyrosine kinase inhibitor therapy.Front Immunol. 2023 Sep 25;14:1241600. doi: 10.3389/fimmu.2023.1241600


