Immunity:中山大学周怡/陈崴等发现肠道CXCR6+ILC3可迁移至肾脏并促进肾脏纤维化发生进展
时间:2024-05-31 23:00:51 热度:37.1℃ 作者:网络
3型先天淋巴样细胞(ILC3s)调节粘膜部位的炎症和组织修复,但这些功能是否适用于其他组织,如肾脏,尚不清楚。
2024年5月29日,中山大学附属第一医院周怡、陈崴及哈佛医学院布莱根妇女医院Joseph V. Bonventre共同通讯(梁州、唐子雯及朱昌健为论文共同第一作者)在共同通讯在Immunity 在线发表题为“Intestinal CXCR6+ ILC3s migrate to the kidney and exacerbate renal fibrosis via IL-23 receptor signaling enhanced by PD-1 expression”的研究论文,该研究表明肠道CXCR6+ ILC3s通过PD-1表达增强的IL-23受体信号迁移到肾脏并加剧肾纤维化。
该研究观察到人类肾纤维化与肾脏和血液中ILC3s的增加有关。在小鼠中,CXCR6+ ILC3s迅速从肠粘膜迁移,并通过损伤小管释放的CXCL16在肾脏中积累。在纤维化肾脏中,ILC3s增加程序性细胞死亡-1 (PD-1)的表达和随后的IL-17A的产生,直接激活肌成纤维细胞和纤维化生态位的形成。ILC3表达PD-1抑制IL-23R的内吞作用,从而扩增JAK2/STAT3/RORgt/IL-17A通路,这是ILC3促纤维化作用所必需的。因此,该研究揭示了迄今为止未被认识的ILC3s从肠道到肾脏的迁移途径,以及ILC3s在促进肾纤维化中的PD-1依赖性功能。

先天淋巴样细胞(ILCs)是异质淋巴细胞,缺乏重排抗原受体,通过细胞因子的产生对损伤作出反应,启动关键的免疫反应和组织修复。ILC3s需要表达类视黄酮相关孤儿受体γt (RORγt),产生白细胞介素(IL)-17A和/或IL-22,在小肠等粘膜屏障部位大量存在(SI) 1ILC3s也存在于肝、肾等实质器官中。ILC3s在生理和病理过程中都起作用,包括维持粘膜稳态、组织修复、抵抗细菌感染和肿瘤免疫监视。ILC3s可以通过IL-17A/IL-22的产生促进沙门氏菌感染的肠道纤维化和四氯化碳(CCl4)诱导的小鼠肝纤维化,表明其在纤维化重塑中的作用。然而,ILC3s是否参与肾纤维化仍不清楚。
肾纤维化是几乎所有类型的慢性肾脏疾病(CKD)的共同命运。在多种刺激下,免疫细胞在很早的阶段就浸润肾脏,产生促炎介质,直接诱导成纤维细胞凋亡分化为表达α-平滑肌肌动蛋白(α-SMA)的肌成纤维细胞。这最终导致异常细胞外基质(ECM)沉积和不可逆的结构和功能损伤。鉴于IL-23、IL-1β和IL-17A是CKD22-24中重要的促炎细胞因子,是ILC3s的主要调节介质和效应因子,假设ILC3s可能参与肾纤维化。
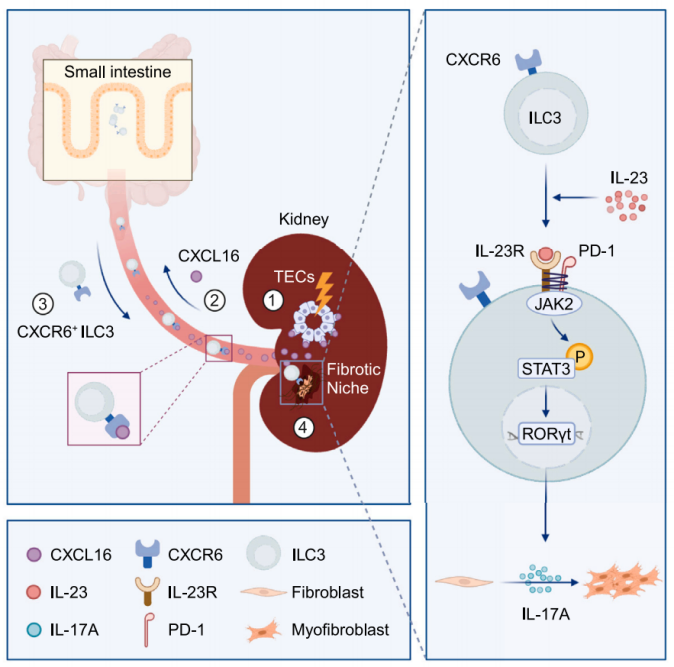
机理模式图(图源自Immunity )
该研究发现ILC3s通过C-X-C基序趋化因子受体6/C-X-C基序趋化因子配体16 (CXCR6/CXCL16)信号传导从SIs迅速募集到肾脏,并通过激活成纤维细胞和启动纤维化生态位形成来促进肾脏纤维化。在机制上,ILC3s的促纤维化作用依赖于IL-23/IL-1β在肾纤维化微环境中诱导的程序性细胞死亡-1 (PD-1)的表达。
PD-1与IL-23R结合,抑制IL-23R的内吞噬,从而维持IL-23R在ILC3s表面,并放大下游细胞内janus kinase 2 (JAK2)/signal transducer and activator of transcription 3 (STAT3)/RORgt信号传导和随后的IL-17A分泌。最终,增加的IL-17A驱动肾成纤维细胞产生ECM。在CKD患者中也检测到类似的模式,支持这些发现的转化潜力。该研究显示ILC3s在肾纤维化中的独特贡献可能通过肠肾连接,靶向ILC3的肠肾迁移或肾ILC3s中的PD-1具有预防CKD的治疗潜力。
原文链接:
https://www.cell.com/immunity/abstract/S1074-7613(24)00255-3


