NEJM:CAR-T细胞治疗继发肿瘤风险可控
时间:2024-07-07 06:00:47 热度:37.1℃ 作者:网络
商用嵌合抗原受体T细胞(CAR-T)疗法在治疗某些肿瘤时疗效显著,但最近有研究报道CAR-T细胞治疗后出现T细胞淋巴瘤(TCL)的病例,并推测可能与CAR-T细胞载体整合到恶性淋巴细胞中有关,这些报道引起人们对CAR-T细胞治疗直接导致肿瘤的担忧。鉴于报道的病例数量相对较少,对接受CAR-T细胞治疗后发生的T细胞淋巴瘤进行全面遗传学特征分析对于了解淋巴瘤的发病机制非常重要。
近日,来自斯坦福大学的 David B. Miklos 等研究团队在 The New England Journal of Medicine 发表题为 Risk of Second Tumors and T-Cell Lymphoma after CAR T-Cell Therapy 的文章。该研究在斯坦福癌症研究所接受过细胞治疗的724例患者中发现25例继发肿瘤,并报告了一例弥漫大B细胞淋巴瘤患者,在接受CAR-T细胞治疗后53天确诊EBV阳性T细胞淋巴瘤。研究团队采用多种分子分析技术,对这例患者的继发T细胞淋巴瘤和既往弥漫大B细胞淋巴瘤的分子特征进行了描述,并对连续收集的细胞游离DNA(cfDNA)血浆样本进行无创基因分型分析、病毒载体监测和最小残留疾病评估,没有发现致癌逆转录病毒整合的证据。

研究分析了2016年2月4日至2024年1月15日期间在斯坦福大学医学中心进行的791例次治疗性细胞输注的724例患者,其中96.6%的输注的为CAR-T细胞,0.8%为细胞因子诱导的杀伤T细胞,1.5%为细胞毒性T淋巴细胞,1.1%为特异性肽增强亲和力受体T细胞(以下简称CAR-T细胞治疗)。经过15个月的中位随访,确定了25例继发肿瘤,其中血液肿瘤14例,实体瘤11例。在14例血液继发肿瘤中,13例与骨髓增生异常综合征或急性髓系白血病相关,1例为T细胞淋巴瘤。11例肿瘤为实体肿瘤(4例黑色素瘤,2例前列腺癌,2例乳腺导管癌,1例子宫内膜腺癌,1例肺腺癌,1例转移性间皮瘤)。三年血液继发肿瘤的累积发生率为6.5%,这一发现与先前报道的CAR-T细胞治疗后继发肿瘤罕见发生相一致。
本文重点研究的继发T细胞淋巴瘤(文中称为索引T细胞淋巴瘤,以下简称为索引TCL)发生在一名59岁接受CAR19细胞治疗的IV期EBV阳性弥漫大B细胞淋巴瘤(EBV+DLBCL)女性患者身上。该患者有银屑病和嗜酸性筋膜炎病史,在诊断淋巴瘤之前接受多种药物治疗。在一线诱导化疗和二线化疗免疫治疗方案失败后,患者接受了Axi-cel(一种商品化的CAR19细胞治疗产品)细胞治疗,在接受细胞输注后54天,经骨髓穿刺确诊为T细胞淋巴瘤。
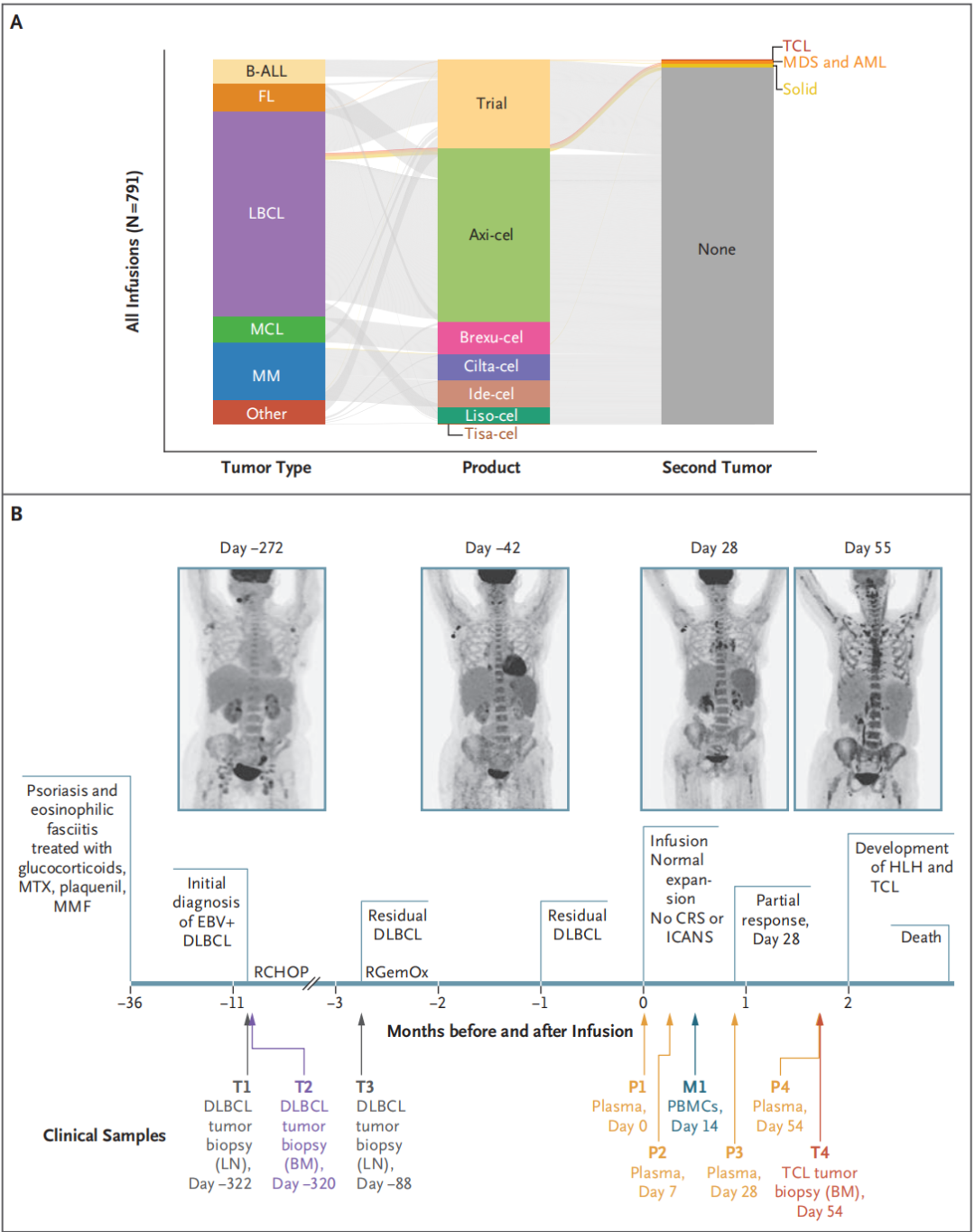
图1,靶向CD19的CAR-T细胞(CAR19,本文中研究患者接受的是一种名为Axi-cel的商品化工程细胞)治疗后T细胞淋巴瘤发生率较为罕见。
由A图可见,在斯坦福大学接受CAR-T细胞治疗的患者中,发生T细胞淋巴瘤(TCL)比例。条形图之间的线连接了单次注射的数据。AML为急性髓系白血病,B-ALL为B细胞急性淋巴细胞白血病,FL为滤泡性淋巴瘤、LBCL为大B细胞淋巴瘤、MCL为套细胞淋巴瘤、MMS为骨髓增生异常综合征、MM为多发性骨髓瘤和组织骨髓瘤;brexu-cel、cilta-cel和ide-cel分别代表不同的商品化或临床试验用CAR-T细胞产品。
B图显示本文重点研究患者(也称索引患者)的临床病程和治疗时间表。一名59岁女性,EB病毒阳性(EBV+)弥漫性大B细胞淋巴瘤(DLBCL)经过RCHOP和RGemOx化疗后复发。EBV+外周T细胞淋巴瘤未明确(CAR-T细胞输注后第54天通过骨髓穿刺确诊),导致噬血细胞性淋巴组织细胞增多症和死亡。T1、T2和T3为3个输注前肿瘤样本;T4,从骨髓活检中提取的TCL样本;M1,外周血单个核细胞(PBMCs);以及P1、P2、P3和P4,4个连续采集的血浆样本。BM为骨髓、LN为淋巴结、CRS为细胞因子释放综合征、HLH为噬血细胞性淋巴组织细胞增多症、ICANS为免疫效应细胞相关神经毒性综合征、MMF为霉酚酸酯和MTX为甲氨蝶呤。
为明确Axi-cel细胞载体整合在驱动T细胞淋巴瘤中的潜在作用,研究团队对收集患者的原发DLBCL和索引TCL的组织样本和连续血浆样本进行了全面的组织学和分子生物学分析,结果发现虽然DLBCL和T细胞淋巴瘤在组织亚型和分子特征上存在差异,但都存在TET2和DNMT3A基因的共突变,意味着他们可能来源于同一个祖细胞。
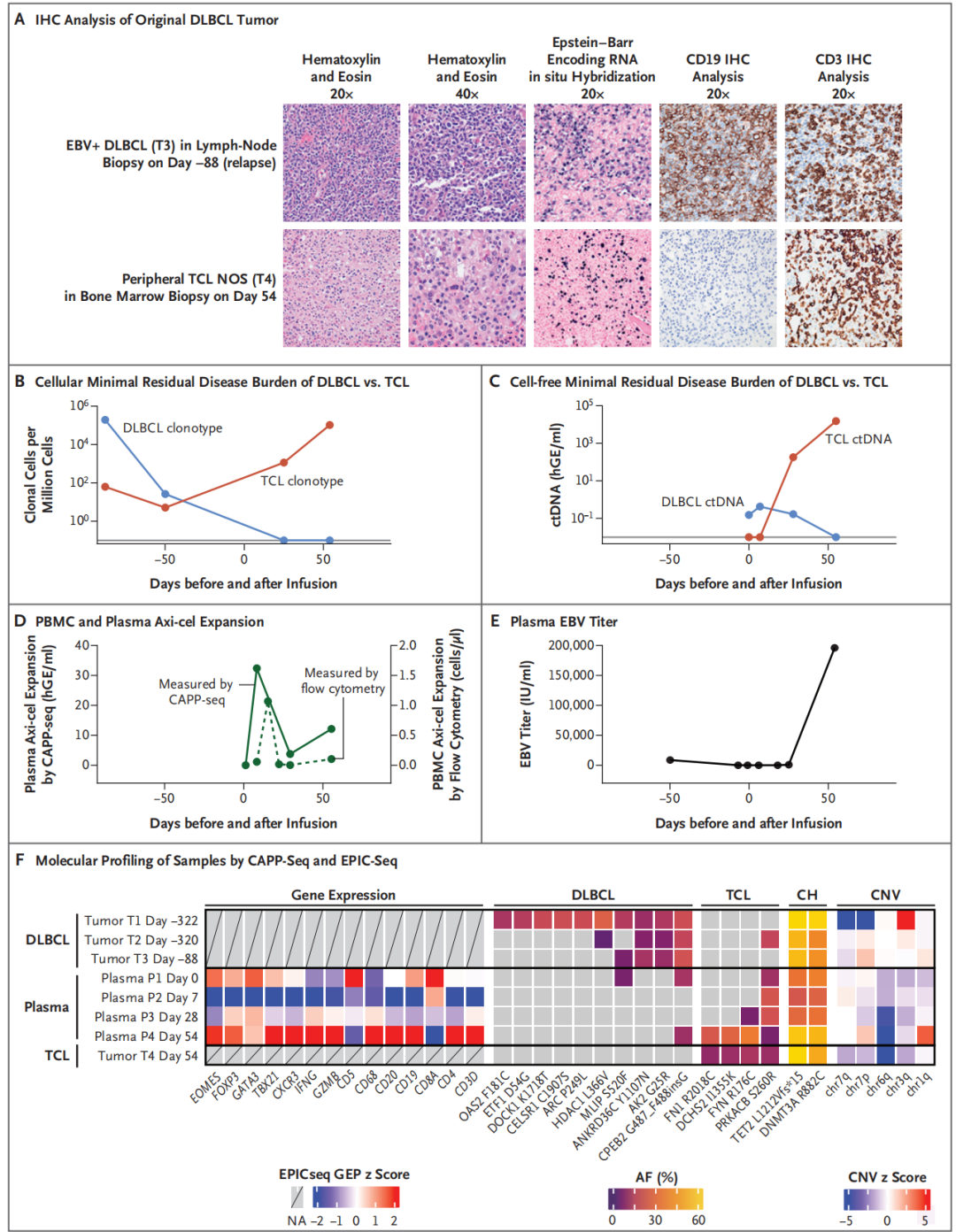
图2,索引TCL的临床和分子特征与原发DLBCL不同。A图显示原发DLBCL和索引TCL的免疫组化特征;B图显示了输注前后DLBCL和TCL受体克隆亚型监测分析结果,TCL受体亚克隆在输注前就存在。C图显示采用CAPP-Seq技术对输注细胞后的血浆样本进行分析发现,原发DLBCL来源的ctDNA水平逐渐降低,而TCL来源的ctDNA水平逐渐增加。D图显示采用杂交捕获测序技术(CAPP-Seq,实线)和流式细胞术(虚线)监测的Axi-cel细胞浓度变化。图E显示血浆样本中EBV滴度显著上升;图F显示通过CAPP-Seq对连续采集血浆和组织样本进行全面分子分析。
然后,研究团队采用多种敏感的分子分析技术,以单细胞分辨率在索引TCL细胞中检测制备Axi-cel细胞的逆转录病毒载体 DNA、RNA 和蛋白质,没有证据显示病毒载体与 T 细胞淋巴瘤发生直接相关。
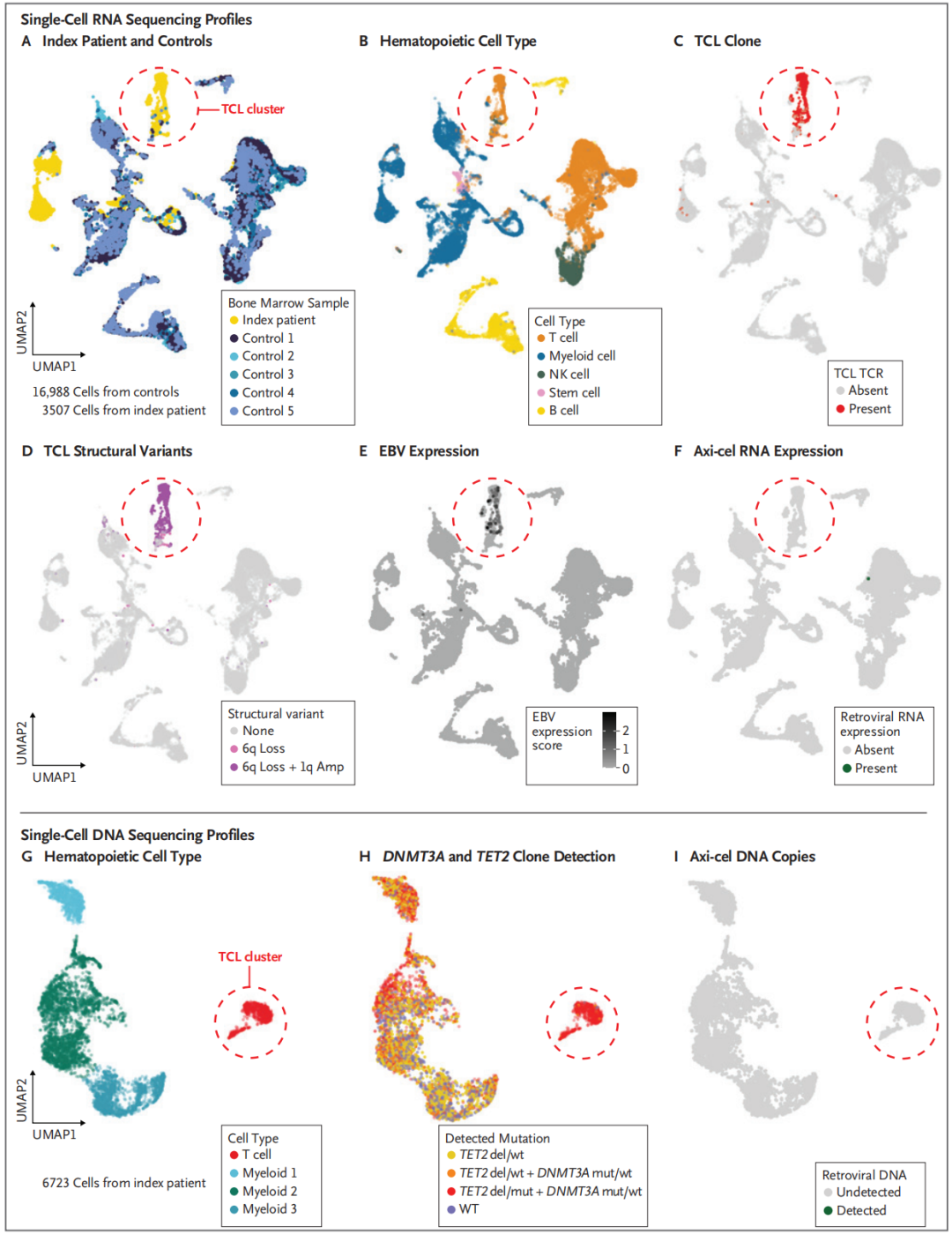
图3,在单细胞分辨率上,索引TCL的RNA和DNA谱上缺乏Axi-cel细胞的载体整合。A图显示来自研究患者的骨髓样本与来自5个健康对照组的骨髓样本的单细胞RNA分析。索引TCL与噬血细胞性淋巴组织细胞增多症的特征相一致。B图显示使用Seurat(R语言中专门用于单细胞RNA数据分析的统计包)的细胞类型预测,并表明被研究患者的独特簇被定义为T细胞。C图显示单细胞T细胞受体(TCR)测序,其中先前描述的在血浆样本中鉴定出的TCL克隆被发现与索引TCL病变中存在的T细胞簇相匹配。图D显示了由RNA推断确定的拷贝数变异,表明新的T细胞簇携带染色体1q的获得和染色体6q的丢失,这与DNA拷贝数分析一致。图E显示EBV RNA的表达,并定位于推测的TCL克隆。图F显示在索引TCL中完全没有单细胞分辨率的Aix-cel细胞mRNA表达。图G显示,细胞表面抗体谱结合单细胞DNA谱显示了一个单独的簇,主要包含CD3+CD4+CD8−T细胞,与TCL克隆一致。H图显示索引TCL存在的DNMT3A R882C、TET2缺失和TET2 L1212Vfs*15克隆的单细胞DNA图谱。I图显示使用11个扩增子对Aix-cel细胞进行单细胞DNA测序,没有任何证据显示Aix-cel细胞的DNA整合。
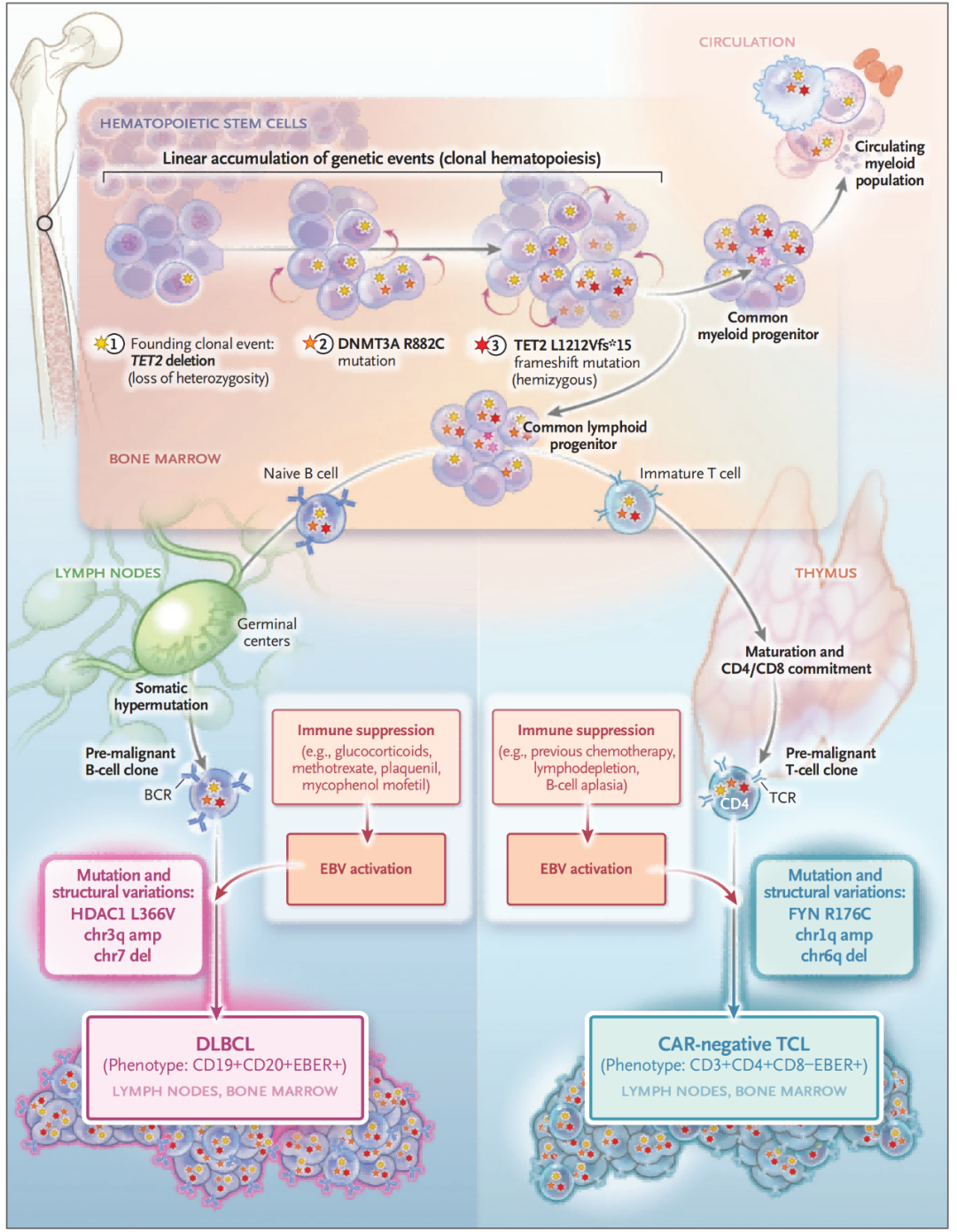
图4,DLBCL 和 TCL 从共同的造血祖细胞群平行发育的示意图。单细胞 DNA 测序数据显示克隆造血的线性积累(TET2缺失→DNMT3A R882C突变→TET2 L1212fs*15 突变),这表明始祖细胞群中,这些细胞繁殖成了普通淋巴祖细胞和普通髓系祖细胞。DLBCL 和 TCL 肿瘤都含有 分别含有重组的 B 细胞和 T 细胞受体。表明 DLBCL 是在生发中心成熟后产生的,而 TCL 是在进入胸腺后产生的。免疫抑制导致的 EBV 激活可能是这两种肿瘤的共同点,但却导致了独特的后续突变从而形成成熟的肿瘤。恶性克隆可以通过它们各自的 B 细胞和 T 细胞受体序列及其独特的突变和结构变化进行追踪。
最后,研究团队在对724例接受细胞治疗的患者进行继发肿瘤监测后发现T细胞淋巴瘤非常罕见,仅占1例。在DNA、mRNA或蛋白质水平,对游离DNA、不同部位的肿瘤组织以及血细胞样本进行分析发现,没有证据显示在索引TCL中存在Aix-cel工程逆转录病毒载体。另外,索引T细胞淋巴瘤的分子特征与最初的DLBCL不同,没有谱系转换或转分化的证据。相反,T细胞淋巴瘤的克隆在输注CAR-T细胞前88天被检测到,并与EBV+淋巴细胞增生、新的结构重排和FYN基因激活突变相关,这种突变的祖细胞存在可能特别容易于在CAR-T细胞治疗后发生继发肿瘤的风险。
研究强调了接受CAR-T治疗发生继发肿瘤的罕见性(发生率在0.12%-0.17%),并为定义继发肿瘤和原发肿瘤克隆之间的关系和病毒载体监测提供了一个框架。


