【衡道丨文献】色素型PEComa——通过7例病例分析一种罕见但独特的亚型
时间:2024-07-21 06:00:39 热度:37.1℃ 作者:网络
近期,来自法国里昂癌症研究中心病理科的Arnaud de la Fouchardiere等人报告了7例色素型PEComas临床病理特征,发病年龄在21至82岁(中位年龄:41岁);发病部位分布广泛,包括骨盆2例,胆囊、子宫颈、眼睑、硬膜外和股骨各1例。所有的肿瘤都有大量色素沉着。与传统的PEComas一样,由大小不一的肿瘤细胞组成,瘤细胞胞质丰富呈颗粒状或透明(不常见)、显著核仁。免疫组化显示所有肿瘤均表达HMB45,7例中有6例显示TFE3核阳性表达。Mart-1/Melan-A、S100、Desmin和SMA标记均为阴性。分子检测发现7例中的5例存在TFE3基因重排,其中4例通过荧光原位杂交证实,1例通过全外显子组RNA测序证实了存在SFPQ::TFE3 融合。一例TFE3免疫组织化学检测结果阴性的病例被发现含有SFPQ::TFEB 融合基因,这是我们所知的第一例PEComa中存在TFEB 融合。

西京医院李超老师对这篇文献要点进行了编译,供大家参考。
背景知识
血管周上皮样细胞肿瘤(PEComas)是一种组织来源尚不明确的间叶源性肿瘤,发病部位广泛,包括软组织、皮肤和内脏。免疫组织化学染色显示特征性地共表达黑色素和平滑肌分化标志物。正如该肿瘤命名一样(血管周上皮样细胞肿瘤),该类肿瘤通常表现出上皮样形态(尽管证实也存在梭形细胞亚型),由于其具有上皮样形态、并表达黑色素细胞标记物以及频繁地发生于深部软组织或内脏,PEComas很容易被误认为是转移性黑色素瘤。
尽管一些病例发生在结节性硬化症(胚系突变)的背景下,但大多数PEComas仅出现TSC2 或TSC1 基因散发性失活性改变。一小部分PEComas是由易位相关的基因融合驱动的,包括TFE3 基因。TSC 和TFE3 重排PEComas的遗传基础是相关的,因为TFE3 是mTOR信号通路的下游分子,而mTOR信号通路本身由TSC1/2 调节。
TFE3 重排的PEComas在形态学上与传统的PEComa相似,但表现出一些独特的特征,包括几乎完全呈上皮样形态、较少表达平滑肌蛋白、HMB45的表达比Mart/Melan-A更显著。关于该病变是PEComa的一个亚型还是一个独立的疾病,有一些讨论,但大多数作者支持前者的观点。
尽管黑色素细胞分化是PEComas的一个特征,但大多数病例看不到黑色素。少数情况下,PEComas可见到广泛的黑色素沉着。这些肿瘤被称为色素型PEComa,但由于其罕见,主要为病案报道或小系列报道。在此,作者报道了7例色素型PEComas,包括其分子特征分析及临床随访数据。
结果
临床特征
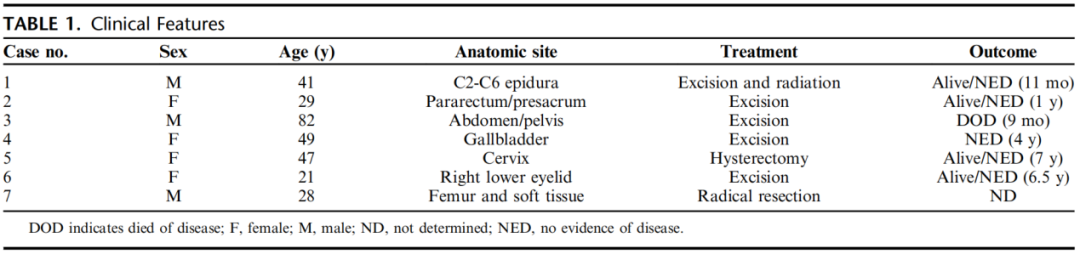
7例患者中男性3例(43%)女性4例(57%),平均年龄41岁(范围21-82岁)。发病部位分布广泛,包括C2-C6硬膜外部位、骶前区、腹部/骨盆、胆囊、宫颈、右下眼睑皮肤和股骨并伴有邻近的软组织的受累。
病理学和免疫组化特征
最显著的形态特征是存在广泛的细胞内黑色素(图1A,B)。3例进行Fontana-Masson银染色,结果呈强阳性,进一步证实了该色素为黑色素。
在色素较少的区域(或漂白的部分),细胞特征容易观察,形态学与传统的PEComas相似。肿瘤呈片状生长,富含血管。肿瘤细胞呈上皮样或多角形,胞质丰富。细胞大小不一,从小到大,大的类似气球样外观。这种变化是由于胞质的扩张而不是核的增大。胞质丰富主要呈嗜酸性颗粒状(图1C)。不太常见的是,肿瘤细胞显示出透明的细胞质(图1D)。即使在这些色素较少的区域,通常仍然有非常细的棕色颗粒或黑色素沉着。
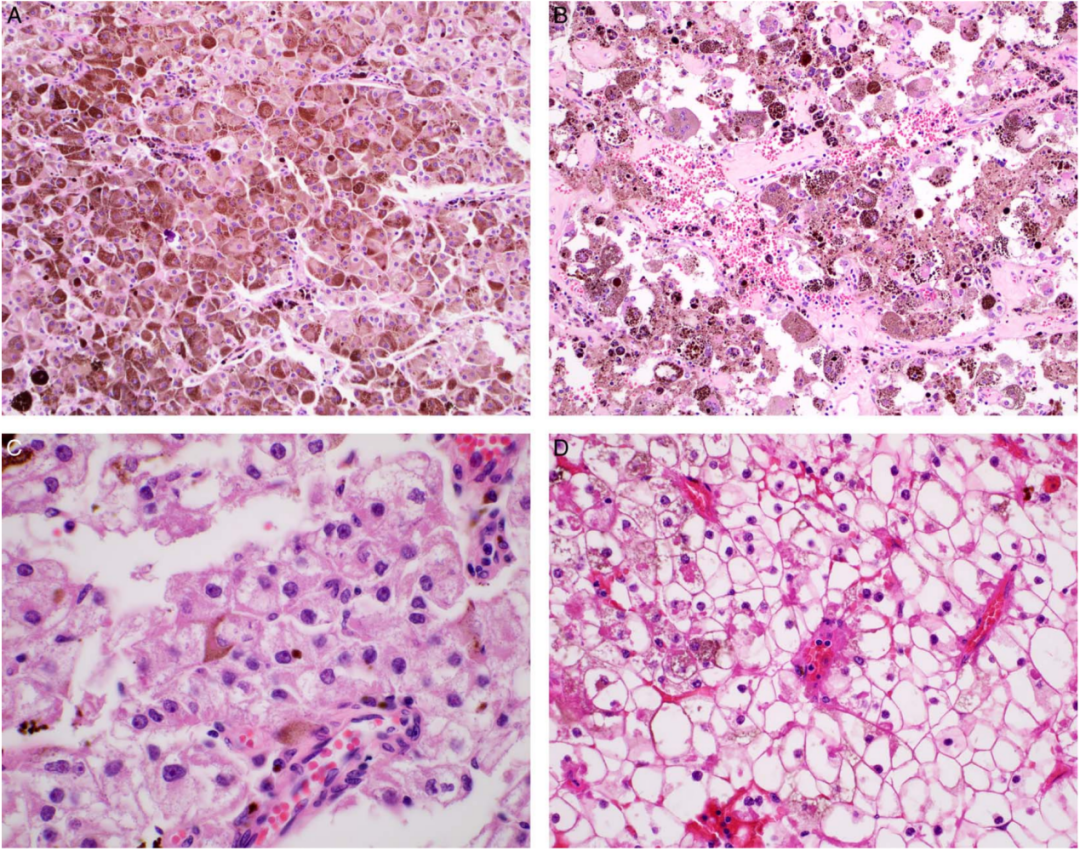
图1:色素型PEComa的形态学特征。A和B,低倍镜(200 X)图像显示大量色素沉着的上皮样肿瘤(A,病例5;panel B,case 2)。注意肿瘤细胞大小不一:B图中的细胞要大得多。C,取自色素较少区域的图像,显示出典型的形态学特征:胞质丰富,显示出颗粒状、嗜酸性外观(case 5,600 X)。D,少见的是,肿瘤细胞显示出透明的外观。
肿瘤细胞核通常为低级别,核小、染色质均匀、核轮廓光滑。核仁大小不一,有时可见单个明显的核仁,但无显著增大。病例#3的结果与其他6例大致相似(图2A,B),该病例最终发展为侵袭性临床病程,其特征是独特的遗传驱动因素(见下文)。核分裂象少见。在其余6个病例中未观察到核分裂象;在病例3中,核分裂象为1/10HPFs(10HPF=2.38mm2)。所有病例均未发现淋巴管侵犯、血管侵犯及肿瘤坏死。
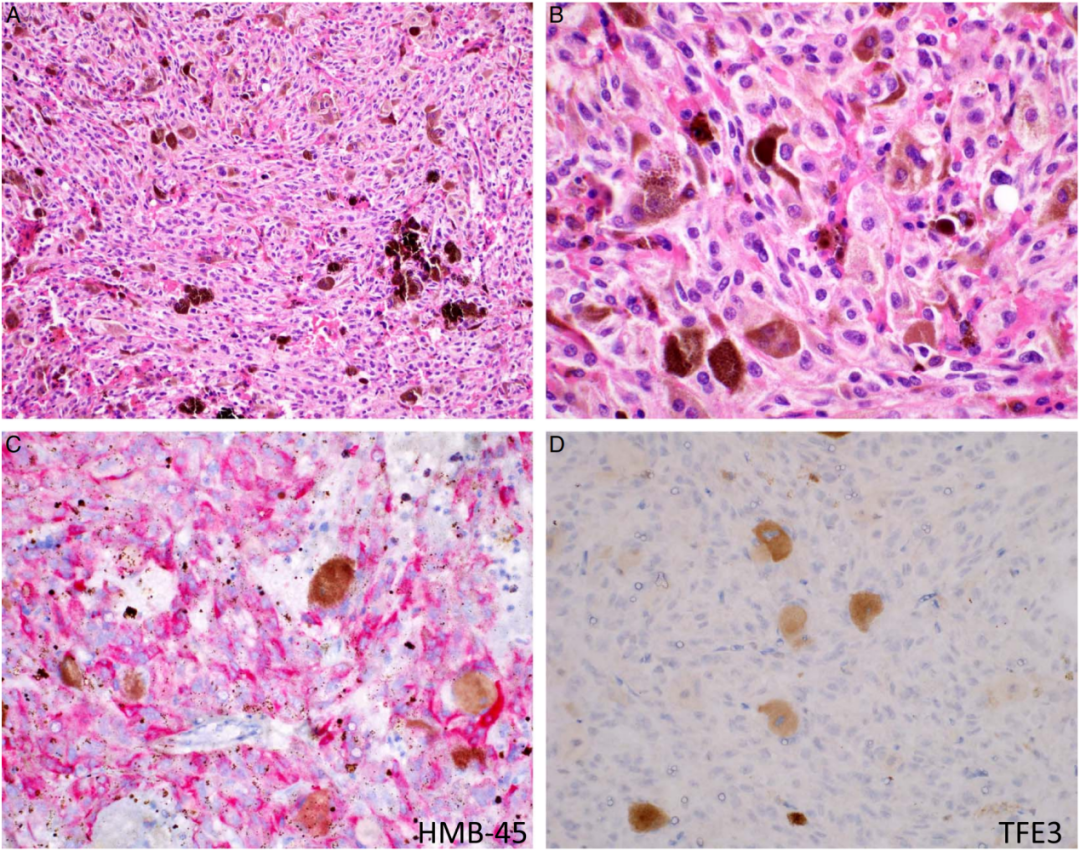
图2:TFEB重排的PEComa的形态学和IHC特征(#3)。A和B,低(200 X)和高倍(600 X)放大的形态学图像,显示出与其他病例非常相似的特征,如低级别的细胞学特征和较少的有丝分裂。C和D(200 X),HMB-45表达较强,而TFE3不表达。
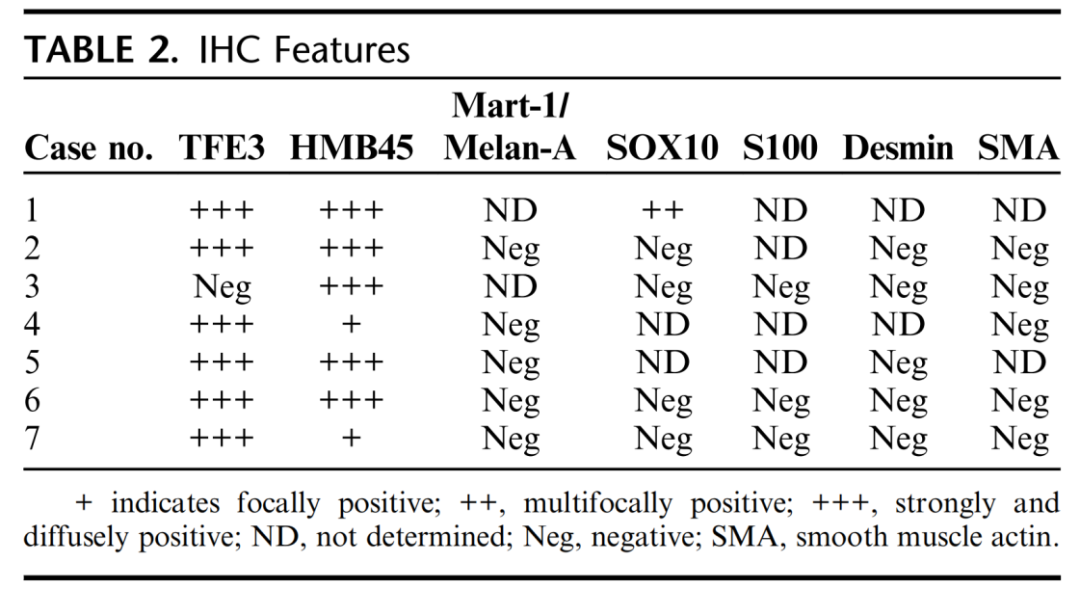
这些肿瘤的免疫组化表达谱是一致的(表2)。唯一可靠表达的蛋白是TFE3和HMB45。7例患者中有6例(86%)存在TFE3核强烈、弥漫性表达(图3A)。1例TFE3阴性病例(#3;图2D)含有不同的分子驱动因子(见下文)。HMB45在所有病例中均有表达(图2D、3B),其中5例强而弥漫表达,2例局灶性表达。所有检测病例的Mart-1和Melan-A均为阴性(图3C)。所有病例S100、平滑肌动蛋白及desmin均阴性。1例(#1)SOX10局灶或多灶阳性。这在PEComa中是一个不寻常的发现,但其意义尚不确定。病例#3发生在盆腹腔区域,PAX8染色进一步评估易位相关RCC的可能性,结果为阴性。
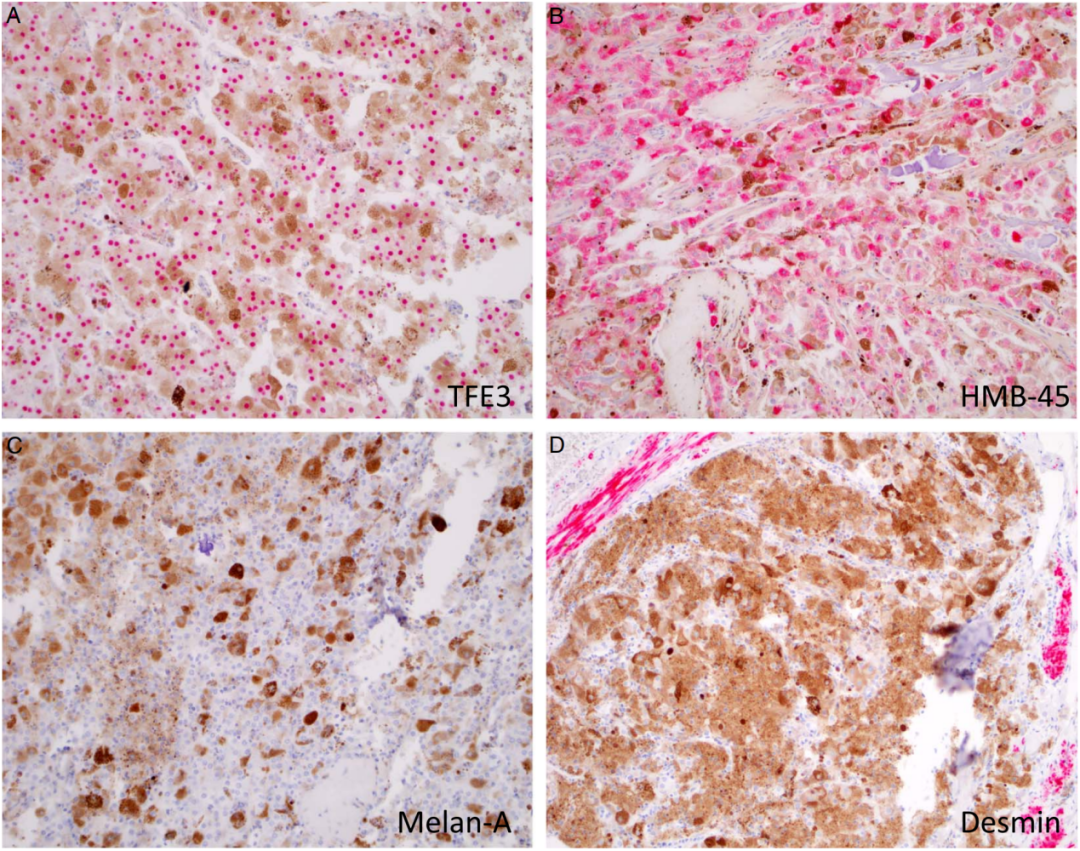
图3:免疫组化特征。A,除病例#3显示SFPQ::TFEB融合外,所有病例均可见核TFE3强而弥漫表达。B和C,HMB-45在所有病例中均有表达,而Melan-A(或Mart-1)的表达均为阴性。D,所有病例Desmin均为阴性(SMA也如此)。注意背景中的 desmin阳性的平滑肌束。考虑到肿瘤细胞背景广泛的色素沉着,使用了红色反应产物。
其中5例被认为是良性的(病例#1及#2,#4至#6)。其中一个病例(#3)在会诊时已经进行了积极的治疗(见下文),并被认为是恶性的。
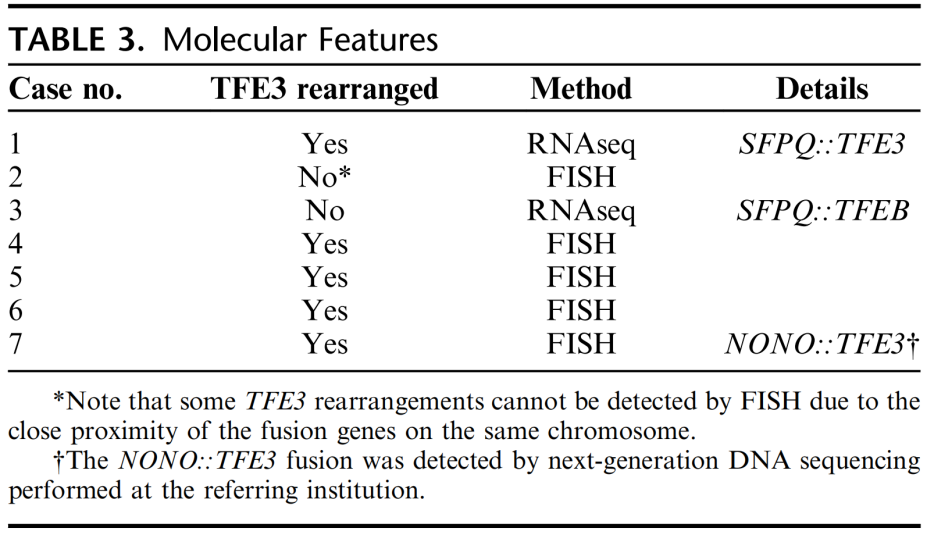
分子特征
通过全外显子组RNA测序(RNAseq)或FISH检测对所有病例进行了分子分析(表3)。4例(#4至#7) FISH显示出TFE3 重排(图4)。这些病例中重排的证据充足,67%至88%的细胞呈阳性。在病例7中,重排的特征是TFE3 位点倒置,表明两个融合伴侣都位于X染色体上。二代测序检测出NONO::TFE3 融合基因,这与FISH结果一致,因为NONO 位于Xq13.1, TFE3 位于Xp11.23。
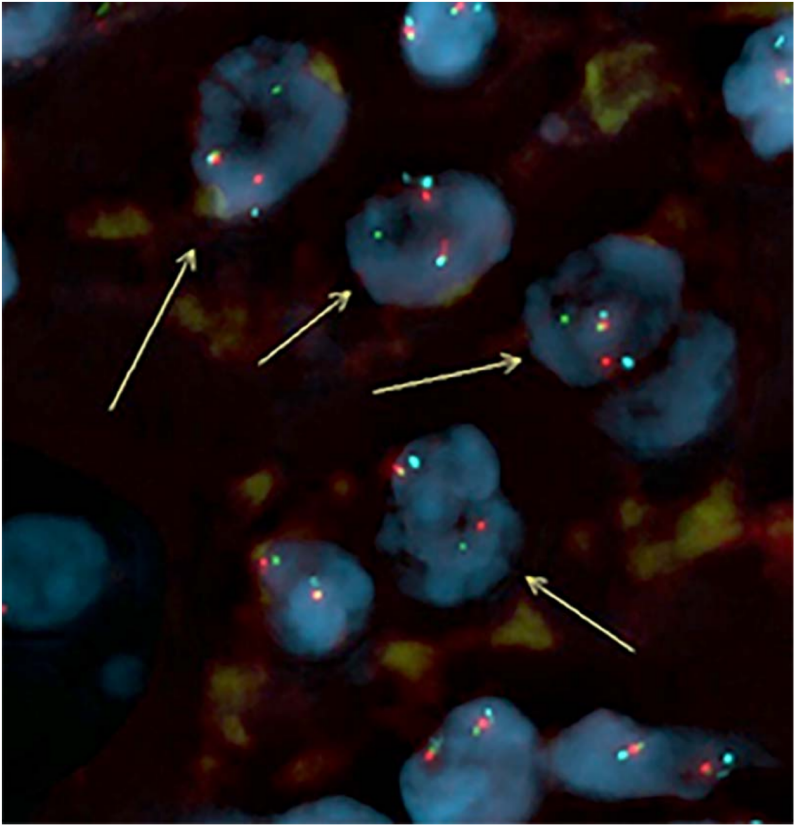
图4: FISH检测证实TFE3 基因重排(病例#4)。FISH结果表明TFE3基因重排:5 '(橙色)和3 '(绿色)信号分离(见箭头)。在病例5至7中也看到了类似的结果。
在病例1中,通过RNAseq检测出存在SFPQ::TFE3 融合基因(图5),随后的免疫组化结果也支持这一结果(TFE3显示弥漫一致的强阳性)。病例3 的TFE3为阴性,提示可能存在其他分子途径。因此,作者行RNAseq检测发现一种新的融合基因SFPQ::TFEB(图6)。值得注意的是,由于融合伴侣基因距离接近的缘故,一些TFE3 融合不能被FISH检测到。比如:RBM10::TFE3 的肾细胞癌,其两个基因都位于Xp11.23。因此,在这种情况下的阴性结果并不排除存在基因融合。
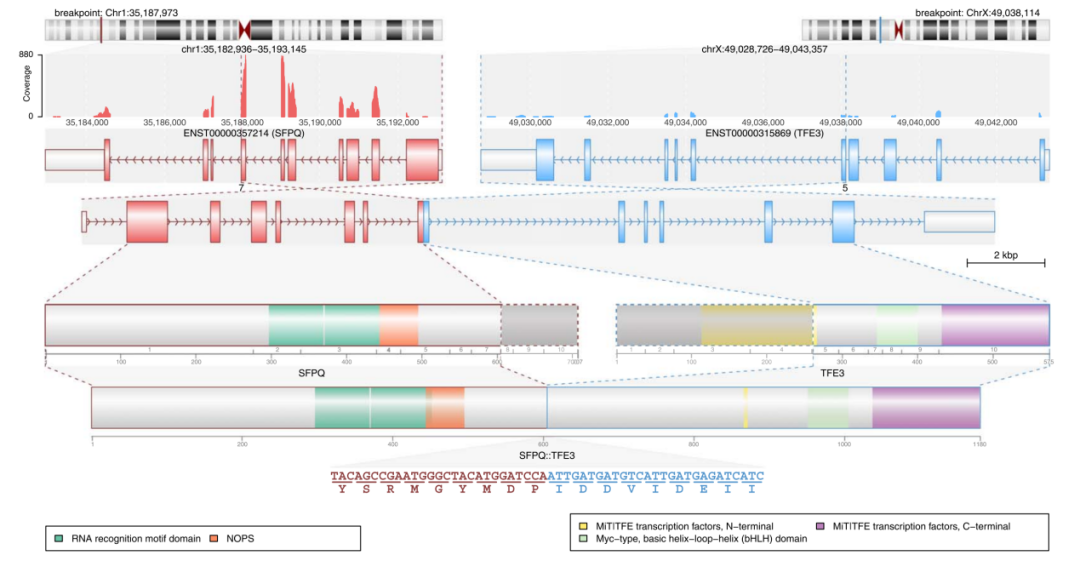
图5。SFPQ::TFE3 融合(病例#1)的细节。从上到下显示的是染色体断裂点位置,测序覆盖范围包含两个基因的内含子/外显子、单个基因和新融合基因内功能域的分布,以及DNA和氨基酸水平上精确的融合断点。
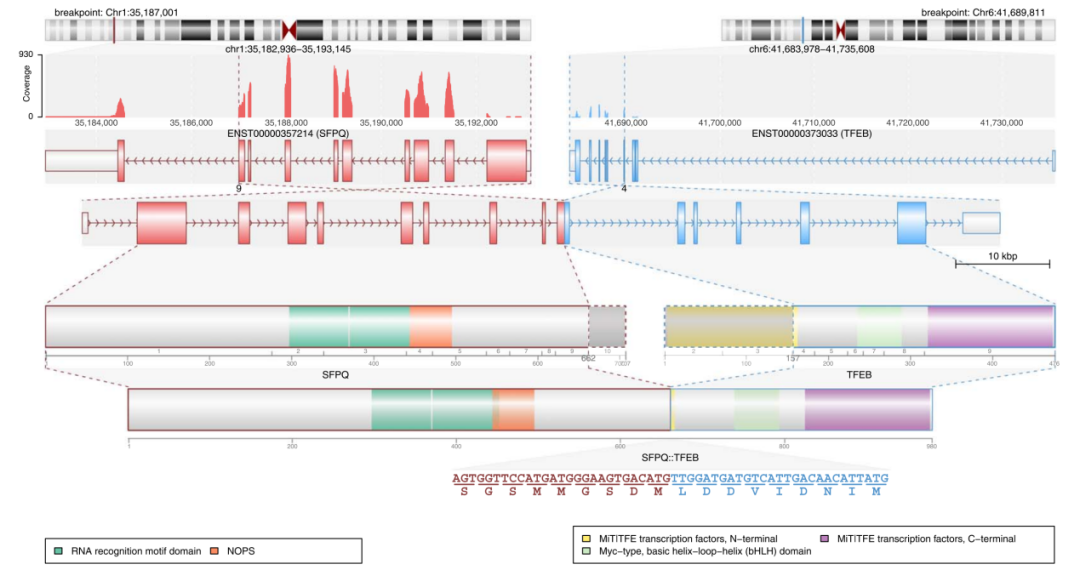
图6: SFPQ::TFEB 融合的细节(病例#3)。从上到下显示的是染色体断裂点的位置,测序覆盖范围包含两个基因的内含子/外显子、单个基因和新融合基因内功能域的分布,以及DNA和氨基酸水平上的精确断点。注意,该融合与SFPQ::TFE3 融合非常相似(图5),TFE3和TFEB的断点出现在各自基因的同一位点上。
SFPQ::TFE3 是非色素型PEComa中较常见的融合类型之一。在病例1中发现的断裂点与先前报道的病例相同。
病例3中发现的SFPQ::TFEB 融合基因值得注意。原因有二,首先,这是首例TFEB 重排的PEComa。其次,虽然SFPQ是TFE3的常见融合伴侣,但这对TFEB来说是一种新的融合伴侣。该融合中的断裂点与病例1中SFPQ::TFE3融合中所见的非常相似。SFPQ的N端片段略大(残基1-661),而TFEB的断裂点与TFE3的断裂点非常相似(图6)。因此,TFEB的C端片段(残基157-476)也保留了转录激活域。
临床随访
7例患者中有6例进行了临床随访,随访时间从9个月到7年不等,中位随访时间为2.5年。其中4名患者仍然存活,没有任何疾病迹象。一例患者(#4)在确诊4年后死于与PEComa无关的癌症。患者3,其肿瘤表现为SFPQ::TFEB 融合,经历了多次腹腔和肝脏转移,在首次手术后9个月死于疾病。
讨论
作者报道了7例色素型PEComas,分析了其临床表现、分子特征和随访情况。7例色素型PEComas中有6例与基因融合相关,这表明基因融合可能是其分子发病机制的一个关键方面,而大多数PEComa与融合无关。色素型PEComas与非色素型TFE3 重排型PEComas均具有上皮样形态,相对缺乏平滑肌分化,且HMB45的表达高于Mart-1/Melan-A的表达。因此,黑色素PEComas可能不仅代表PEComa的一个亚型,而是一小部分融合相关PEComas的一个亚型。
除了5例TFE3重排的病例外,作者还发现了一例SFPQ::TFEB融合,SFPQ尚未被报道为TFEB的融合伴侣。有趣的是,SFPQ::TFEB融合基因的排列和断点与SFPQ::TFE3非常相似。在这两种情况下,框架内融合蛋白都保留了bHLH转录激活域,预计这将导致TFEB或TFE3功能的过度活跃。目前尚不清楚为什么这些肿瘤存在大量黑色素,这是未来工作的一个重要研究内容。
色素型PEComa的鉴别诊断主要是其他具有大量黑色素的肿瘤,其本身的诊断就具有挑战性,因为色素可能掩盖形态学和IHC的发现。在真正的黑素细胞病变中,相关实体包括恶性黑色素瘤、细胞性蓝痣和所谓的色素性上皮样黑素细胞瘤。事实上,任何发生在深部或内脏部位的黑色素肿瘤通常都会引起人们对转移性黑色素瘤的关注。这些黑素细胞性肿瘤应表现出SOX10和S100的强表达,而这种表达在PEComa中并不常见。恶性黑色素性神经鞘瘤是另一个重要的鉴别诊断,在这里,SOX10和S100表达可能有帮助。如前所述,TFEB或TFE3融合的RCC也应该被考虑在内,尽管它们通常不表现出广泛的黑色素沉积。临床和影像学对于确定肾脏来源至关重要,使用肾脏特异性标记物进行IHC分析也可能有帮助。最后,婴儿色素性神经外胚层肿瘤也需进行鉴别,这种病变通常发生在婴儿中,除了胞质内富含色素的上皮样细胞外,通常还有第二种更原始的小细胞成分(神经母细胞样细胞、瘤细胞呈圆形、核深染、染色质粗糙、巢状排列),可以帮助区分婴儿色素性神经外胚层瘤和黑色素型PEComa。
PEComas有良性和恶性之分。虽然恶性肿瘤的正式标准尚未建立,但已经提出了2个或2个以上特征(直径> 5cm,浸润性生长模式,高核级和高细胞密度,核分裂象≥1/50 HPF,坏死和血管侵犯)。本研究病例中,临床随访的6例患者中,有5例表现为惰性行为,符合其良性的形态学特征。然而,1例TFEB重排病例表现为侵袭性生物学行为,在首次手术切除9个月后发生转移并死亡。根据上述标准可将其归类为恶性肿瘤(直径为18cm,核分裂象为1/10 HPF),但值得强调的是,其整体形态学表现为低级别,在其他方面难以与另外6例区分。TFEB重排和TFE3重排病例也没有明显的形态学特征进行区分。虽然不能根据这1例病例进行概括。随着越来越多的病例被发现,确定侵袭性行为是否是TFEB重排PEComas的一般特征将至关重要。
总之,作者在此报告了7例色素型PEComa,包括第一例TFEB重排的PEComa。这些发现扩大了PEComa的形态学和分子谱。认识到这一实体对于准确诊断这类伴有大量色素沉着的肿瘤将会至关重要。


