药学权威期刊万字综述:BTK抑制剂的过去、现在和将来
时间:2024-07-25 18:01:15 热度:37.1℃ 作者:网络
BTK抑制剂
Bruton酪氨酸激酶 (BTK) 抑制剂彻底改变了 B 细胞淋巴瘤(如慢性淋巴细胞白血病[CLL])的治疗前景,已有多款共价 BTK 抑制剂上市,但BTK抑制剂仍面临耐药突变的挑战。非共价 BTK 抑制剂 pirtobrutinib 最近获得FDA批准用于复发和难治性CLL,未来非共价 BTK 抑制剂是否会取代共价BTK 抑制剂(单药或联合治疗)作为一线治疗选择也未可知。此外,新型BTK 抑制剂和 BTK 降解剂也竞争其在 B 细胞肿瘤以及自身免疫性疾病的潜在未来前景中的地位。
《Trends in Pharmacological Sciences》近日发表综述,阐述了BTK 抑制剂的最新进展和未来方向。该杂志是美国著名出版集团Cell Press旗下的药理学权威期刊,是国际公认的药学研究领域最顶尖的综述杂志之一,当前影响因子13.9。

BTK是容易产生耐药性但有吸引力的靶点
B 细胞受体 (BCR) 信号是正常情况下在获得性免疫中起关键作用的重要信号通路。抗原结合BCR时启动信号传导通路,最终导致 B 淋巴细胞增殖和分化(图1)。
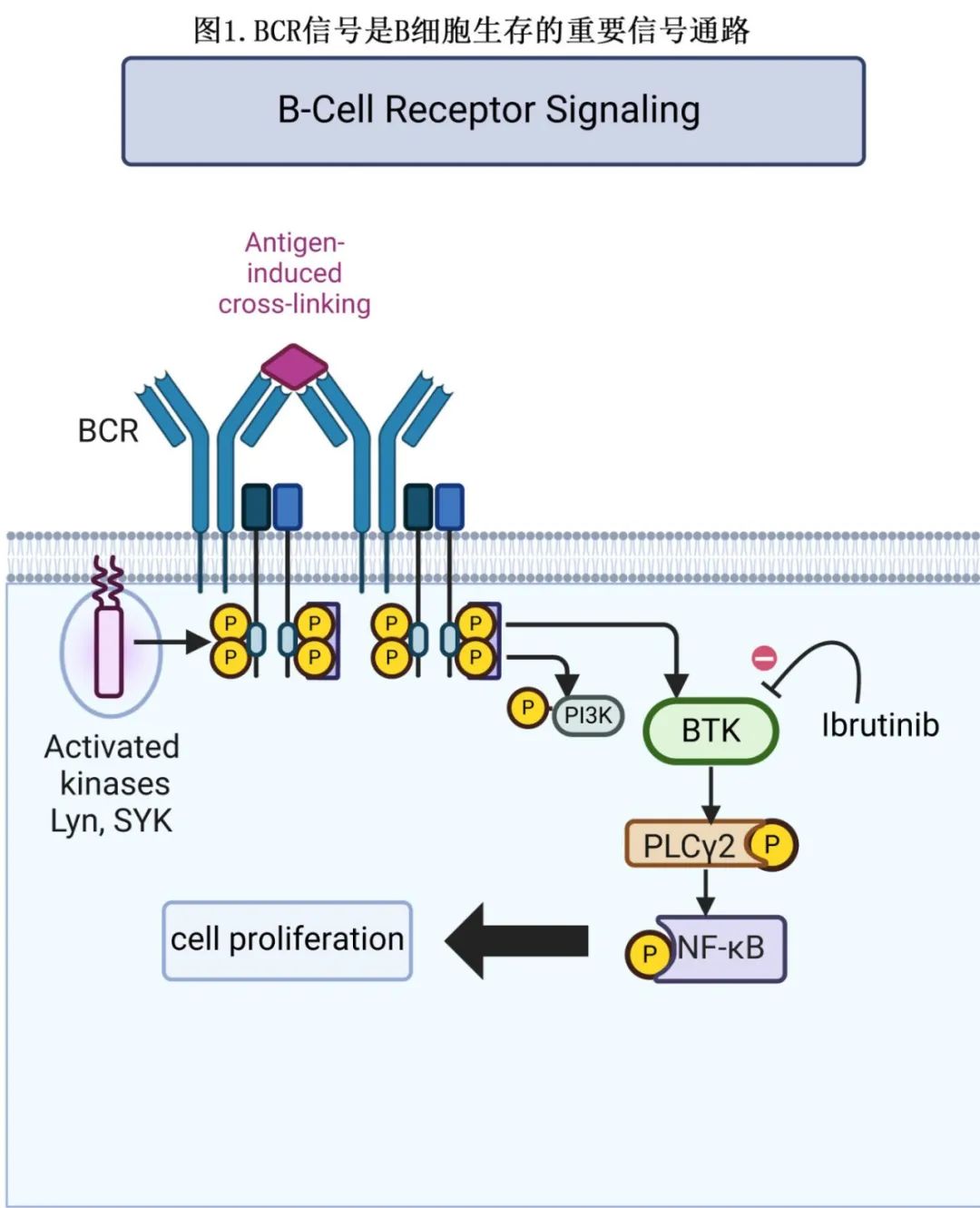
参与该通路的关键分子包括 BCR 本身、Lck/Yes相关新型蛋白质酪氨酸激酶 (LYN)、脾酪氨酸激酶 (SYK)、BTK和磷酸肌醇3-激酶 (PI3K)。LYN和 SYK 均在磷酸化 BTK 中发挥作用,从而激活BTK,并导致下游底物如磷脂酶C-γ2(PLCγ2) 的激活。BCR信号传导在部分B 细胞淋巴瘤中失调,如CLL、套细胞淋巴瘤 (MCL)、华氏巨球蛋白血症 (WM) 和自身免疫性疾病(BOX1)。

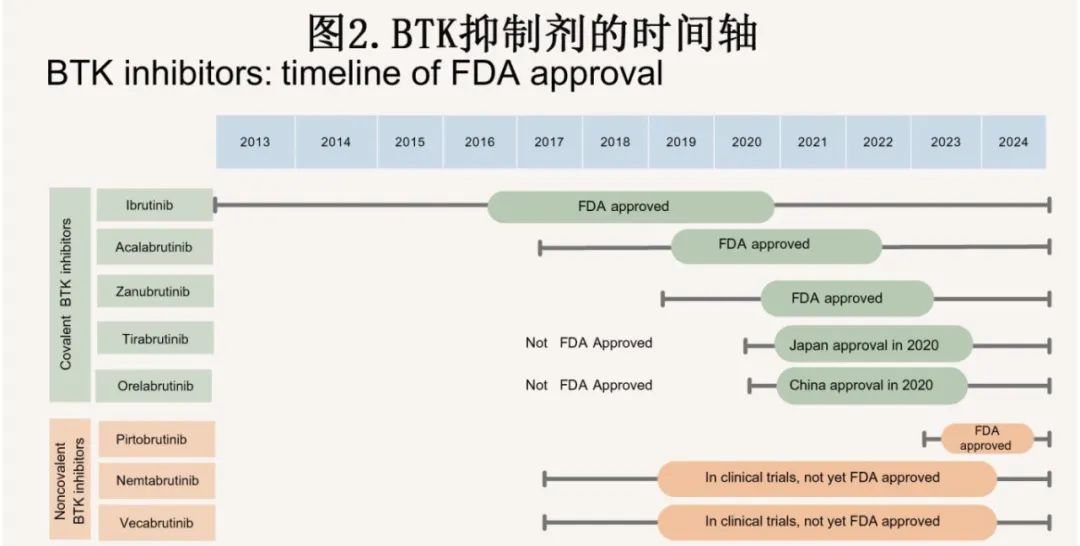
BTK 在 B 细胞和其他造血细胞(包括巨噬细胞、肥大细胞和血小板)中表达,但在 T 细胞中不表达。由于 BTK 在 BCR 信号通路的上游和重要位置,加之其在其他细胞类型中的表达有限,BTK是一个很好的抑制性药物靶点。BTK抑制剂已成为多种 B 细胞恶性肿瘤的标准治疗(图2)。
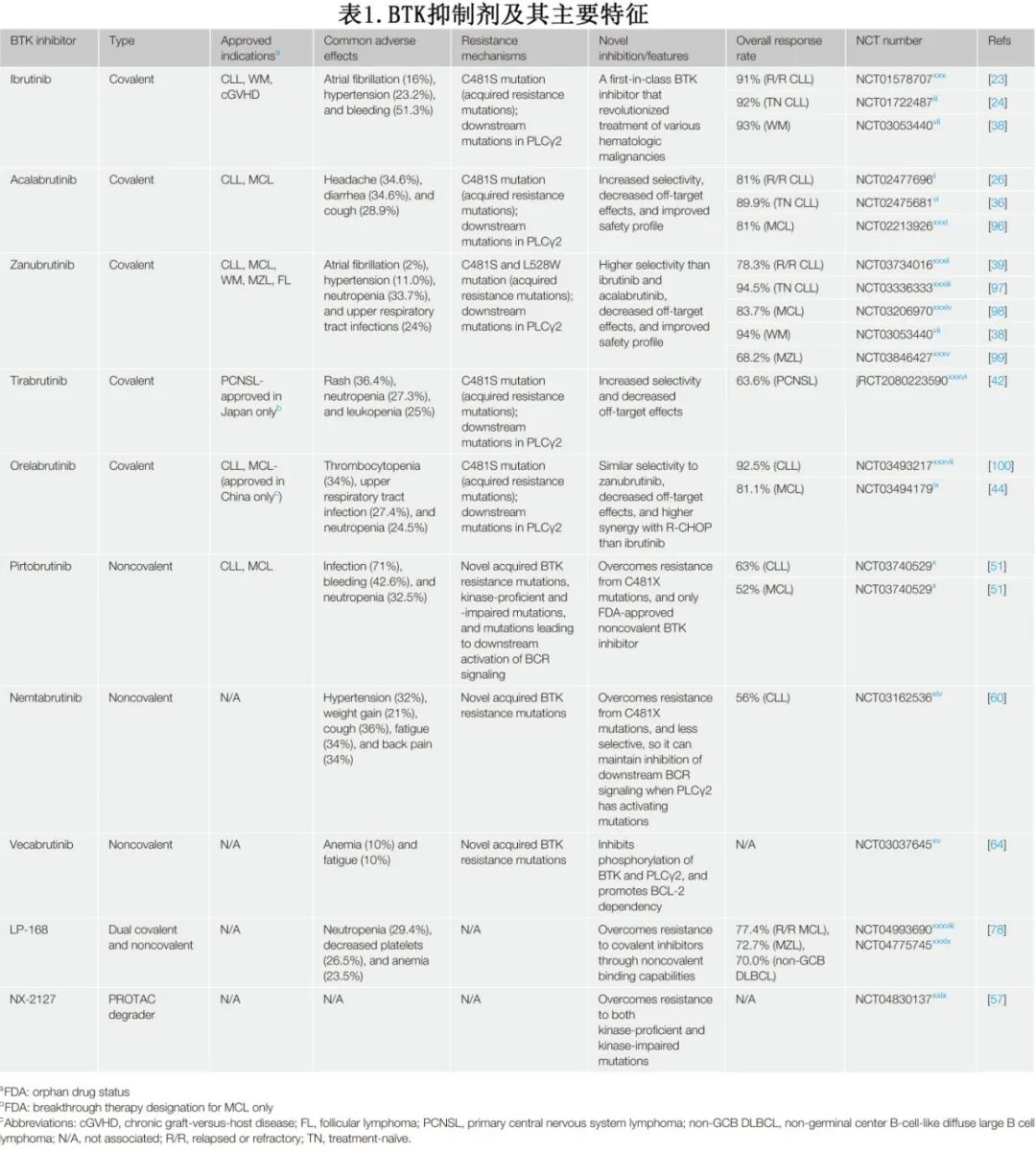
尽管在抑制 BTK 方面取得了成功,也仍存在挑战,包括耐药突变、通过激活替代通路产生的耐药性和不良反应(表1)。
下文讨论共价 BTK 抑制剂、非共价 BTK 抑制剂以及已经进行或正在进行的基础、转化和临床研究。最近发现激酶受损的 BTK 耐药突变,表明这些突变可对获批的 BTK 抑制剂产生耐药性,因此在设计未来的 BTK 抑制剂试验时,必须考虑这些因素。作者还阐明了后续的路线图,包括替代 BTK 抑制剂、BTK降解剂和联合治疗。
共价BTK抑制剂:强效药物
共价 BTK 抑制剂与其 ATP 结合口袋内 BTK 的半胱氨酸 481(C481) 残基形成不可逆的共价键。抑制BTK可导致主要下游信号通路(如PLCγ2)的激活受损,阻止恶性 B 细胞增殖并促进其凋亡。但长期使用共价 BTK 抑制剂可导致通过 BTK 结合位点 (C481) 突变或通过激活 BTK 下游底物PLCγ的突变而产生获得性耐药。临床前分析显示,共价抑制剂对C481S突变细胞几乎没有活性,从而导致对其获得性耐药的患者构成潜在挑战。其他 BTK 抑制剂可解决伊布替尼抑制剂的副作用,其选择性提高,从而限制了伊布替尼的脱靶毒性。新型共价 BTK 抑制剂在初治和复发性或难治性疾病中具有耐受性优势。CLL等疾病的标准一线治疗现在已经转向使用共价 BTK 抑制剂或 BCL-2抑制剂维奈克拉,联合 CD20 单克隆抗体奥妥珠单抗。
伊布替尼:首创BTK抑制剂
伊布替尼是首个BTK 抑制剂,FDA 于2013年批准(图2)。与传统的免疫化疗相比,它彻底改变了血液恶性肿瘤如MCL、边缘区淋巴瘤 (MZL)、WM以及CLL 的治疗格局,但其 MCL 和 MZL 适应症的批准已被撤销。多项研究证明伊布替尼可改善治疗结局。在一项包含85例复发或难治性 CLL 患者的 Ib/II 期研究中总缓解率为71%。一项纳入111例复发或难治性 MCL 患者的2期研究显示总缓解率为67.6%。CLL的治疗已从烷化剂发展到免疫化疗,虽然仍在不断探索,但即使使用奥法妥木单抗(ofatumumab)等药物,复发或难治性 CLL 的有效挽救治疗仍存在挑战。伊布替尼不仅作为挽救治疗比奥法妥木单抗更有效,其与标准治疗苯丁酸氮芥作相比,作为CLL一线治疗同样更有效。III期RESONATE研究中,伊布替尼组的总生存率和总缓解率(90%和42.6%)高于奥法妥木单抗组 (81%和4.1%)。此外,考察伊布替尼对比苯丁酸氮芥作为一线药物的 III 期 RESONATE-2 研究表明,伊布替尼治疗患者的死亡或进展相对风险降低84%,总缓解率 (86%) 高于苯丁酸氮芥 (35%)。但在接受伊布替尼治疗的 CLL 患者中进行了扩展观察,RESONATE研究表明,28%的患者因为不良反应中止治疗,如房颤 (16%)、高血压 (23.2%) 和出血 (51.3%)。这些心脏副作用是由于表皮生长因子受体 (EGFR)、Src和 Tec 家族激酶的脱靶抑制所致。
伊布替尼治疗原发性或继发性中枢神经系统疾病的有效性依赖于其跨血脑屏障分布的能力。,原发性中枢神经系统淋巴瘤 (PCNSL) 复发率极高,没有确定的挽救治疗,而伊布替尼显示出对 PCNSL 的治疗前景。伊布替尼可损害 BCR 信号传导,降低信号通路下游的核因子κβ (NF-κB) 活性,后者激活时可促进 B 细胞淋巴瘤增殖。
在3期 PHOENIX 研究中,伊布替尼联合弥漫性大 B 细胞淋巴瘤 (DLBCL) 的标准一线方案R-CHOP仅改善年轻患者(<60岁)的结局,可能是由于不良反应的耐受性更好。上述患者(<60岁)中,伊布替尼+R-CHOP组的 OS 改善程度大于安慰剂 +R-CHOP组(分别为93.2%和80.9%)。伊布替尼+R-CHOP组的 SAE 发生率高于R-CHOP+安慰剂组(分别为53.1%和34.0%)。老年人(≥60岁)毒性增加,导致 R-CHOP 给药受损。伊布替尼是一种非常有效的药物,但其毒性仍是重大挑战。该结果导致了更多共价 BTK 抑制剂的开发,阿可替尼是下一个获得批准的药物。
阿可替尼:BTK抑制剂的重大进展
伊布替尼给药后共价 BTK 抑制剂的开发旨在最大限度减少脱靶不良反应,同时保留对 BTK 的靶向效力。阿可替尼治疗复发或难治性 CLL 患者(包括对伊布替尼不耐受的患者)具有疗效。此外根据一项在复发或难治性和初治患者中使用阿可替尼的随机 II 期研究,其在初治 CLL 患者中也安全有效。该研究显示,初治患者和复发或难治性 CLL 患者的24个月无进展生存率 (PFS)分别为100%和84.3%。由于对上述伊布替尼脱靶效应的抑制作用极小,因此阿可替尼的安全性特征有所改善。在 III 期 ELEVATE-RR 非劣效性研究中进行头对头比较,发现阿可替尼的 PFS 不劣于伊布替尼,两组的中位 PFS 均为38.4个月。在随机分配的533例患者中,14.7%因毒性而停用阿可替尼,而伊布替尼组为21.3%,证明前者的优越耐受性。尽管心脏不良反应减少,但在阿可替尼(6.2%) 与伊布替尼 (14.9%) 治疗期间仍有部分CLL患者发生房颤。在该研究中,阿可替尼最常见的副作用包括头痛 (34.6%)、腹泻 (34.6%) 和咳嗽 (28.9%)。同样,纳入7项研究的(n=610)阿可替尼汇总安全性分析发现,最常见的治疗相关不良事件为头痛 (29.2%) 和腹泻 (16.6%)。开发最佳联合疗法是目前 CLL 的主要焦点。ELEVATE-TN 研究证实阿可替尼联合奥妥珠单抗的24个月 PFS 为93%,而阿可替尼单药治疗为87%。尽管该药物耐受性良好,但耐药机制仍存在问题,患者通常因疾病进展而非毒性而停药。由于 BTK 抑制剂领域仍存在未满足的需求,因此开发了泽布替尼,并证明其具有强效和选择性。
泽布替尼:BTK抑制的进一步发展-降低毒性并提高疗效
与阿可替尼开发背后的原理相似,泽布替尼的开发旨在降低患者的毒性,2021年 FDA 批准用于WM,便可反映该目的。ASPEN 研究是一项在 WM 患者中比较泽布替尼与伊布替尼的 III 期研究。泽布替尼组的毒性发生率低于伊布替尼,如房颤(泽布替尼为 2% vs 伊布替尼为15%)和高血压 (11% vs 16%)。泽布替尼组的中性粒细胞减少症发生率高于伊布替尼组(33.7%和19.4%),但两组的上呼吸道感染发生率相似,分别为24%和29%。头对头优效性ALPINE研究纳入652例患者,经独立审查委员会确定,泽布替尼在 CLL 患者中的总体缓解率优于伊布替尼(分别为86.2%和75.7%)。泽布替尼组 (5.2%)房颤发生率低于伊布替尼组 (13.3%),但高血压的发生率相似(分别为23.5%和22.8%)。该不良反应特征与ASPEN 研究中WM 患者相比存在差异,其中泽布替尼组的房颤和高血压发生率均较低。与其他共价 BTK 抑制剂相似,泽布替尼的耐药性仍存在挑战。除 C481 位点突变外,其他位点的获得性突变(如L528W)也可能导致泽布替尼耐药。已经开发了其他 BTK 抑制剂,但目前旨在治疗 CLL 以外的其他类型淋巴瘤,如 PCNSL 和DLBCL。
Tirabrutinib:PCNSL中的疗效和耐受性
Tirabrutinib 是一种不可逆 BTK 抑制剂,可与 Cys481 共价结合。在一项临床前研究中,tirabrutinib抑制 BTK 的速率与阿可替尼相似,但比伊布替尼低10倍以上。目前仅在日本获批用于治疗PCNSL。其PROSPECT研究(一项在美国复发或难治性 PCNSL 患者中评价 tirabrutinib 的2期研究)的入组刚刚开始。日本一项评价 tirabrutinib 治疗44例 PCNSL 患者的1/2期研究的3年随访报告总缓解率为63.6%,最常见不良反应为皮疹 (36.4%)、中性粒细胞减少症(27.3%) 和白细胞减少症(25.0%)。早期临床试验表明,tirabrutinib对复发或难治性 CLL 和 WM 也有疗效。由于缺乏 PCNSL 的挽救治疗,对于不耐受伊布替尼相关毒性的患者,tirabrutinib可能是一种更安全的替代药物;但它尚未在美国获批。另一种在其他国家获批的 BTK 抑制剂是奥布替尼。
奥布替尼:揭示BTK抑制剂的潜力
奥布替尼目前仅在中国获批用于 MCL、MZL和CLL,但正在开展进一步研究以研究其治疗潜力。奥布替尼与泽布替尼的激酶选择性相当,选择性高于阿可替尼和伊布替尼。在中国进行的一项 I/II 期研究纳入106例接受奥布替尼治疗的复发或难治性 MCL 患者,106例患者中86例接受 150 mg 每日一次治疗、20例100 mg 每日两次治疗,仅评估了前者的治疗结局,因其缓解率更优,为81.1%。150 mg每日一次剂量是首选II 期剂量,在药代动力学和药效学研究中也更优。最常见不良事件为血小板减少症(34.0%)、上呼吸道感染 (27.4%) 和中性粒细胞减少症(24.5%)。体外研究表明,与伊布替尼相比,对于DLBCL 患者,在 R-CHOP 治疗的基础上加用奥布替尼具有协同作用。目前正在进行一项 III 期、随机、双盲、多中心研究,以评价奥布替尼联合 R-CHOP 与 R-CHOP 相比治疗MCD亚型初治DLBCL的疗效和安全性。
尽管已获批的共价 BTK 抑制剂具有较强的临床价值,但其毒性和耐药性可限制其长期疗效,从而促进了非共价 BTK 抑制剂的开发。
非共价BTK抑制剂可克服BTK C481耐药突变
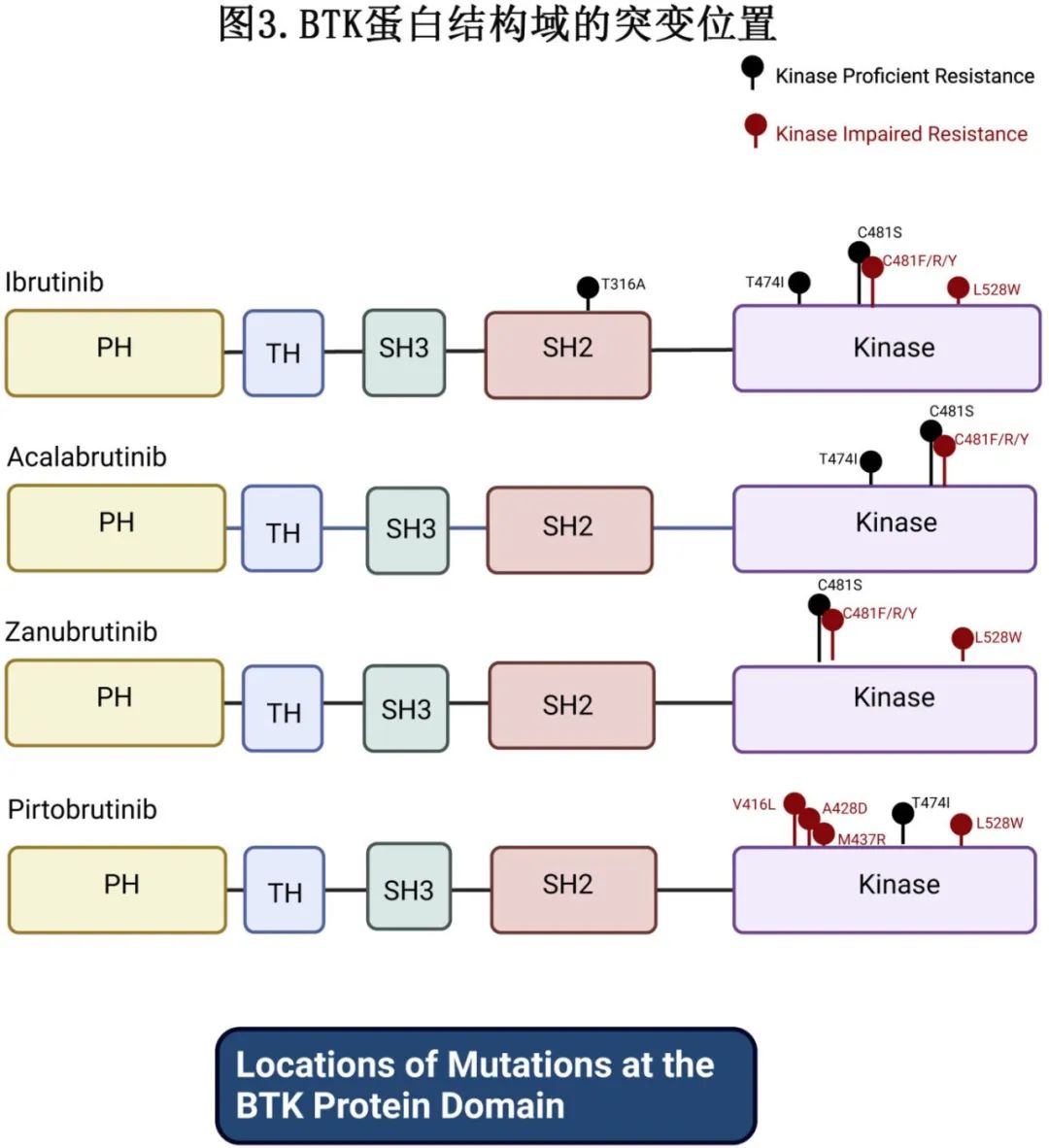
非共价 BTK 抑制剂不与 Cys481 结合,也不阻断野生型 (WT) 和 Cys481 突变型 BTK 的活性,为共价 BTK 抑制剂治疗后因 C481 突变导致疾病进展的患者创造了一种替代方案。到目前为止唯一获批的非共价 BTK 抑制剂 pirtobrutinib 通过广泛的氢键与 ATP 结合位点附近的水分子和 BTK 残基相互作用。虽然非共价 BTK 抑制剂可以有效治疗伊布替尼耐药的 C481 突变BTK,但信号通路下游耐药性的产生仍存在挑战,特别是通过激活涉及PLCγ2的突变而产生的耐药性。此外,通过对接受非共价 BTK 抑制剂治疗后疾病进展的患者进行测序,发现了新的获得性 BTK 突变(图3)。非共价 BTK 抑制剂最成熟的数据是pirtobrutinib。
Pirtobrutinib:首创的可逆BTK抑制剂
Pirtobrutinib 是首个也是目前唯一获得 FDA 批准的非共价、可逆 BTK 抑制剂。在其他 C481X 突变中,其对 C481S 突变细胞的抑制具有高度选择性。即使没有 C481 突变,Pirtobrutinib也表现出对耐药性 B 细胞恶性肿瘤的活性。该机制标志着 BTK 抑制剂的重要发展,因为 C481 突变是 CLL 中共价 BTK 抑制剂的主要耐药机制。在I/II 期BRUIN研究中,317例 CLL 患者在共价 BTK 抑制剂治疗期间疾病进展后接受Pirtobrutinib单药治疗,显示出作为首个可逆性 BTK 抑制剂的前景,总缓解率为73.3%,仅2.6%的患者因治疗相关不良反应而停药,与伊布替尼存在明显差异;最常见的不良事件为感染 (71.0%)、出血 (42.6%) 和中性粒细胞减少症 (32.5%)。BRUIN研究后续队列也报告了Pirtobrutinib+维奈克拉(93.3%,n=15) 与Pirtobrutinib+维奈克拉+利妥昔单抗 (100%,n=10) 联合治疗的总缓解率。一项 III 期头对头研究BRUIN CLL-322对Pirtobrutinib+维奈克拉+利妥昔单抗联合治疗的可能性进行了研究,并与维奈克拉+利妥昔单抗进行对比。另一项 III 期研究 BRUIN MCL-321 正在进行,在既往接受过一种治疗的 BTK未暴露MCL患者中比较Pirtobrutinib与三种其他 BTK 抑制剂。一项2期研究最近启动,研究Pirtobrutinib+奥妥珠单抗作为初治 CLL 患者的一线治疗。如果显示有前景的治疗结局,则需要使用当前一线治疗进行头对头研究,或可在该患者中产生新的标准治疗。
目前Pirtobrutinib的挑战在于,在复发的CLL患者的基因组分析中发现许多非c481 BTK突变,这些脱靶突变允许通过激活 AKT 信号通路进行 BCR 信号传导,证明存在不同于BTK的自主性。激酶富集突变可通过维持 BTK 的激酶活性促进 BCR 信号传导,而激酶受损突变使 BTK 的激酶活性丧失,但仍通过激活下游替代激酶维持 BCR 信号传导。其他激酶结构域突变也在非共价 BTK 抑制剂(如Pirtobrutinib)中发现,其中L528W值得注意,该耐药机制使 BTK 激酶受损,并独立于 BTK 激活 BCR 信号。其他非共价 BTK 抑制剂如 nemtabrutinib 在临床使用中是否会对这些新的耐药机制敏感仍有待观察,但临床前数据表明它们很有可能。
Nemtabrutinib:利用恢复性(resilience)以改善治疗结局
Nemtabrutinib 具有与 pirtobrutinib 相似的机制,均具有可逆性抑制 WT BTK 和 C481 伊布替尼耐药性 BTK 的能力,通过与 BTK 的 E475 和 Y476 残基形成氢键维持其抑制作用。临床前研究表明,与其他非共价 BTK 抑制剂相比,它可以维持对下游 BCR 信号的抑制,即使在PLCγ激活突变的患者中也是如此。开发 nemtabrutinib 的目的是靶向其他激酶,如 Tec 和Src,这是因为假定其反应更稳健且有恢复性(resilient),可改善复发或难治性患者的治疗结局。然而额外的激酶抑制也可能导致不良反应,正如伊布替尼的高停药率所示,主要是由于心脏效应。在一项1期研究 MK-1026 中,B 细胞恶性肿瘤患者使用 nemtabrutinib 显示出可管理的总体安全性,大多数不良反应为1级和2级,但87%的患者至少发生1起≥3级不良事件。最常见的毒性包括高血压 (32%)、体重增加 (21%)、咳嗽 (36%)、疲乏 (34%) 和背部疼痛 (34%)。目前复发或难治性疾病的有效治疗非常有限,其中之一为 B 细胞淋巴瘤 2(BCL-2) 抑制剂维奈克拉,临床前研究显示nemtabrutinib联合维奈克拉具有一定潜力。
Vecabrutinib:联合治疗的挫折和开创性路径
Vecabrutinib的临床前特征强调了其可通过抑制 BTK 及其下游靶点PLCγ2的磷酸化来抑制 WT 和突变型 BTK 细胞。复发性 DLBCL 的体外研究显示对vecabrutinib敏感,但对伊布替尼耐药。一项Ib 期研究评估vecabrutinib的临床反应,但未达到其终点。因此,尽管在患者中耐受良好,但未进入2期研究。Vecabrutinib耐受性良好贫血 (10%) 和疲乏 (10%) 是最普遍的治疗相关不良事件。目前还没有临床试验研究vecabrutinib。尽管vecabrutinib未显示出作为 CLL 单药治疗的前景,但它作为 BCL-2 抑制剂维奈克拉联合治疗的一部分的潜力已进行临床前研究。在vecabrutinib中发现的一个新属性在于其可促进 BCL-2 依赖性(这与伊布替尼不同),使其成为联合治疗的选择,与维奈克拉相似。与维奈克拉的协同作用可能是非共价 BTK 抑制剂克服可能限制其作为一线单药治疗中耐药机制的一种方式。
靶向BTK以规避耐药的未来方向
靶向 BTK 的新方向包括 BTK 抑制剂联合 BCL-2 抑制剂,以帮助克服耐药性并为患者创造更好的治疗选择。BCL-2可作为 B 细胞淋巴瘤患者促生存通路的一部分而上调,导致对 BTK 抑制剂耐药;因此BCL-2抑制剂治疗有可能使患者对 BTK 抑制重新敏感。体外和体内研究均充分支持 BTK 抑制剂与 BCL-2 抑制剂之间的协同效应。
伊布替尼和维奈克拉:克服耐药的新进展
伊布替尼和维奈克拉均可作为多种 B 细胞恶性肿瘤的单药治疗,但它们均有各自的局限性,包括耐药性、不良反应和剂量限制性毒性。多个临床试验旨在评估伊布替尼联合维奈克拉是否为 B 细胞淋巴瘤患者提供更多的治疗选择。AIM研究是在澳大利亚进行的一项2期研究,纳入复发或难治性MCL、初治MCL 或不适合化疗的患者。患者接受伊布替尼 560 mg/天口服给药4周,然后在第5周期间,引入维奈克拉50 mg/天,每周增加剂量至400 mg。在主要终点(第16周)时,接受联合治疗的患者完全缓解率(无PET评估)为42%。该研究将其与接受伊布替尼单药治疗的患者历史队列进行比较,结果显示无 PET 评估的完全缓解率仅为9%。最常见的不良事件包括腹泻 (83%)、恶心和呕吐 (71%)、胃食管反流 (38%)、疲乏 (75%) 和出血 (54%)。该研究认为,维奈克拉每天 50mg 的起始剂量太高,患者从每天 20mg 开始时则不良反应不太严重。在既往未接受过治疗的 CLL 患者中开展了一项伊布替尼联合维奈克拉的2期非随机研究。患者前3个周期接受 420 mg/天伊布替尼(每周期28天),然后引入维奈克拉,起始剂量为 20mg/天,随后每周递增至400 mg/天。5例患者在单药治疗期间中止治疗,其余75例患者继续联合治疗。在研究结束时,3年 PFS 为93%,66%的患者骨髓检测不到可测量残留病 (U-MRD) ,大于单药治疗的结果。该结果与另一项使用伊布替尼联合维奈克拉治疗 CLL 的2期研究 CAPTIVATE 的结果相似:联合治疗12个周期后U-MRD率为68%,联合治疗的大部分不良事件为1级和2级且发生于治疗早期,最常见的3级和4级不良事件为中性粒细胞减少症(36%)、高血压 (10%)、血小板减少症(5%) 和腹泻 (5%)。另一项评估伊布替尼联合维奈克拉的研究是3期GLOW研究。此外,新的 BTK 抑制剂(如泽布替尼和pirtobrutinib)正在临床试验中与维奈克拉联合治疗血液恶性肿瘤。此外,有研究正在使用更强效的 BCL-2 抑制剂 sonrotoclax 联合泽布替尼治疗 CLL。
超越传统BTK抑制剂
除联合治疗外,正在开发一种 BTK 抑制剂新药,旨在最大限度地减少副作用和减少耐药性。这种新型抑制剂 LP-168 是一种双重抑制剂,能够以共价和非共价的形式结合(取决于突变);LP-168共价结合WT BTK,非共价结合突变的BTK 残基。一项 I 期研究评估了 LP-168 的安全性和有效性,入组68例既往至少接受过一线共价 BTK 抑制剂的多种 B 细胞恶性肿瘤患者。患者按照3 + 3剂量递增(从 100 mg 递增至 150 mg 再递增至200 mg)接受治疗,不良反应轻微,大多数为1级或2级,中性粒细胞减少 (29.4%)、血小板减少 (26.5%) 和贫血 (23.5%)是最常见的不良反应。另一项1期研究发现,LP-168在患者中耐受良好,高达 300 mg 的剂量未达到最大耐受剂量。
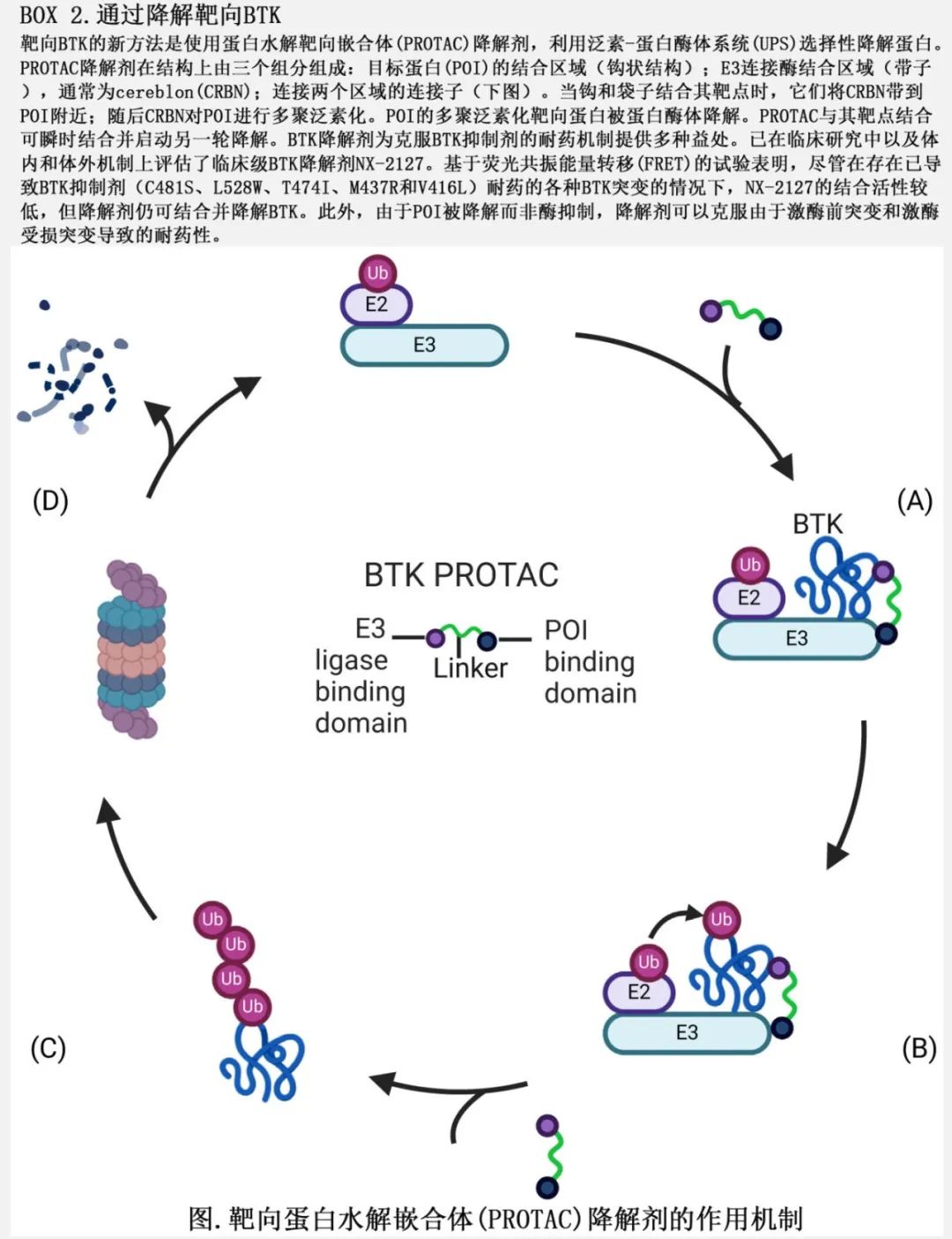
此外,靶向 BTK 的另一种新兴治疗选择是使用 BTK 降解剂(BOX 2)。一种首创BTK 降解剂 NX-2127 正在复发或难治性 B 细胞恶性肿瘤中进行I期研究。对入组 CLL 或小淋巴细胞淋巴瘤 (SLL) 患者的中期分析显示,尽管23例患者中有10例携带 BTK 突变,但仍对 NX-2127 有反应。此外,还有两种 BTK 降解剂,NX-5948 和 BGB-16673,正在进行临床试验。NX-5948的初步结果表明具有临床疗效且患者耐受性良好,最常见的不良反应为紫癜或挫伤 (57.1%)、恶心 (35.7%) 和血小板减少症(35.7%)。BGB-16673 I期研究的初步结果表明,在18例缓解可评价的患者中,12例缓解,其余患者为部分缓解。尽管 BTK 降解剂取得成功,但仍要认识到随着时间的推移可能出现潜在挑战。与大多数药物一样,长期使用可能导致耐药突变的发生,这些突变可能出现在 BTK 内本身或在 cereblon(CRBN) 内,目前大多数正在评估的降解剂都使用E3连接酶。
结论和未来展望
BTK 抑制剂首次获批用于治疗 B 细胞淋巴瘤并已成为重磅疗法已有十多年的历史。小分子 BTK 抑制剂的进展导致了更具选择性、更强效和毒性更小的化合物。尽管大多数 CLL 患者对单药治疗 BTK 抑制剂有多年缓解,但需要持续治疗,最终会出现 BTK 或PLCγ2耐药突变。共价抑制剂对 C481 突变具有独特的敏感性,因为其依赖于与该残基的结合。非共价 BTK 抑制剂可克服该局限性,但仍对新型 BTK 激酶结构域突变敏感。BTK L528W、V416L和 A428D 被归类为激酶受损耐药突变,而 BTK C481S 和 T474I 具有激酶特异性。BTK降解物仍在进行临床试验,但早期结果表明它们可以克服激酶受损和激酶精通获得性BTK耐药突变,然而尚不清楚其是否可靶向下游PLCγ2激活突变。BTK抑制剂与 BCL-2 抑制剂联合治疗的固定持续时间治疗显示出作为一种时间限制性治疗的前景。到目前为止,联合治疗后复发的 CLL 患者未获得BTK、PLCγ2或 BCL-2 耐药突变。
尽管在BTK 作为靶点方面取得了显著的基础、转化和临床进展,但许多问题仍未得到解答。在 CLL 中,非共价 BTK 抑制剂仅获批于两线治疗后(包括既往共价 BTK 抑制剂);然而,如果非共价 BTK 抑制剂一线治疗的临床试验导致其在该领域获批,则共价和非共价 BTK 抑制剂的最佳排序就可以通过具体 BTK 抑制剂的副作用特征来确定,否则就需要进一步的临床试验来阐明 BTK 抑制剂的最佳排序。即使是现在,在一线 CLL 中选择共价 BTK 抑制剂时,也没有数据表明阿可替尼或泽布替尼是否更好。就副作用特征而言它们都比伊布替尼更耐受,但尚未进行头对头研究,并且与伊布替尼相比的研究设计差异很大,无法进行交叉试验比较。匹配校正的间接比较 (MAIC) 结果也相互不一致。从治疗 CLL 的医生的角度来看,BTK抑制剂是很好的选择,副作用特征和给药频率有助于区分哪一种可能最适合某位患者。随着其他共价 BTK 抑制剂的研究,必须了解是否已经拥有同类最佳的共价 BTK 抑制剂,或者是否需要更多。或者,重点应该是否应在于开发对耐药机制不太敏感的 BTK 靶向治疗或联合方案?尚不知道是否激酶受损的 BTK 耐药突变可导致对所有获批的 BTK 抑制剂产生临床耐药性。在接受伊布替尼、泽布替尼和pirtobrutinib治疗的患者中报告了激酶受损的 BTK L528W 耐药突变,这些突变对 BTK 降解剂敏感,但其安全性和有效性仍在研究中。BTK 抑制剂联合 BCL-2 抑制剂似乎安全有效,可提供固定持续时间治疗,且作为后续治疗(再治疗)也可能同样有效,但长期结果仍有待确定;比较不同选择的随机试验正在进行中。目前,尚无 BTK 抑制剂和 BCL-2 抑制剂联合治疗耐药机制的报告,但了解导致复发的原因对于改善联合治疗和获得长期缓解非常重要。
参考文献
Cool A, et al. BTK inhibitors: past, present, and future.Trends Pharmacol Sci . 2024 Jul 17:S0165-6147(24)00137-8. doi: 10.1016/j.tips.2024.06.006.


