鲁凤民教授:多指标联合提高原发性肝细胞癌诊断性筛查效能
时间:2024-08-21 18:00:32 热度:37.1℃ 作者:网络
前言
原发性肝癌是全球常见的恶性肿瘤之一,2020年全球肝癌年新发90.6万例、死亡83.1万例,我国分别占45%和47%,严重威胁人民生命健康。因此,普及肝癌的早筛早诊至关重要。近日,北京大学基础医学院鲁凤民教授分享《多指标联合提高原发性肝细胞癌诊断性筛查效能》,肝癌在线特将精彩内容整理成文,供临床医生参考。
一 研究背景
WHO更新2030年病毒性肝炎消除目标:1、90%的慢性乙型肝炎病毒(HBV)感染者被诊断;2、80%的慢乙肝患者被治疗[1]。在我国,乙肝相关肝癌占80%以上。早期诊断的HCC患者5年生存率约70-75%,晚期HCC患者平均生存时间<1年[2]。因此,普及肝癌早筛早诊是当下我国降低慢性HBV感染相关病死率的不二选择。
HBV不断将自身DNA整合入宿主DNA,整合赋予肝细胞增殖优势。慢性肝脏炎症所致反复的肝细胞损伤与携带整合肝细胞的代偿性增殖,导致克隆性细胞集落形成,使肝细胞癌(HCC)发病风险升高。核苷(酸)类似物(NAs)阻断新整合事件发生,但是,对即存整合作用乏力[3]。
我国慢性乙型肝炎患者诊治面临的挑战包括:大多数慢性HBV感染者并未被诊断、大多数患者未接受规范抗病毒治疗或启动治疗较晚,HCC发生风险并未完全消除。疾病进程30-50年>20%的慢性乙肝患者会发展为肝硬化和/或肝癌。由此,我们做出了相应的对策,2022版中国指南提到>30岁即治疗,约92%的患者需要立即开展抗病毒治疗[4]。
相关研究显示:基于社区人群的普筛将会使更多的HBsAg阳性人群被发现。对HBsAg阳性人群积极开展肝癌筛查,以显著降低肝癌死亡风险。肝癌的早诊有利于患者生存率的提升。基于对HBsAg阳性患者开展的肝癌筛查,显著提高了早期肝癌的检出率[5]。
二 aMAP风险评分
通过国际合作,候教授团队构建了覆盖全球慢性肝病患者的肝炎合作网络,研究纳入了5大洲、29个国家、968家中心,共分析17374例受试者(肝癌人群455例,非肝癌人群14752例),以年龄(age)、男性(Male)、白蛋白/总胆红素(ALBI)、血小板(Platelet)作为最终纳入aMAP评分的模型指标。具体公式如下:
aMAP评分={[0.06×年龄+0.89×性别+0.48×(0.66×log10总胆红素-0.085×白蛋白)-0.01×血小板]+7.4}/14.77×100(年龄:年;总胆红素:μmol/L;白蛋白:g/L;血小板:103/mm3)。
aMAP评分将患者区分为HCC低风险(0-50分)、中风险(50-60分)和高风险(60-100分)组,三组患者五年肝癌发生率如下图(图1)所示。该研究发现aMAP风险评分可预测慢性肝病患者远期肝癌发生风险[6]。
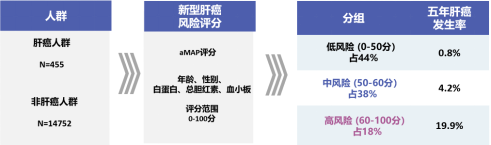
图1
aMAP及现有大部分评分仍存在一些局限性,首先,忽略了HCC发生风险在长期随访过程中会因病情的变化而不断变化的特点。其次,绝大部分模型的预测效能在肝硬化患者中明显下降。为了克服上述现有模型存在的缺陷,南方医科大学南方医院侯金林/樊蓉教授团队基于纵向判别分析建模算法,高效利用患者随访期间产生的大量多维纵向数据,分别构建并验证了2项新型、精准的肝癌风险预测模型(aMAP-2与aMAP-2 Plus评分)。
序贯应用(aMAP→aMAP-2→aMAP-2 Plus)即每一评分所识别的高风险患者推荐使用下一级别评分进行筛查,为慢性肝病患者提供了新的HCC高风险人群富集策略,利于指导HCC的个体化监测工作的开展。逐步完善的aMAP评分系统进一步提高了预测HCC发生风险的性能[7]。
三 肝癌无创筛查与诊断现状
中国及亚太推荐AFP、AFP-L3和DCP联用,加/不加影像学,用于肝癌的筛查和诊断。在我国,AFP仍然作为肝癌筛查和辅助诊断的指标(图2)。
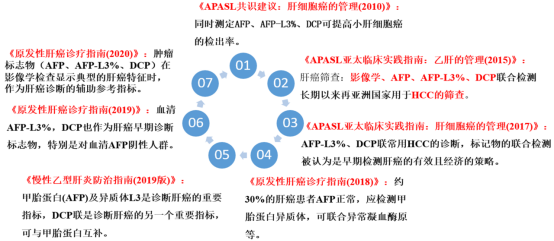
图2
血清甲胎蛋白(AFP)是当前诊断肝癌常用而又重要的方法,诊断标准:AFP≥400μg/L。我们验证了AFP对HBV相关肝癌有相对更好的诊断和预后预测价值[8]。但是,AFP检测早期肝细胞癌的性能受到抗病毒治疗和AST水平的影响,抗病毒治疗和血清AST可用于判断和选择血清AFP的特定临界值,用于不同高危人群的HCC监测。
关于AFP和AFP-L3%联合检测在肝癌中的应用价值。一般认为甲胎蛋白异质体(AFP-L3)主要来源于肝癌细胞,因此特异性更强。尽管有文献报道,肝癌患者AFP-L3水平不受AFP水平的影响。但我们的结果显示肝癌患者血清AFP-L3水平与AFP水平高度相关(R2=0.81,P<0.01),而AFP-L3%水平与AFP水平不相关。这一现象提示,AFP-L3%能够提高诊断的特异性。临床上常以甲胎蛋白异质体比率(AFP-L3/AFP%)作为HCC筛查指标,界值多采用>10%。
我们的研究比较了AFP和AFP联合AFP-L3%对不同肿瘤大小或不同病因肝癌的诊断价值。结果显示,对肿瘤直径>2cm(P<0.01)和乙肝相关肝癌的诊断价值有显著提升(P<0.01)。
异常凝血酶原(DCP)可作为肝癌筛查和辅助诊断的指标,DCP是无活性的凝血酶的前体,由肝脏合成,通过VitK作为辅助因子γ羧化后转为活化的凝血酶形式。当肝脏发生癌变时,合成了比正常结构少的γ羧基谷酸,即形成了异常的凝血酶原。
四 不同病因原发性肝细胞癌诊断模型GALAD
不同病因原发性肝细胞癌诊断模型GALAD横空出世,基于性别、年龄、AFP、AFP-L3、DCP建立的GALAD模型在以西方人为主的人群中原发性肝癌诊断上表现出良好的诊断价值。但其在我国以HBV感染为背景的HCC的诊断价值如何,需进一步验证。
GALAD评分:Z=-10.08+0.09×年龄+1.67×性别(男性为1,女性为0)+2.34 ×log (AFP) +0.04×AFP-L3+1.33×log (DCP)。
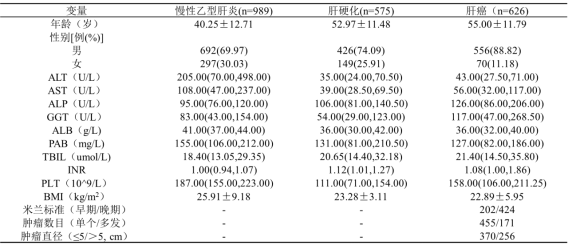
我们的工作:基于我国HBV相关肝癌背景下的GALAD评估与完善尝试(表1)。
表1 研究队列的基本信息(n=2190)
结果:1、GALAD原模型对HBV-HCC有很好的诊断价值(图3)
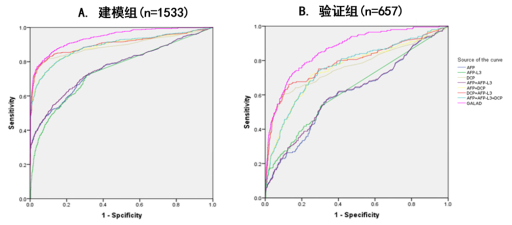
图3
结果:2、GADA模型对早期HBV-HCC优于GALAD原模型(图4)
表2 不同模型诊断性能对比
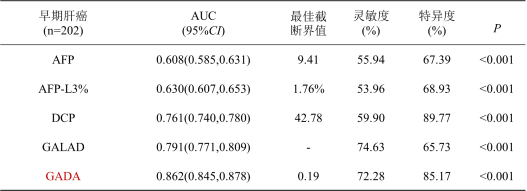
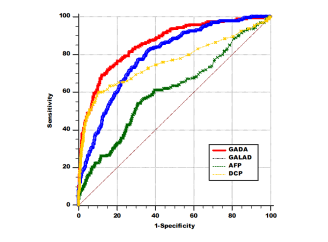
图4 不同模型诊断性能ROC曲线
五 多指标联合提高肝癌筛查效能的多中心研究
多指标联合提高肝癌筛查效能的多中心研究项目正式启动,基于中国慢性乙型肝炎人群大数据建立的肝癌风险评估系统,为临床医生提供肝癌早期诊断的有效手段,有助于推动临床对肝癌的早筛早诊。总计入组28273例,十家研究中心,两家外部验证与对比(图5)。
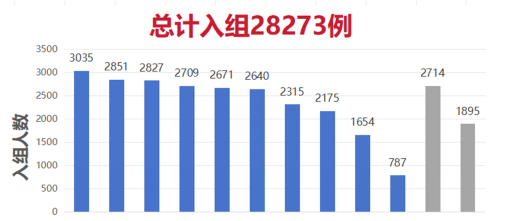
图5 入组人数
汇总多中心(10家)GADA模型的肝癌诊断性能优良(表3)
表3 血清学标志物单独及模型性能比较

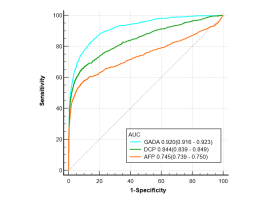
图6 血清学标志物单独、GADA模型诊断HCC的ROC曲线
GADA模型对HBV-HCC有较好的诊断价值:AUC=0.920(0.916-0.923)
总结:GADA模型对HBV-HCC诊断效能总体优秀(表4)。
表4 GADA模型对HBV-HCC诊断效能
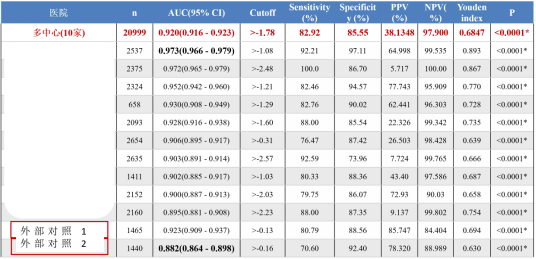
GADA模型 vs GALAD/C-GALAD(外部对照单中心1)(表5)
表5 血清学标志物单独及不同模型性能比较

GADA模型 vs GALAD/C-GALAD(外部对照单中心2)(表6)
表6 血清学标志物单独及不同模型性能比较
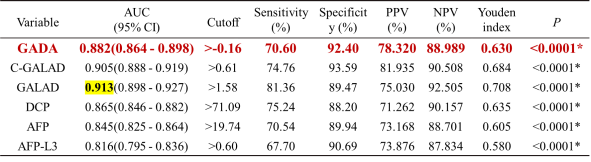
六 结论与呼吁
结论
1、在单指标辅助诊断肝癌方面,DCP的诊断效能更优。
2、对比GALAD模型,C-GALAD显示了更好的诊断性能, GADA模型对早期HBV-HCC也优于GALAD原模型。因此有必要对改进GALAD原模型,以辅助诊断我国的HBV-HCC。
3、以GADA为代表的简约辅助诊断模型,在10家多中心的前瞻性注册临床研究中的诊断效能AUC=0.920(0.916-0.923),且灵敏度和特异度符合预期。
4、需要进一步探索:
a. 简约辅助诊断模型,对于其他病因导致的肝癌是否具有同等的预测能力?
b. 整合了HBV-HCC发病风险分层管理的HBV HCC诊断流程:患者按风险分层以决定诊断性筛查的频次与强度,多参数模型诊断性筛查+影像学≈临床确诊。
呼吁
各有关企业联合起来,计算模型开源,在纳入性别、年龄的基础上,允许医生以临床需求、经济条件来选择不同的组合,加以影像学,临床诊断原发性肝细胞癌。开源前提下的机器学习,以不断优化多参数模型,提高HBV-HCC早诊率,使我国的>7500万的慢性HBV感染人群最大获益。
参考文献
[1] Interim guidance for country validation of viral hepatitis elimination. Geneva: World Health Organization; 2021 [J].
[2] Llovet J M, Kelley R K, Villanueva A, et al. Hepatocellular carcinoma [J]. Nat Rev Dis Primers, 2021, 7(1): 6.
[3] 周召, 阿卜杜热西提·阿卜来提, 顾智强, et al. 尽早启动抗病毒治疗降低慢性HBV感染者肝细胞癌发生风险 [J]. 临床肝胆病杂志, 2023, 39(1): 31-6.
[4] 中华医学会肝病学分会. 扩大慢性乙型肝炎抗病毒治疗的专家意见 [J]. 中华肝脏病杂志, 2022, 30(2): 131-6.
[5] Zeng H, Cao M, Xia C, et al. Performance and effectiveness of hepatocellular carcinoma screening in individuals with HBsAg seropositivity in China: a multicenter prospective study [J]. Nat Cancer, 2023, 4(9): 1382-94.
[6] Fan R, Papatheodoridis G, Sun J, et al. aMAP risk score predicts hepatocellular carcinoma development in patients with chronic hepatitis [J]. J Hepatol, 2020, 73(6): 1368-78.
[7] Fan R, Chen L, Zhao S, et al. Novel, high accuracy models for hepatocellular carcinoma prediction based on longitudinal data and cell-free DNA signatures [J]. J Hepatol, 2023, 79(4): 933-44.
[8] Yao M, Zhao J, Lu F. Alpha-fetoprotein still is a valuable diagnostic and prognosis predicting biomarker in hepatitis B virus infection-related hepatocellular carcinoma [J]. Oncotarget, 2016, 7(4): 3702-8.


