【协和医学杂志】859例胰腺占位性病变超声造影诊断的准确性分析
时间:2024-08-26 06:00:28 热度:37.1℃ 作者:网络
不同病理类型的胰腺占位性病变治疗方案差异极大,及时、准确的定性诊断至关重要。腹部超声是胰腺病变的首选筛查方法,但其对于良恶性病变的诊断困难[1],区分不同病变的血供差异可为鉴别诊断提供依据。超声造影检查操作简单、无肾毒性和辐射,可实时、动态观察组织器官的微血管灌注情况。目前临床广泛应用的纯血池超声造影剂仅能进入毛细血管网,而不会渗出至细胞外基质,可清晰准确显示胰腺病灶及周围正常胰腺实质的微血管灌注,有助于提高胰腺肿瘤的诊断准确性[2-3]。
北京协和医院自2013年起开展胰腺超声造影相关研究,至2017年逐步过渡为常规临床检查项目,本文在总结分析本中心859例胰腺占位性病变超声造影准确性的基础上,结合文献复习,探讨胰腺占位性病变超声造影检查在临床决策中的价值以及未来探索方向。
资料与方法
1.1 研究对象
本研究为回顾性诊断性试验。连续纳入2017年1月—2022年12月于北京协和医院超声医学科行胰腺占位超声造影检查的患者。纳入标准:(1)初步诊断为胰腺占位,且在本院接受超声造影检查;(2)经手术或穿刺病理诊断,且诊断明确;(3)穿刺诊断良性的病例,要求诊断后完成6个月以上随访且资料齐全,影像学及临床表现证实疾病无明显进展。排除标准:超声造影检查前行新辅助化疗、放疗等治疗的胰腺肿瘤患者。
收集患者性别、年龄等一般资料,常规超声及超声造影的影像学检查结果、手术或穿刺病理诊断信息、临床及影像随访资料等。
本研究已通过北京协和医院伦理审查委员会审批(审批号:I-23PJ387),并豁免患者知情同意。
1.2 研究方法
1.2.1 超声造影检查
应用Philips iU22/Epic7彩色多普勒超声仪,2~5 MHz凸阵探头。患者检查前禁食至少8 h。先行常规超声检查定位胰腺占位,然后启动低机械指数的实时谐波超声造影模式,于同一扫查切面同时显示病灶与正常胰腺实质。超声造影剂使用声诺维(SonoVue)溶解于5 mL生理盐水,振荡后形成微泡悬浊液,经肘静脉推注1.2~2.4 mL,随后注入5 mL生理盐水。
注射造影剂后,以周围正常胰腺组织为参照,连续、动态观察胰腺病灶的增强方式及增强强度120 s以上。依据欧洲超声医学和生物学联合会(EFSUMB)超声造影指南[4],胰腺超声造影分动脉期(10~30 s)及静脉期(31~120 s),结合病灶常规超声及超声造影的微血管灌注模式,判断病灶性质并报告。出具报告者均有3年以上胰腺超声造影诊断经验。
1.2.2 病理诊断
手术切除标本常规记录病理结果。穿刺病理诊断为恶性的病例直接记录病理诊断类型,诊断良性的病例则进行随访(一般6个月以上),若临床及影像学评估均证实疾病无进展,记录穿刺病理诊断类型。
1.2.3 超声造影诊断报告准确性判断标准
将胰腺占位超声造影诊断报告分为一级描述性诊断、二级良恶性诊断、三级具体病理类型诊断3个层次(若患者有多个病灶,以恶性程度最高的病灶为准)。以病理诊断为金标准,分析超声造影报告的诊断准确性。
1 良恶性诊断准确性
根据病理结果,将胰腺病变分为良性及恶性,分析超声造影检查在病灶良恶性判断方面的诊断准确性。
超声造影诊断为一级描述性诊断的病例,按“良恶性判断错误”纳入分析;超声造影诊断为三级具体病理类型诊断的病例,将三级诊断结果分为良、恶性纳入研究,例如,三级诊断为胰腺转移性癌,则将病例标记为超声造影诊断恶性。由于胰腺神经内分泌肿瘤(pNENs)难以应用良恶性进行分类,本研究不将其纳入良恶性诊断准确性分析。
2 不同病理类型误诊分析
具体分析各种病理类型胰腺占位性病变的超声造影诊断误诊情况。如超声造影报告仅为一级描述性诊断,即未定性良恶性,则定义为错误诊断;如报告为二级良恶性诊断,当超声诊断与病理相符即定义为正确诊断;如报告为三级具体病理类型诊断,当超声诊断与最终病理不相符时,即使二级诊断正确,仍定义为错误诊断,例如,将胰腺转移性肾透明细胞癌诊断为胰腺导管腺癌(PDAC),则定义为错误诊断。
1.3 统计学处理
应用SPSS 21.0软件录入数据并进行统计学分析。计数资料采用频数(百分数)表示;符合正态分布的计量资料以均数±标准差表示,符合偏态分布的计量资料以中位数(四分位数)表示。以病理诊断为金标准,计算胰腺占位超声造影对良恶性病变的诊断灵敏度、特异度、ROC曲线下面积(AUC)、预测值、似然比、超声造影良恶性诊断符合率,以及不同病理类型的误诊率。
2 结果
2.1 一般临床资料
本研究共入选符合纳入和排除标准的患者859例,其中男性489例(56.9%),女性370例(43.1%);年龄16~85岁,中位年龄60(53,66)岁。所有患者超声造影过程中均未发生不良反应事件。
2.2 胰腺占位超声造影良恶性诊断准确性分析
排除47例pNENs,最终812例胰腺占位患者纳入分析,对于良恶性判断的病理诊断及超声造影诊断报告结果见表1。
表1 812例胰腺占位患者的超声造影良恶性诊断报告结果
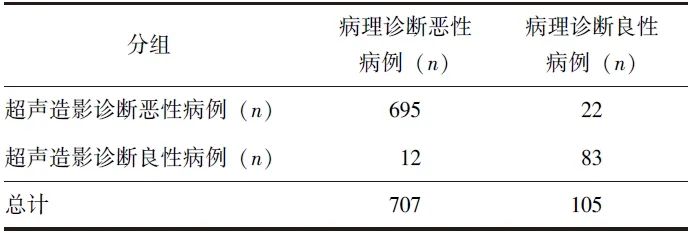
超声造影对胰腺恶性病变的诊断灵敏度为98.3%(95% CI:97.1%~99.1%),特异度为79.0%(95% CI:70.1%~86.4%),AUC为0.887(95% CI:0.863~0.908);阳性预测值为96.9%(95% CI:95.6%~97.9%),阴性预测值为87.4%(95% CI:79.6%~92.4%);阳性似然比为4.69(95% CI:3.24~6.80),阴性似然比为0.02(95% CI:0.01~0.04)。超声造影诊断胰腺病变良恶性的报告诊断符合率为95.8%。
2.3 不同病理类型胰腺占位超声造影误诊情况分析
以病理诊断为金标准,859例胰腺占位病例中,超声造影误诊48例,总误诊率为5.6%,其中包含未定性诊断病例7例(0.8%),不同病理类型胰腺占位的超声造影误诊情况见表2、3。
表2 859例胰腺占位患者超声造影检查误诊情况
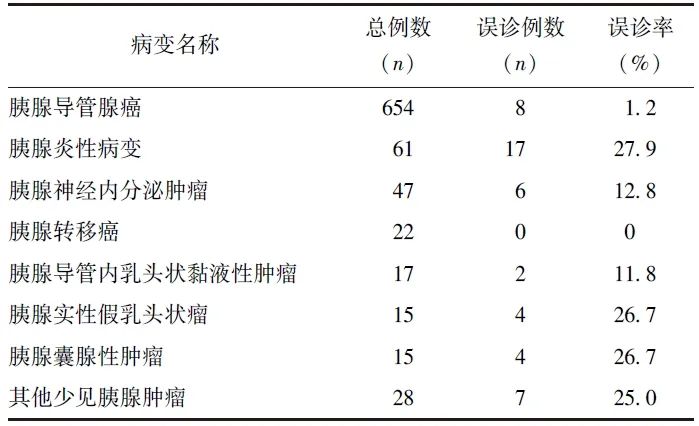
表3 48例胰腺占位患者超声造影误诊情况分布

其中,胰腺炎性病变超声造影的误诊率最高(27.9%,17/61),17例误诊病例中,16例[包括自身免疫性胰腺炎(AIP)、慢性胰腺炎、胰腺脓肿、胰腺结核、沟槽性胰腺炎]判定为恶性,1例未定性诊断。误诊为恶性的胰腺炎性病变二维超声均形态不规则、边界不清,动脉期呈不均匀等增强或低增强,静脉期明显廓清。
回顾未明确诊断的沟槽性胰腺炎超声造影图像,病灶动脉期呈等增强,静脉期明显廓清,无法排除恶性诊断。同时本研究中有2例假阳性的转移癌诊断,患者均年轻,既往分别诊断为肾癌和乳腺癌,最终胰腺占位的病理诊断分别为腺鳞癌和PDAC,其中1例患者基因检测存在BRCA突变。
3 讨论
本研究以病理诊断为金标准,发现超声造影对胰腺恶性病变的诊断灵敏度为98.3%,特异度为79.0%,AUC为0.887,其中PDAC的诊断准确率高达98.8%,但胰腺炎性病变的诊断准确率较低(72.1%)。
超声造影剂安全性高,患者耐受良好,可应用于肝肾功能衰竭的患者。意大利一项对23 188例超声造影剂SonoVue应用的回顾性研究发现,轻度不良反应患者29例,类过敏反应患者2例,无永久性损害发生[5]。超声造影成像具有实时、连续的特点,可弥补增强CT的不足,在胰腺实性占位的诊断准确率方面与增强CT无明显差异[6]。
PDAC是最常见的胰腺原发恶性肿瘤,预后差,5年生存率约为10%~12%[7],位列我国癌症相关死因第6位[8]。病变二维超声表现为形态不规则,边界不清的低回声,彩色多普勒超声显示肿瘤内血流少。EFSUMB等指南中典型PDAC的超声造影表现为全程低增强[4],但本中心发现,约30%~40%的PDAC动脉期早期强化明显,呈等增强的富血供状态,易造成假阴性诊断,因此在原有指南基础上,笔者提出廓清模式和静脉期低增强对PDAC的诊断价值,以病灶动脉期等/低增强+快速廓清作为诊断标准,显著提高了诊断的灵敏度[9]。本研究所有病例均采用该诊断标准,结果显示PDAC的诊断准确率达98.8%。
PDAC和肿块型胰腺炎的鉴别充满挑战,二者临床及影像均存在重叠关联。研究表明,手术切除的AIP中40%合并PDAC[10],20%的胰腺癌组织中存在类似AIP的组织学特征[11]。有观点认为PDAC是AIP的并发症,另有观点认为AIP是PDAC副肿瘤综合征的一种表现,但均提示胰腺炎背景下的PDAC不容忽视。炎性病变必须是排除肿瘤后的诊断,同时炎性病变并非诊断的终点,而是定期随访的开始。
本研究中有0.5%(3/654)的PDAC误诊为炎性病变,2例病灶范围较大、结构紊乱,超声造影呈不均质增强,穿刺病理证实为胰腺癌;另1例术前超声显示病灶范围为5.8 cm×3.6 cm×3.0 cm,而术后病理诊断PDAC病灶大小约2.0 cm×1.5 cm×1.5 cm,合并周围胰腺炎性改变。可见误诊为炎性病变的3例病灶可能均是炎症合并局灶性癌变。
典型的肿块型胰腺炎超声造影呈同步增强及减退,但随着病程进展,其内可出现类似PDAC的纤维化改变,超声造影呈不均匀低增强模式。本研究中26.2%(16/61)的胰腺炎性改变误诊为恶性,其中1例AIP患者术后病理提示间质广泛纤维化。1例慢性胰腺炎患者,术前多种影像均高度怀疑恶性,针对胰腺病灶2次穿刺活检均未见瘤细胞;术中粘连严重,病灶难以切除,行术中穿刺活检,病理提示胰腺组织呈重度慢性炎,可见较多淋巴细胞、浆细胞浸润及纤维组织增生。
由此可见,PDAC和部分胰腺炎性病变在临床和影像上的鉴别均非常困难。当超声造影出现不均匀增强及廓清时,局部快速廓清区应考虑到恶性风险,需穿刺活检明确诊断。由于病灶内部的异质性,穿刺前超声造影检查将有利于定位可疑病变区域,提高穿刺诊断效能[12]。随着方法学的进步,有研究表明应用列线图有助于PDAC和肿块型胰腺炎的鉴别[13],但尚需要更广泛的临床研究加以证实。
胰腺转移癌的超声造影表现与原发肿瘤相似,多呈快进快出的增强模式,静脉期快速廓清呈低增强。肾透明细胞癌超声造影表现相对特殊,表现为动脉期高增强,静脉期持续增强缓慢廓清,结合既往病史诊断并不困难。但本研究中有2例假阳性的转移癌诊断,患者均年轻,其中1例患者基因检测存在BRCA突变。提示当患者年轻、存在肿瘤相关基因突变时,需考虑多种原发恶性肿瘤的可能。
2017年WHO病理分级标准根据组织分化程度、核分裂数及Ki-67增殖指数,将pNENs分为神经内分泌瘤(NET)(G1/G2/G3)、神经内分泌癌和混合性神经内分泌-非神经内分泌肿瘤,不同的pNENs治疗方案存在差异。本研究中6例NET G2因合并肝内多发转移或腹腔内血管包绕,超声造影诊断为恶性病变,而未提示pNENs的诊断。
回顾图像,病灶超声造影均表现为动脉期较高增强,静脉期快速廓清,与富血供胰腺癌相似,但其中4例常规超声下形态规则、边界清晰。实现pNENs与PDAC鉴别达到明确的三级诊断并预测病理分级,将为临床提供更多诊断信息。根据2012年欧洲神经内分泌肿瘤学会共识指南,pNENs的超声造影增强模式与Ki-67指数存在相关性[14],可作为分级替代方案。
此外,针对PDAC的研究已经证实[15-16],超声造影的增强模式对化疗预后、肝转移风险等均有相关性,故NET的超声造影分型能否对药物疗效、转移风险评估等提供更多预测价值,值得深入探究。
胰腺囊腺肿瘤中有较多实性成分时,提示存在恶性风险。回顾本研究中4例误诊为囊腺癌的浆液性囊腺肿瘤的超声图像发现,常规超声内部均见类似实性的成分,但实性部分超声造影静脉期逐步廓清,2例静脉后期出现细小分隔样结构,提示局部呈微囊型改变。
当胰腺导管内乳头状黏液性肿瘤(IPMN)合并主胰管显著增宽,且病灶内无回声的黏液与胰管相通时,诊断IPMN并不困难。但不能局限于诊断提示IPMN,及时、准确发现恶变征象对于后续治疗策略的选择至关重要,超声造影在IPMN诊断的主要优势在于区分有血流灌注的囊壁结节和无血流灌注的黏蛋白栓。
本研究中2例误诊的IPMN病变,均提示了IPMN,1例未提示恶变,1例合并异型增生诊断为恶变,回顾图像发现2例超声表现相似,均有囊内分隔的不均匀增厚及明显增强的乳头样结构。从IPMN到异型增生,再到恶变,病理上是连续性变化的过程,影像上也有部分重叠。
总体而言,大量临床及影像判断为无恶性风险的胰腺囊性病变,会选择定期随访观察,因此本研究中经手术或穿刺的胰腺囊性占位,大部分为临床评估存在一定恶性风险或良恶性判断困难的患者。本研究数据可能无法客观反映超声造影对胰腺囊性占位的诊断准确性,对于临床诊断困难的胰腺囊性占位,超声造影能否提供更多有效的诊断信息,仍需更多的经验积累和研究总结。
超声造影检查具有操作者依赖性,同时与患者情况密切相关。患者腹壁厚、肠气重、呼吸配合不佳、病灶位置深、病灶体积小等,均是超声下病灶显示不清的重要影响因素。本研究未能明确诊断的7例病变中,6例病灶显示不清晰,1例常规超声下病灶定位错误。可见常规超声显示不佳的胰腺病灶,在分辨率更低的超声造影条件下显示更加困难,难以提供额外的诊断信息。因此强调常规超声下胰腺病灶的清晰显示是超声造影检查的前提,对于诊断困难病例应结合增强MRI、增强CT、PET/CT等影像学检查结果,实现病变区域的精准定位。本研究旨在探讨超声造影对胰腺占位性病变的诊断价值,未能明确诊断的病例提示超声造影的诊断价值有限,因此本研究将未能明确诊断的病例定义为误诊病例,避免数据剔除造成诊断价值高的假象。
本研究的优势在于样本量大,纳入的胰腺病变类型较全面,可为临床提供超声造影的诊断现状。局限性体现在以下方面:(1)由于疾病发病率的差异及纳入标准严格要求病理诊断,导致不同类型病变数量差异大,尤其是良性病变不足;(2)本研究为单中心研究,行胰腺超声造影检查的患者,多来源于临床怀疑恶性风险拟行穿刺活检或多学科会诊中心诊断困难的病例,因此存在一定的选择偏移。
综上,超声造影检查安全、有效,是评估各种胰腺病变微血管灌注的准确成像方法,对胰腺病变良恶性诊断,特别是PDAC的定性诊断具有良好的临床应用价值。但在纤维化严重的胰腺炎性病变和与PDAC的鉴别、复杂胰腺囊性病变的良恶性判断、胰腺炎性病变及囊性病变局部恶变的早期发现、NET的精确诊断和疗效预测等方面,超声造影的价值尚待进一步探索。
参考文献
[1]Martínez-Noguera A, D'Onofrio M. Ultrasonography of the pancreas. 1. Conventional imaging[J]. Abdom Imaging, 2007, 32(2): 136-149.
[2]Yamashita Y, Shimokawa T, Ashida R, et al. Value of low-mechanical-index contrast-enhanced transabdominal ultrasound for diagnosis of pancreatic cancer: a meta-analysis[J]. Ultrasound Med Biol, 2021, 47(12): 3315-3322.
[3]Gupta P, Rana P, Marodia Y, et al. Contrast-enhanced ultrasound of solid pancreatic head lesions: a prospective study[J]. Eur Radiol, 2022, 32(10): 6668-6677.
[4]Sidhu P S, Cantisani V, Dietrich C F, et al. The EFSUMB guidelines and recommendations for the clinical practice of contrast-enhanced ultrasound(CEUS) in non-hepatic applications: update 2017(long version)[J]. Ultraschall Med, 2018, 39(2): e2-e44.
[5]Italian Society for Ultrasound in Medicine and Biology(SIUMB) Study Group on Ultrasound Contrast Agents. The safety of Sonovue® in abdominal applications: retrospective analysis of 23188 investigations[J]. Ultrasound Med Biol, 2006, 32(9): 1369-1375.
[6]Wang Y J, Li G H, Yan K, et al. Clinical value of contrast-enhanced ultrasound enhancement patterns for differentiating solid pancreatic lesions[J]. Eur Radiol, 2022, 32(3): 2060-2069.
[7]Park W, Chawla A, O'Reilly E M. Pancreatic cancer: a review[J]. JAMA, 2021, 326(9): 851-862.
[8]Zheng R S, Sun K X, Zhang S W, et al. Report of cancer epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(1): 19-28.
[9]Jia W Y, Gui Y, Chen X Q, et al. Evaluation of the diagnostic performance of the EFSUMB CEUS Pancreatic Applications guidelines(2017 version): a retrospective single-center analysis of 455 solid pancreatic masses[J]. Eur Radiol, 2022, 32(12): 8485-8496.
[10]Macinga P, Pulkertova A, Bajer L, et al. Simultaneous occurrence of autoimmune pancreatitis and pancreatic cancer in patients resected for focal pancreatic mass[J]. World J Gastroenterol, 2017, 23(12): 2185-2193.
[11]Chen L N, Orr C E, Wang T. Prevalence of histological features resembling autoimmune pancreatitis in neoplastic pancreas reps[J]. Histopathology, 2020, 77(4): 673-677.
[12]Gui Y, Dai M H, Meng Z L, et al. Value of contrast-enhanced ultrasound combined with percutaneous ultrasound-guided fine-needle aspiration in the diagnosis of solid pancreatic lesions[J]. Chin Med J(Engl), 2021, 135(4): 426-432.
[13]Huang J Y, Yang J, Ding J M, et al. Development and validation of an ultrasound-based prediction model for differentiating between malignant and benign solid pancreatic lesions[J]. Eur Radiol, 2022, 32(12): 8296-8305.
[14]Falconi M, Bartsch D K, Eriksson B, et al. ENETS consensus guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: well-differentiated pancreatic non-functioning tumors[J]. Neuroendocrinology, 2012, 95(2): 120-134.
[15]Zhou T T, Tan L, Gui Y, et al. Correlation between enhancement patterns on transabdominal ultrasound and survival for pancreatic ductal adenocarcinoma[J]. Cancer Manag Res, 2021, 13: 6823-6832.
[16]Jia W Y, Gui Y, Chen X Q, et al. Pancreatic ductal adenocarcinoma with synchronous and metachronous hepatic metastasis predicted by contrast-enhanced ultrasound[J]. Quant Imaging Med Surg, 2023, 13(6): 3902-3914.


