华中科技大学吴钰周/董念国/史嘉玮团队《自然·通讯》:免疫微环境调控加速再生的新型交互式心脏瓣膜
时间:2024-09-01 06:00:35 热度:37.1℃ 作者:网络
心脏瓣膜病是全球心血管疾病发病和死亡的主要原因,且目前没有药物可以阻止瓣膜恶化,因此瓣膜置换手术依旧是最有效的治疗方案。目前临床中使用的心脏瓣膜假体主要可以分为机械瓣膜和生物瓣膜两种。其中,机械瓣膜虽然使用年限较长但是患者需要进行终身的抗凝血治疗,而生物瓣膜由于不可再生和钙化导致其使用寿命仅为10-15 年。面对这些挑战,具有再生能力的组织工程心脏瓣膜的开发具有重大意义,但该种新型瓣膜假体的构建通常涉及到复杂的多种功能性药物分子的负载等复杂设计,这也极大的限制了其临床转化的潜力。
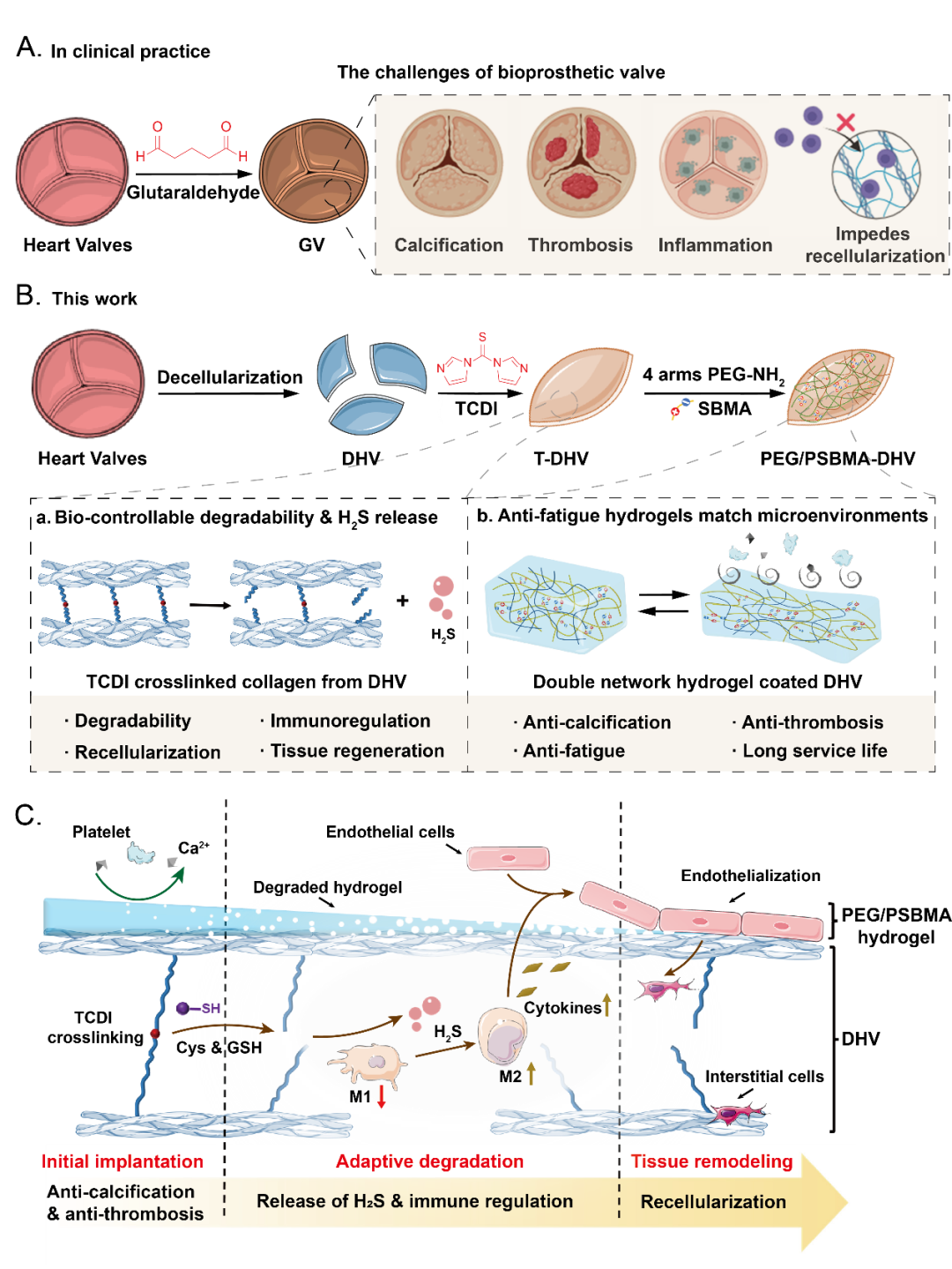
Figure. 1 PEG/PSBMA-DHV的制备及机制示意图
传统的基于共价键的交联策略,在提高瓣膜的力学强度的同时也会导致致密的孔隙结构的形成,同时由于其不可降解性导致在一定程度上妨碍了细胞的浸润,不利于再细胞化和组织再生。此外,传统的组织交联剂通常为生物惰性,难以指导细胞行为促进再生。理想的组织交联剂应该在材料植入体内后能够展现出缓慢降解的能力,满足细胞浸润的需求。同时,应该具备生物活性进一步加速再生进程。那么,如何通过高效且简单的策略实现对组织交联,同时满足上述需求,是目前亟需解决的问题。
在本文中,吴钰周教授及其团队提出了一种创新且高效的策略,利用1,1'-硫羰基二咪唑(TCDI)的化学特性,开发了一种新型交互式心脏瓣膜再生材料。这种材料基于TCDI交联能够形成可水解的硫脲和硫代碳酸酯键,实现了在材料降解过程中能够逐步释放硫化(H2S),有效调节免疫微环境,促进组织修复和再生。
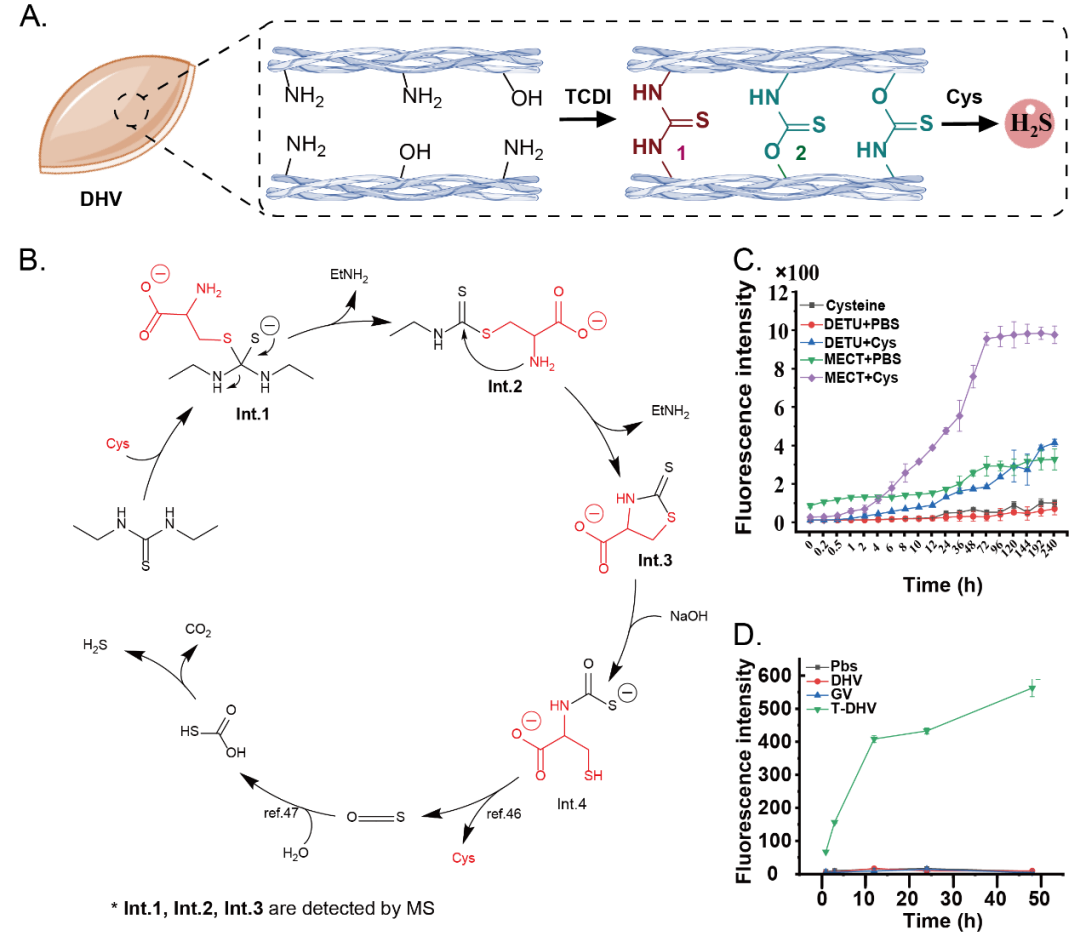
Figure. 2 TCDI交联心脏瓣膜的H2S释放机制探究
由于心肌的节律性收缩与松弛,心脏瓣膜会持续受到周期性的机械刺激。这就要求瓣膜材料不仅要在静态条件下表现优异的抗钙化和抗蛋白黏附的性能,即使在剧烈的循环力学刺激之后,依旧维持良好的性能。因此,研究团队以TCDI交联技术为基础,在脱细胞心脏瓣膜(DHVs)表面构建了一种PEG/PSBMA双网络水凝胶。该种策略不仅有效提高了心脏瓣膜的力学强度和稳定性,同时展现出良好的抗疲劳性能,经历500次循环拉伸测试后依旧展现出优异的抗钙化和抗蛋白黏附性能。

Figure. 3 PEG/PSBMA的抗钙化和抗蛋白黏附性能评估
最终,当将该材料植入体内,血液循环中的半胱氨酸等小分子激活材料的H2S释放和降解,并驱动巨噬细胞向M2表型计划,促进细胞迁移和组织再生。为了更好模拟心脏瓣膜的体内环境,我们采用腹主动脉移植模型评价该材料的免疫调控和再生能力。从实验结果能够看到,植入体内28天后,PEG/PSBMA-DHV有效抑制了瓣膜钙化、 实现了完整内皮细胞层的重塑并明显促进了一型胶原的重塑。
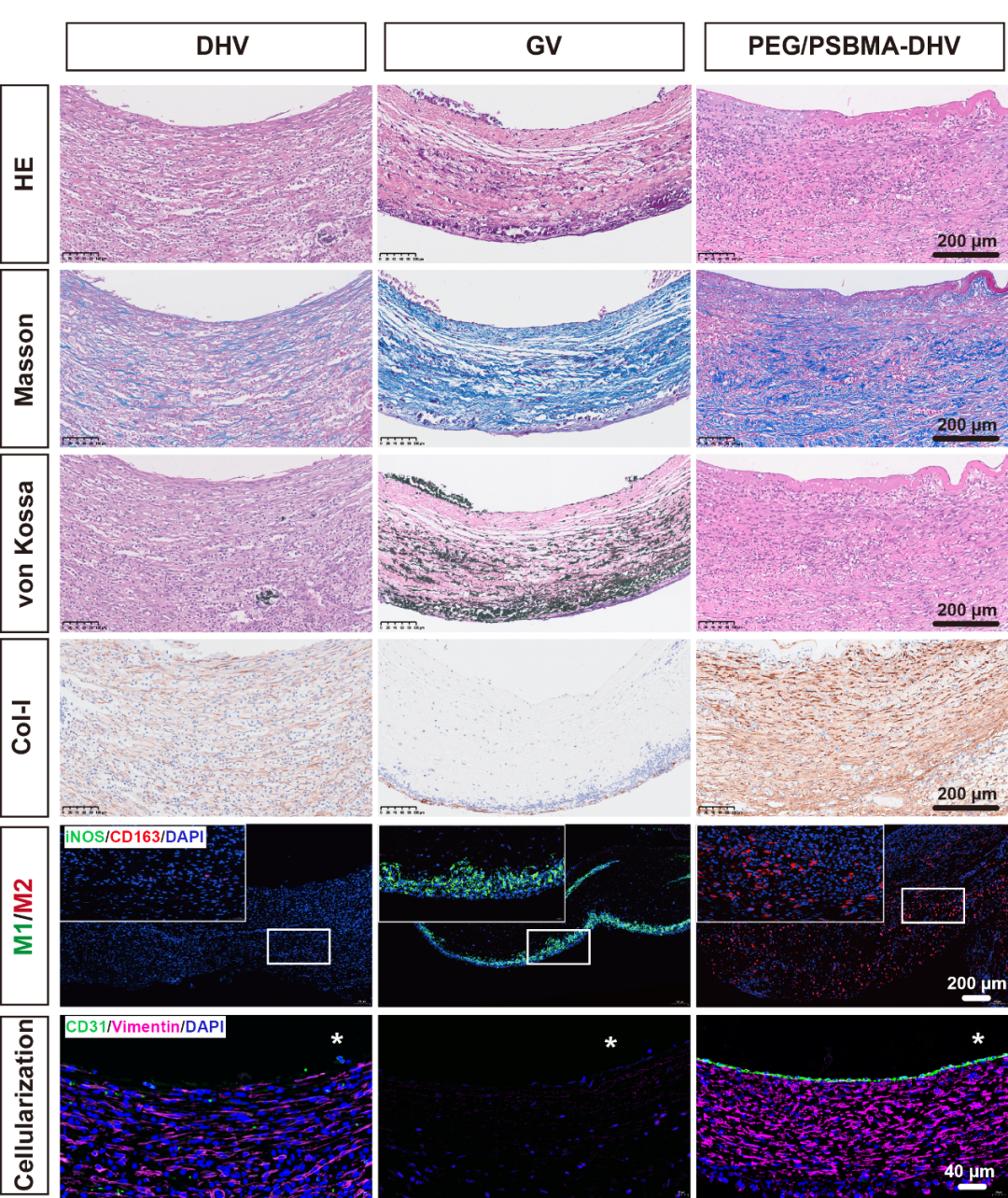
Figure. 4 腹主动脉移植四周后的整体性能评价
总言而之,该研究利用TCDI作为交联剂,解决了非共价交联剂在稳定性和力学强度方面的不足,同时也克服了不可降解的共价交联剂可能导致的细胞浸润和组织再生受阻的问题。其所具备的H2S释放能力也赋予PEG/PSBMA-DHV调节免疫反应的能力,有效地诱导巨噬细胞向具有抗炎和促进组织再生的表型转变。通过这种创新的方法,PEG/PSBMA-DHV在心脏瓣膜的内皮化、细胞化和组织重塑方面展现出了卓越的潜力,为心脏瓣膜的修复和再生提供了一种有效的解决方案。
上述研究成果近期于Nature Communications期刊在线发表,“Facile engineering of interactive double network hydrogels for heart valve regeneration” (DOI: 10.1038/s41467-024-51773-0)。华中科技大学化学与化工学院吴钰周教授和华中科技大学同济医学院附属协和医院董念国教授、史嘉玮教授为本文通讯作者,2022级博士研究生李金生和附属协和医院乔韡华为论文第一作者,华中科技大学为唯一通讯单位。
课题组网站:
http://faculty.hust.edu.cn/wuyuzhou/zh_CN/index.htm
原文链接:
https://www.nature.com/articles/s41467-024-51773-0


