【醉仁心胸】可变与常规容量控制通气对胸外科手术患者气体交换和呼吸力学影响的比较:一项随机对照临床试验
时间:2024-09-13 06:02:36 热度:37.1℃ 作者:网络

摘要
背景: 可变容潮气量控制通气(V-VCV)具有改善全麻期间肺功能的潜力。该研究假设与常规容量控制通气(C-VCV)相比,可变容潮气量控制通气(V-VCV)可改善胸外科手术患者单肺通气(OLV)期间动脉氧合和呼吸力学。
方法:患者随机分为V-VCV组(n = 39)和C-VCV组(n = 39)。在单肺通气期间,按预测体重(PBW)设定潮气量为5 mL/kg。两组患者通气时呼气末正压(PEEP)为5 cm H2O,吸呼比(I:E)分别为为1:1 (单肺通气时)和1:2(双肺通气时),呼吸频率(RR)根据动脉血气pH滴定,吸气峰压≤40 cm H2O,吸氧浓度为100%。
结果:78名患者中有75名完成了试验并进行了分析(退出者除外)。单肺通气开始后20min动脉氧分压(PaO2)各组间无差异(V-VCV: 25.8±14.6 kPa vs C-VCV: 27.2±15.3 kPa;平均差异[95% CI]: 1.3[−8.2,5.5],P = 0.700)。此外,术中气体交换、术中不良事件、由于缺氧和高碳酸血症而需要抢救操作、术后肺和肺外并发症的发生率以及术后第30天的住院天数在两组之间没有差异。
结论:单肺通气的胸外科患者中,与C-VCV相比,V-VCV并没有改善氧合或呼吸力学。
伦理委员会:EK 420092019。
试验注册:在德国临床试验注册:DRKS00022202(16.06.2020)。
关键词
单肺通气,可变通气,可变潮气量,胸外科手术。
1.引言
在胸外科手术中,通常需要对术侧肺萎陷以创造手术条件,并予健侧肺行单肺通气以维持气体交换。通气侧肺也可发生肺不张,导致通气血流比失调和气体交换障碍。事实上,在单肺通气期间可能发生严重的低氧血症,通常需要抢救治疗,甚至需要恢复双肺通气(TLV)[1]。重要的是,与双肺通气相比,单肺通气期间呼吸机诱导肺损伤(VILI)的风险更高[2],即使使用保护性小潮气量通气策略(VT),也可能会导致术后肺部并发症(PPC)的发生。
容量控制通气(Volume-controlled ventilation, VCV)是单肺通气中最常用的机械通气方式[2]。VCV以及稳定状态下的压力控制通气(PCV)产生恒定的潮气量(VT)和呼吸频率(RR),从而产生固定的呼吸模式。相比之下,健康受试者的自主呼吸模式则表现出明显的VT和RR变异性。为了克服这一局限性,可变潮气量通气 (V-VCV)这一概念被引入临床实践[3]。在V-VCV期间,VT随呼吸而变化。研究表明,V-VCV可以改善啮齿动物和猪肺损伤模型的气体交换、呼吸力学甚至有肺保护作用[4]。在接受腹部大手术的患者中,V-VCV可改善术中肺功能[5]。然而,这个结论在最近接受腹部手术的患者中并没有得到证实[6],可能是由于这类患者存在轻度肺不张。理论上,V-VCV可能改善呼吸力学和气体交换,因为它能够促进肺复张[7],特别是单肺通气等可能会引起显著肺不张的情况。事实上,V-VCV可改善猪单肺通气期间的肺功能[8],但尚未在临床实践中进行测试。
该研究的目的是探讨在单肺通气术中采用可变潮气量通气(V-VCV)和常规容量控制通气(C-VCV)模式对术中肺功能的影响。研究假设V-VCV可以改善在接受胸外科手术的患者术中单肺通气期间的动脉氧合。此外,假设V-VCV会改善呼吸力学。
2 方法
2.1 伦理
这是一项单中心、双臂、随机对照试验。研究方案由机构审查委员会批准
德国德累斯顿工业大学医学院,德累斯顿,德国(EK 420092019),并在德国临床试验注册(DRKS-ID: DRKS00022202, 16.06.2020,回顾性)。试验按照赫尔辛基宣言和良好临床实践原则进行。
2.2 纳入及排除标准
纳入标准:
1)选择性胸外科手术,单肺通气时间≥30min,
2)常规有创动脉压监测,
3)ASA分级≤3,
4)体重> 40 kg,
5)获得患者书面知情同意。
排除标准:
a)年龄< 18岁,
b)慢性阻塞性肺疾病(COPD)的GOLD评分≥3,
c)未经控制的哮喘,
d)计划采用双腔管(DLT)以外的其他方法进行肺隔离,
e)出现全凭静脉麻醉(TIVA)的禁忌症,
f)在手术前30天内参加另一项介入性临床试验。
g)使用药物或存在任何可能影响临床试验评估的性质、范围和可能后果的况;
h)怀孕、哺乳或育龄妇女,绝经后(定义为自然闭经12个月或闭经6个月且血5清促卵泡激素(FSH) > 40 U/mL),或行双侧卵巢切除术伴或不伴子宫切除术,或使用任何常规避孕方法且每年失败率< 1%,或伴侣行输精管切除术。
2.3随机化和控制偏倚
患者被随机分配到V-VCV或C-VCV单肺通气组。采用固定的1:1比例随机分组,分组患者分别为6 × 10、1 × 8、1 × 6和1 × 4。患者和术后评估人员均设盲。由于试验的特点,术中评估人员不能对通气方式实施盲法。然而,术中管理是由一名不参与该研究的医生提供,减少了偏倚的风险。
2.4干预措施
术前评估时需获得所有参与患者的书面知情同意。术前用药、围术期液体管理、术中监测(包括有创动脉压)、血液制品、抗生素的使用、神经肌肉阻断剂的拮抗和疼痛治疗方案均按当地标准进行。全麻诱导使用舒芬太尼(0.5 μg/kg)、异丙酚(1 ~ 2.5 mg/kg)、罗库溴铵(0.6 ~ 1.0 mg/kg)。在纤支镜引导下,使用可视喉镜插入左侧DLT。用异丙酚(5 ~ 6 mg/kg/h)和瑞芬太尼(0.2 ~ 0.8 μg/kg/min)维持TIVA。通过持续输注晶体(E153, Serumwerk Bernburg AG, Bernburg, Germany),以实现术中血流动力学稳定,平均动脉压(MAP)>65 mmHg的目标,必要时可输注去甲肾上腺素。
机械通气采用VCV模式(Evita XL, Drager,德国),禁止使用七氟烷等挥发性麻醉剂。因此,本研究中所有患者均接受了TIVA。插管后,肺通气策略按照预测体重(PBW)设定VT为7 mL/kg, 单肺通气时吸呼比(I:E)为1:1,双肺通气时吸呼比(I:E)为1:2,呼吸频率依据有无高碳酸血症而滴定,吸入氧浓度(FIO2)为100%。术中维持PEEP在5 cm H2O。患者取侧卧位,按分组开始进行单肺通气。
V-VCV模式通过计算机远程控制呼吸机完成,详见其他文献[9]。简单地说,在容量控制的连续正压通气模式下,通过定制软件,在每次呼吸周期的基础上改变VT。潮气量值采用高斯分布,平均值为5 mL/kg PBW,变异系数为30%。低于1 mL/kg和高于10 mL/kg的偏差值分别被这些值所取代。流量为35 L min - 1,呼吸机在每个呼吸周期自动调节主动吸气时间,以达到目标潮气量VT[6]。在C-VCV期间,固定使用VT为5 mL/kg PBW。在两组中,当吸气峰压限制在40 cm H2O时,与双肺通气相比,单肺通气期间的RR增加了约30%,单肺通气启动20 min后,滴定FIO2,使外周血氧饱和度(SpO2)≥94%。两组气体交换障碍的抢救措施相同,在线补充中进行了描述。
2.5测量方法
在仰卧位双肺通气下、单肺通气开始后20分钟、60分钟及手术结束时分别测量呼吸参数、气体交换和血流动力学参数。采用ABL90 Flex (Radiometer, Copenhagen, Denmark)测量动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)和动脉血pH值(pHa)。以125 Hz的采样频率从呼吸机连续获取呼吸指标(Evita XL4Lab, Dr¨ager Medical)。从5分钟气道流速和压力记录(Paw)中提取呼吸变量,并使用运动方程计算呼吸系统的平均弹性和阻力(静态和动态)[6]。机械功率的计算方法如前所述[10]。PPC定义为以下情况:中度和重度呼吸衰竭;急性呼吸窘迫综合征;支气管痉挛;新发肺部浸润;肺部感染;吸入性肺炎;胸腔积液;肺不张;心肺水肿;以及术后五天内发生气胸。PPC和肺外并发症(EPC)的定义见在线补充。
2.6主要和次要观察指标
主要观察指标为单肺通气启动后20分钟的PaO2。
次要指标为:术中PaO2、PaCO2、pHa、呼吸系统顺应性和气道阻力、机械动力、术中低氧血症(SpO2 < 90%且持续>1 min)、低血压(收缩压突然下降>20%,儿茶酚胺剂量增加)、心动过缓、低氧或高碳酸血症抢救、PPC和EPC;住院天数和手术后30天额外住院天数。
2.7样本量计算
样本量的计算基于先前的一项研究,该研究调查了VCV联合肺复张策略对单肺通气期间氧合的影响[11]。主要结局(PaO2)的Cohen效应预估值为0.68。使用双侧t检验,检验水准为5%,检验效能80%,得到每组35例的样本量。考虑到10%的脱落率,最终每组患者总数为39例(R统计编程语言[12])。
2.8数据分析
数据分析方案在开始之前经由作者同意。分类资料研究终点总结为绝对频率和百分比,连续性变量使用均值和标准差(表1、2、3)或连续变量的中位数和四分位数间距(表S1、S2、S3)。采用卡方检验(表1、2、3)或Fisher精确检验(表S1、S2、S3)评估组间比率和比例的差异。各研究组间的均值或中位数比较采用两样本t检验(表1、2、3)或Mann-Whitney U检验(表S1、S2、S3)。此外,我们提供了组间均值(表1、2、3)和中位数(表S1、S2、S3)差值的95%置信区间,其中中位数基于Bonett和Price[13]的方法。对于假设检验,选择显著性水平为5%(双侧)。未对多重比较进行调整。该探究应用成对删除来处理缺失值,因此所有结果都基于变量内的可用数据。数据的统计分析通过R语言[12] 4.2.2版本实现。
3.结果
CONSORT项目清单已完成,试验的相应图表如图1所示。从2020年5月26日至2022年6月24日,共有78名患者被纳入并进行随机化。共排除3例患者,最终纳入75例患者。2例患者符合排除标准。第1例患者手术当日预计单肺通气时间<30 min,第2例患者未行单肺通气。第3例患者由于先前存在肺部疾病,无法遵循该方案被排除。对39例V-VCV组和36例C-VCV组患者的主要终点进行分析。两组患者的人口学数据,包括患者特征、手术类型和术后镇痛情况见表1。
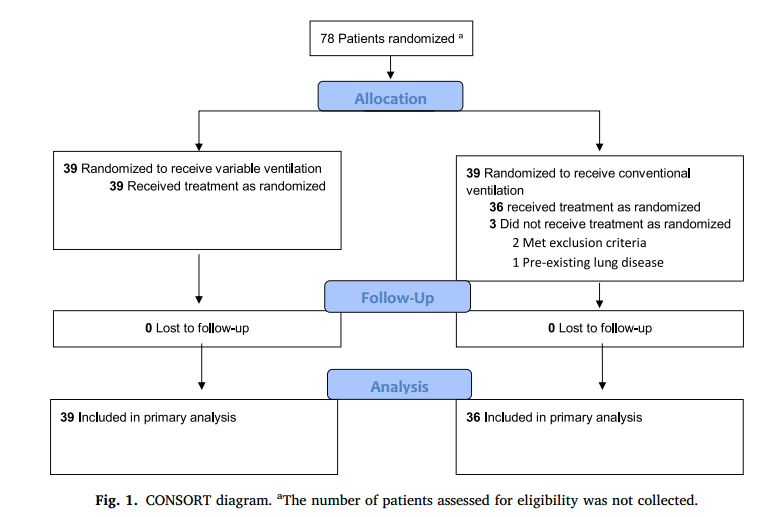
Table 1 Patient characteristics.

3.1术中监测
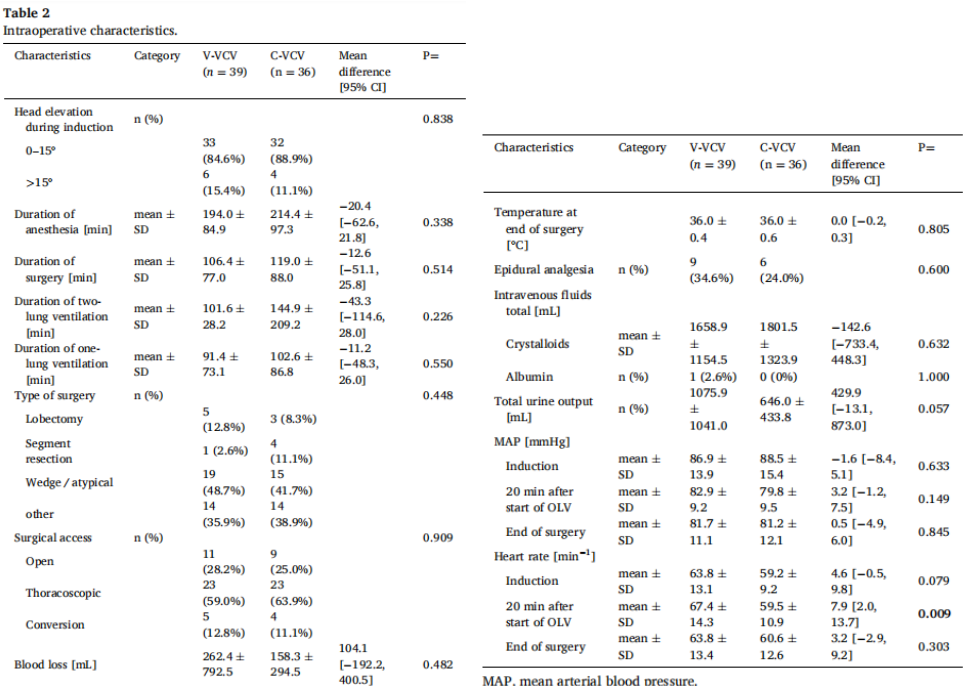
术中变量见表2。在手术类型、手术途径、出血量、补液量、尿量、麻醉方案、硬膜外镇痛的使用、手术时间、麻醉、双肺通气和单肺通气持续时间、平均动脉压和心率方面,组间无显著差异。在开始单肺通气治疗20 min后,V-VCV组心率明显增高。
Table 2 Intraoperative characteristics.
3.2主要和次要结局
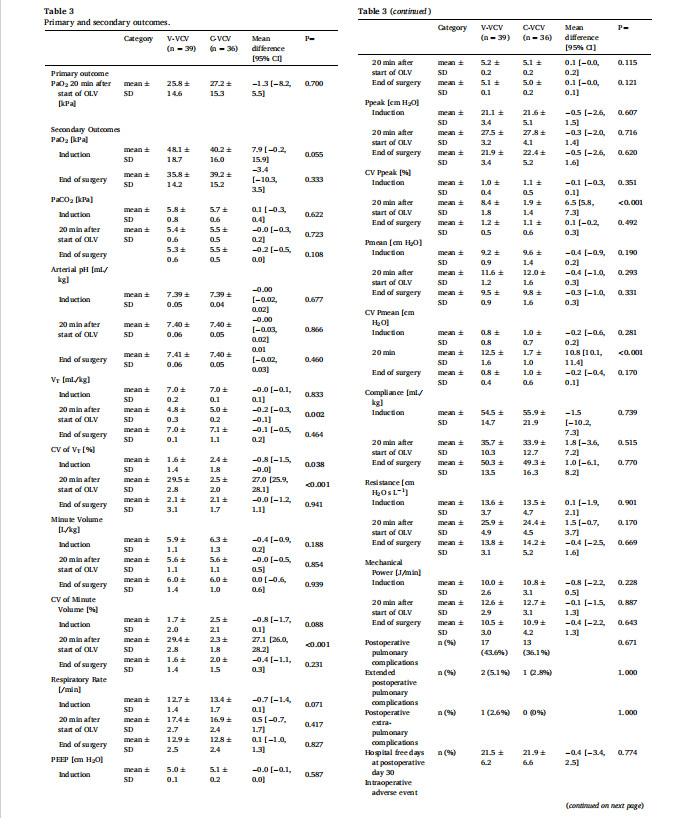
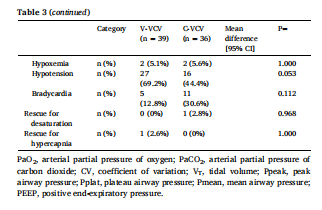
主要和次要结局总结于表3。单肺通气开始后20 min,两组间PaO2无差异(V-VCV: 25.8±14.6 kPa vs C-VCV: 27.2±15.3 kPa;P = 0.700)。此外,在诱导、单肺通气开始后20分钟和手术结束时,各组间PaCO2和pHa无差异。两组间潮气量相似。在V-VCV组中,单肺通气期间VT模式的示例在补充图S1中描述。在V-VCV期间,VT最低至0.8 mL/kg PBW,最高至9.8 mL/kg PBW。单肺通气开始20 min后,V-VCV组VT CV为29.5%,C-VCV组为2.5%。两组间PEEP、气道峰压(Ppeak)、平台压、呼吸系统顺应性和气道阻力、机械功率均无差异。此外,各组之间术中不良事件、低氧血症和高碳酸血症、PPC和EPC而需要采取抢救措施;术后大于30天的住院天数等没有显著差异。
Table 3
4.讨论
该研究发现,在胸外科手术患者单肺通气期间,与C-VCV相比,V-VCV并没有改善气体交换或其他呼吸力学指标。此外,在次要终点机械功率方面,V-VCV和C-VCV没有显著差异。血流动力学、术中并发症、因气体交换障碍而需要抢救治疗、PPC或EPC的发生率、住院天数以及术后第30天额外住院天数也无明显差异。在动物实验[7]和临床研究[5]中报道了可变通气模式,即在预设的平均VT范围,随着每个呼吸周期的变化而变化的VT可以实现有效肺复张。V-VCV肺复张的可能机制包括随机共振[14]、Jensen不等式[15]、表面活性物质释放和功能的改善[16]以及肺复张和呼吸动力学的差异[17-19]。值得注意的是,在啮齿动物肺不张模型中,可变潮气量通气的复张作用随着VT的变化后不久就消失了[19]。此外,可变潮气量通气使得通气血流重新再分布,提示肺通气改善[20]。在大多数研究中,肺复张可使氧合和呼吸力学得到改善[4]。
与该研究的初步假设相反,在单肺通气期间,与C-VCV相比,V-VCV没有改善氧合。然而,该研究的数据与本组之前的研究一致,表明可变潮气量通气并不能改善腹部手术患者的氧合、呼吸系统弹性,也不能将通气重新分配到肺依赖区[6]。另外,该研究结果与另外一项动脉瘤手术的研究结果不一致,对这种差异的一种可能解释是,在该研究中,肺不张的形成更为明显。事实上,这些患者采用零PEEP通气,使用腹部撑开器,手术时间更长。因此,不能完全排除可变潮气量通气可能在肺不张增加和手术时间增加的情况下显示出益处。在本研究的患者中,与C-VCV相比,V-VCV并没有改善呼吸系统力学,特别是呼吸系统弹性阻力,这一事实也与先前的临床研究不一致[5]。造成这种差异的一个可能原因是,本研究患者的PEEP为5cm H2O,可能允许在压力-容积曲线的线性部分进行通气。对气体交换障碍的抢救治疗需求在各组之间没有差异,并且与随机共振假设以及Jensen不等式定理相一致[15],本研究的观察结果也证实了这一点。事实上,当呼吸系统的压力与容积呈线性关系时,可变潮气量通气并不会带来好处[14]。患者呼吸功能未能改善的另一个可能原因是,无论可复张肺组织的数量多少,V-VCV期间的气道峰压都没有达到小气道的开放压力。事实上,V-VCV期间VT达到最大时的气道峰压也低于42 cm H2O,但是在接受全身麻醉的患者中,可能需要气道压力高于40 cm H2O才能使肺组织复张[21]。
在急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的实验模型中,可变潮气量通气可有效减轻组织损伤[20]、炎症和上皮细胞损伤[16,22 - 24]以及肺水肿[25-27]。可能的机制包括应力应变分布的改善[14]、灌注的重新分配[20]、肺表面活性物质释放的增加[16]、肺泡II型细胞促炎反应的降低[22]。原则上,可变潮气量通气降低临床中PPC的发生,但该项研究并不支持这一假设。该研究没有发现可变潮气量通气在PPC、EPC、住院时间以及第30天再住院天数方面有任何优势。然而,这些结果与先前的一项研究一致,先前研究表明,在接受腹部手术的患者中,可变通气与固定通气相比并没有减少肺部不良事件的发生。由于该研究没有发现肺功能和呼吸系统力学的任何改善,所以缺乏临床效益并不奇怪。此外,该研究纳入的患者数量相对较少,而且本研究在临床结局变量方面的说服力不足。
事实上,即使是大型随机临床试验也无法证明术中肺复张对降低PPC发生率的益处[28,29]。这项研究有其优势。PEEP和平均VT的设置严格遵循目前的临床指南[30]。此外,通过随机分配、结果评估者的盲法和避免随访缺失,偏倚被最小化。此外,患者入组时间相对较短,最大限度地减少了临床实践变化的影响。
这项研究也有局限性。首先,虽然患者和术后评估人员不知道分组分配,但是术中无法对麻醉医生实施盲法。其次,30%的VT CV是基于猪肺损伤实验模型的氧合数据得出的[20]。不能排除,健康肺的最佳VT变异性是不同的,健康受试者自主呼吸变量的CV约为33%[31]。第三,本研究使用随机生成的呼吸周期序列,该序列具有VT的高斯分布,这与生理模式不同。第四,V-VCV期间呼吸频率保持恒定,但本组前期研究表明,调节RR对于改善呼吸功能并不是必需的[20,26]。
5 结论
在本研究接受单肺通气的胸外科患者中,与C-VCV相比,V-VCV并没有改善氧合或呼吸力学。
醉仁心胸述评
容量控制通气(Volume-controlled ventilation, VCV)是单肺通气中最常用的机械通气方式[2]。VCV以及稳定状态下的压力控制通气(PCV)产生恒定的潮气量(VT)和呼吸频率(RR),从而产生固定的呼吸模式。相比之下,健康受试者的自主呼吸模式则表现出明显的VT和RR变异性。为了克服这一局限性,可变VCV (V-VCV)这一概念被引入临床实践[3]。在V-VCV期间,VT随呼吸而变化。研究表明,V-VCV可以改善啮齿动物和猪肺损伤模型的气体交换、呼吸力学甚至肺保护[4]。在接受腹部大手术的患者中,V-VCV可改善术中肺功能[5]。然而,这些结果在最近接受腹部手术的患者中并没有得到证实[6],这可能是由于存在轻微的肺不张。理论上,V-VCV可能改善呼吸力学和气体交换,因为它能够促进肺复张[7],尤其是单肺通气等可引起显著肺不张的情况。事实上,V-VCV可改善猪单肺通气期间的肺功能[8],但尚未在临床实践中进行测试。
该文献的目的是研究在单肺通气术中V-VCV和常规容量控制通气(C-VCV)对术中肺功能的影响。并假设V-VCV可以改善在接受胸外科手术的患者术中单肺通气期间的动脉氧合,但后续的研究结果表明,与C-VCV相比,V-VCV并没有改善氧合或呼吸力学。
该文献也具有局限性,如研究过程中操作医生未实施盲法,样本量较小等,在未来的研究中,仍需要更多的临床数据来验证这一结论。
原始文献
Wittenstein J, Huhle R, Mutschke AK, et al. Comparative effects of variable versus conventional volume-controlled one-lung ventilation on gas exchange and respiratory system mechanics in thoracic surgery patients: A randomized controlled clinical trial. J Clin Anesth. 2024;95:111444. doi:10.1016/j.jclinane.2024.111444
参考文献
[1]Vivona L, Huhle R, Braune A, Scharffenberg M, Wittenstein J, Kiss T, et al. Variable ventilation versus stepwise lung recruitment manoeuvres for lung recruitment: a comparative study in an experimental model of atelectasis. Eur J Anaesthesiol 2023 Jul 1;40(7):501–10.
[2]Uhlig C, Neto AS, van der Woude M, Kiss T, Wittenstein J, Shelley B, et al.
Intraoperative mechanical ventilation practice in thoracic surgery patients and its
association with postoperative pulmonary complications: results of a multicenter
prospective observational study. BMC Anesthesiol 2020 Jul 22;20(1):179.
[3] Spieth PM, Guldner A, Uhlig C, Bluth T, Kiss T, Conrad C, et al. Variable versus
conventional lung protective mechanical ventilation during open abdominal surgery (PROVAR): a randomised controlled trial. Br J Anaesth 2018 Mar;120(3): 581–91.
[4]Wittenstein J, Scharffenberg M, Braune A, Huhle R, Bluth T, Herzog M, et al. Effects of variable versus non-variable controlled mechanical ventilation on pulmonary inflammation in experimental acute respiratory distress syndrome in pigs. Br J Anaesth 2020 Feb 4;124(4):430–9.
[5]Scharffenberg M, Huhle R, Wittenstein J, Ran X, Zhang Y, Braune A, et al. Low
positive end-expiratory pressure ventilation increases mechanical power and
pulmonary neutrophilic inflammation in an experimental model of moderate to
severe acute lung injury. Am J Respir Crit Care Med 2022 May 1:205.


