Nat Commun:北京大学伊鸣/万有揭示了外周炎症大鼠的自发性疼痛是由边缘皮层前区神经元群介导的
时间:2024-09-13 15:06:37 热度:37.1℃ 作者:网络
由于缺乏对自发疼痛的神经基础的全面理解,限制了针对慢性疼痛患者主诉的治疗策略的发展。
2024年9月10日,北京大学伊鸣及万有共同通讯在Nature Communications 在线发表题为“A distinct neuronal ensemble of prelimbic cortex mediates spontaneous pain in rats with peripheral inflammation”的研究论文,该研究揭示了自发疼痛在神经元水平上的皮层基础,突出了前边缘皮层及其相关的疼痛调节脑网络中独特的神经元集合。
研究阐述了在大鼠慢性炎症性疼痛中,在处理自发疼痛相关信号的前边缘皮层中有一个独特的神经元集合。这种神经元集合专门编码自发的疼痛相关行为,独立于其他运动和诱发行为。该神经元群的激活引发了明显的自发疼痛样行为并增强了伤害性反应,而长时间沉默其活动可减轻自发疼痛并促进炎症性疼痛的整体恢复。值得注意的是,来自初级体感皮层和边缘下皮层的传入信号双向调节自发疼痛反应的边缘前皮层神经元群的活动和疼痛行为。

疼痛是由实际或潜在的组织损伤引起的一种不愉快的体验。组织损伤早期的急性疼痛对个体生存具有重要的预警和保护意义,但持续的慢性疼痛可能导致多维度的行为异常,给社会和经济带来巨大负担。越来越多的证据表明,慢性疼痛不仅仅是一种持续的伤害感觉状态,而是通过中枢神经系统逐渐进行的可塑性变化而建立的一种适应状态,反映在自发脑活动的动态变化和疼痛相关神经元活动的神经可塑性上。
自发性疼痛无明显外因或诱因,常处于持续波动状态。持续性自发性疼痛调节了对外部刺激的诱发反应,如伤害感受和负面影响,从而影响疼痛的整体进展。在临床上,自发性疼痛只存在于病理性疼痛状态中,是患者最常见和最严重的痛苦,严重影响患者的生活质量。传统上,由于技术限制,绝大多数临床前疼痛研究和药物开发都是基于诱发而非自发疼痛模型,这是新型镇痛药在临床试验中一再失败的关键原因。虽然外周机制正在出现,但自发性疼痛的脑机制尚不明确。
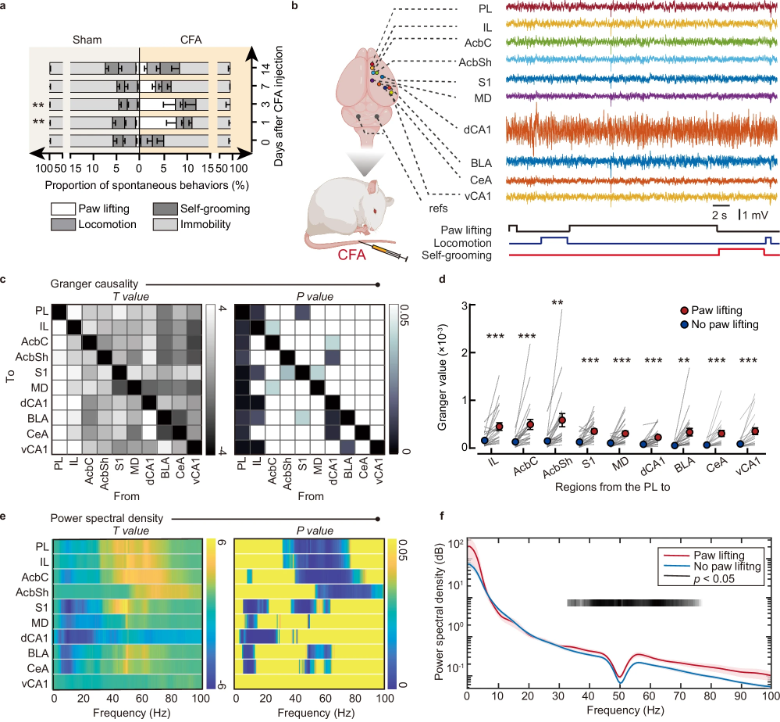
前边缘皮层(PL)在自发性疼痛行为中的关键作用(图源自Nature Communications )
多个大脑区域在疼痛时经历动态变化。初级体感皮层(S1)和外侧丘脑始终对伤害性信号作出反应,而边缘系统与持续自发疼痛和慢性疼痛的关系更为密切。特别是内侧前额叶皮层(mPFC)在自发性疼痛中起着重要作用,与S1相比,它描绘了不同的疼痛特征。在mPFC的伽马波段(60-90hz)的神经振荡与持续疼痛的主观感知呈正相关,而持续疼痛强度是由mPFC血氧水平依赖(BOLD)信号反映的。mPFC由不同的子区域组成,具有不同的解剖和功能,其中背侧部分与岛叶的连接有助于识别容易出现持续性背痛的患者。在患有外周炎症的啮齿动物中,mPFC腹侧极的边缘下皮层(IL)在持续自发性疼痛期间显示出与海马腹侧CA1的活动和连接中断,挽救这种功能障碍可以减轻自发性疼痛并加速整体恢复。相比之下,前边缘皮层(PL),即mPFC的背极,已经被证明能够编码与恐惧、学习和感知相关的行为。
在成像研究中,人类的这个mPFC亚区与自发性疼痛有关。值得注意的是,PL深层的兴奋性锥体神经元表现出内在的兴奋性和转录变化,并在慢性疼痛中发挥关键作用。然而,目前还缺乏直接的证据来证明PL神经元群参与编码和调节自发性疼痛行为。研究结合疼痛行为的纵向监测、体内电生理动力学、活动依赖标记与稳健活动系统(RAM)、光遗传学/化学遗传学操作和病毒介导的电路追踪,在大鼠慢性炎症性疼痛中鉴定了PL中特异性编码自发疼痛的神经元集合,并验证了其电生理特征、行为功能和电路结构。
参考消息:
https://www.nature.com/articles/s41467-024-52243-3


