震惊!葛根芩连片竟然能调节肠道紊乱,阻止老年痴呆症恶化!
时间:2024-09-16 23:01:17 热度:37.1℃ 作者:网络
阿尔茨海默病(AD)是一种典型的神经退行性疾病,主要表现为记忆力逐渐衰退及认知功能障碍。在AD的进展过程中,神经炎症是一个关键的神经病理学特征,其初始阶段为大脑内β-淀粉样蛋白(Aβ)斑块的异常沉积。这一过程激活了反应性小胶质细胞和星形胶质细胞的积聚,反应性胶质细胞能够分泌促炎细胞因子,进而引发神经炎症、神经元损伤等。
葛根芩连片(GGQLT)是一种由葛根、黄芩、黄连及甘草组成的传统清热方剂,在临床中被广泛应用于炎症性疾病的治理。依据中医理论,清热法与AD的治疗具有理论上的兼容性。然而,目前尚无确切证据表明GGQLT具备神经保护功能,以及能否有效缓解AD引发的神经炎症反应。
日前,一篇名为“Gegen Qinlian tablets delay Alzheimer’s disease progression via inhibiting glial neuroinflammation and remodeling gut microbiota homeostasis”的文章探讨了GGQLT对抗AD的相关机制。

图1 论文首页
长期的GGQLT治疗可改善AD大鼠的认知功能缺陷,且无毒性反应
图2A显示了具体实验步骤及时间安排。研究在14周的治疗后,对大鼠的认知功能进行评估。导航测试阶段,与对照组相比,模型组大鼠的逃避潜伏期显著延长,表明其行为模式存在异常。而GGQLT治疗组中,逃避潜伏期和指标从第二天至第五天逐渐降低(图2B 、C)。代表性大鼠的游泳路径如图2D所示。值得注意的是,整个实验过程中,各组大鼠的运动活动水平未见显著差异(图2E)。在空间探索测试中,AD模型大鼠在平台象限停留时间较短,主要在水箱边缘进行导航。与此相反,接受GGQLT治疗的大鼠在平台原始位置附近停留时间较长,且穿越频率呈现剂量依赖性增加,表明其认知能力相对于AD模型大鼠有所提升(图2F、G)。以上结果提示GGQLT治疗能有效改善AD模型大鼠的认知功能。
为评估GGQLT治疗的长期毒性,研究对实验动物的体重进行了测量,并对肝脏及肾脏组织进行了HE染色。在整个实验期间,GGQLT的给药未对实验动物的体重产生影响。同时,所有组别大鼠在第 13 周时体重略有下降,可能与手术操作有关(图2H)。肝脏切片镜检结果显示,GGQLT治疗组的肝细胞结构正常,呈放射状排列,围绕中央静脉,细胞核染色较深,与对照组形态相似。此外,肾实质组织结构规则,肾小球和肾小管形态正常,GGQLT治疗组中未观察到明显的病理损伤(图2I)。这表明长期口服GGQLT是安全的。
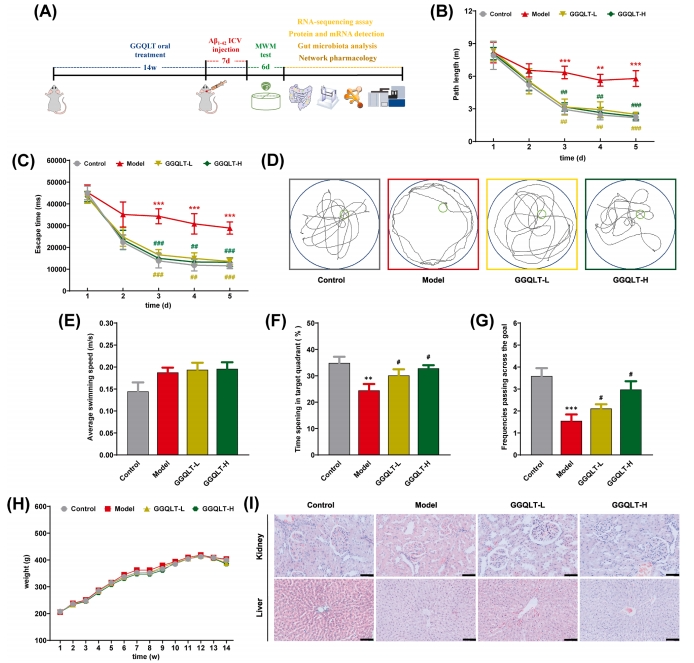
图2 GGQLT改善了注射了Aβ1-42的大鼠的认知能力缺陷
GGQLT抑制海马中的NF-κB和MAPK信号通路
研究通过免疫组化(IHC)检测,观察了IκBα及其下游NF-κB p65的蛋白质表达情况。结果显示,AD大鼠海马组织中,p-IκBα和p-NF-κB p65的表达水平升高。采用不同剂量的GGQLT治疗后,这些表达水平呈现剂量依赖性的逆转(图3A-C)。进一步的蛋白质印迹分析结果显示,总IκBα和NF-κB p65的水平未见显著变化,而AD大鼠海马中p-IκBα和p-NFκB p65的水平升高。GGQLT治疗以剂量依赖性方式降低p-IκBα和p-NFκB p65的水平(图3D、E)。
此外,p38、ERK和JNK是MAPK信号通路活化的标志。IHC分析表明,与对照组相比,AD大鼠海马组织中磷酸化的p38、ERK和JNK水平显著升高。GGQLT治疗导致这些蛋白质的表达水平以剂量依赖性方式降低(图3F-I)。Western blot分析也证实,AD大鼠的p-p38/p38、p-ERK/ERK和p-JNK/JNK比率显著升高,但GGQLT治疗以剂量依赖性方式逆转了这些蛋白质的表达水平(图3J、K)。综上所述,GGQLT治疗能够有效抑制NF-κB和MAPK信号通路的过度激活。
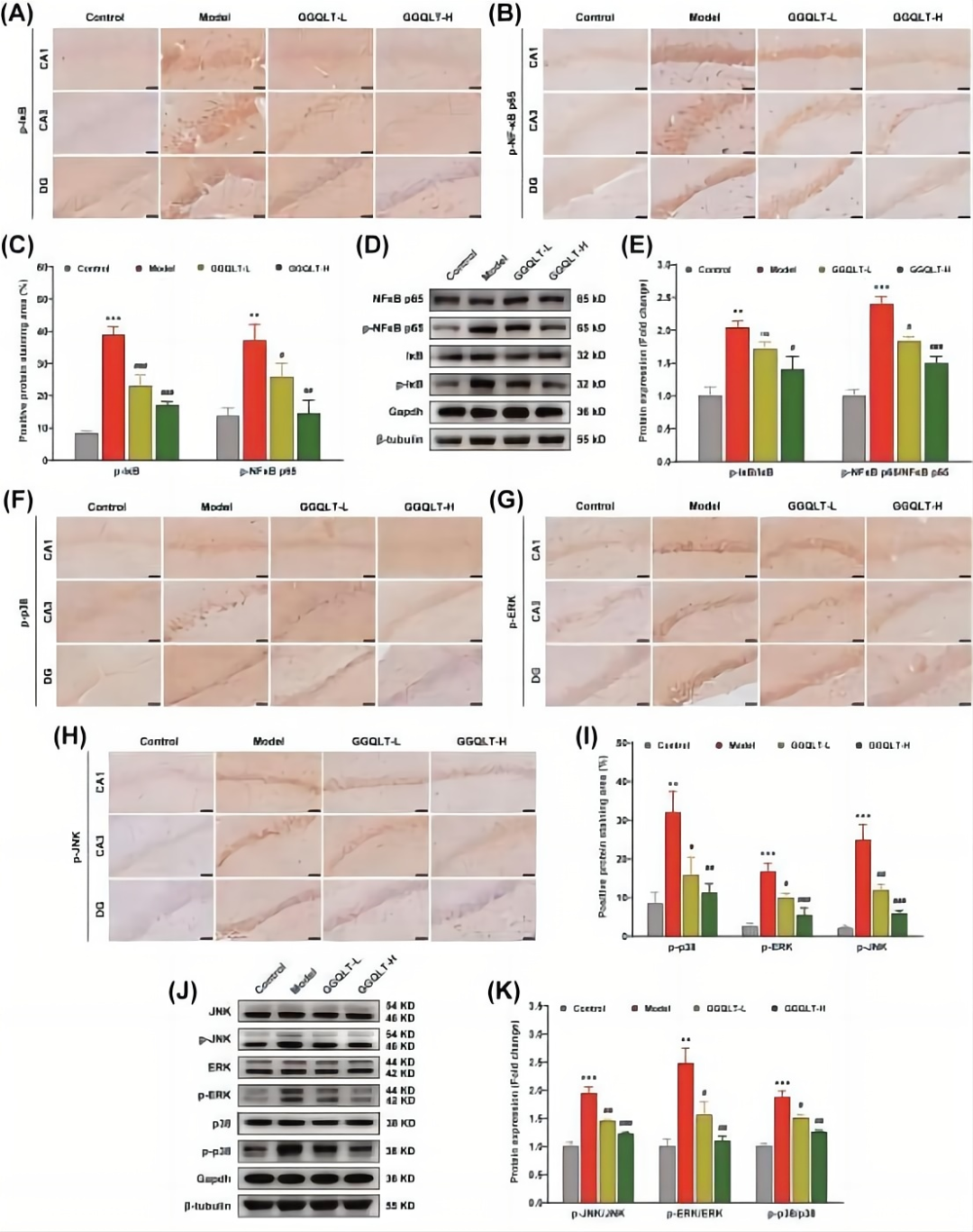
图3 GGQLT治疗抑制了海马组织中NF-κB和MAPK信号通路的激活
GGQLT 重塑AD大鼠异常肠道细菌菌群
为评估肠道菌群的动态变化,研究收集了粪便样本并进行了16S rRNA测序分析。α多样性分析显示,与对照组和GGQLT治疗组相比,AD组呈现出较低的趋势。尽管如此,GGQLT治疗显著提升了细菌类群的丰富度和多样性(图4A)。PCoA分析结果显示,GGQLT治疗组样品的成分分布趋势与对照组相似,而这两个组均与AD组存在显著差异(图4B)。维恩图分析显示,对照组、AD组及GGQLT-H治疗组分别具有4915、4725和4405个常见或独特的OTU,同时这三个组之间共有804个OTU(图4C)。
为进一步探究肠上皮细胞的特异性改变,研究分析了微生物群中优势类群(前10个)的相对丰度。在门分类学水平上,厚壁菌门和拟杆菌门为各组的主要门类。与对照组相比,AD组大鼠的拟杆菌门比例显著增加,而厚壁菌门比例减少,导致厚壁菌门/拟杆菌门比例降低(图4D)。在厚壁菌门中,AD组瘤胃球菌科和颤螺旋菌属的比例较低;在拟杆菌门中,AD组普雷沃菌科和普雷沃菌属的比例较高。经GGQLT治疗后,这些异常的细菌菌群组成得到显著改善,厚壁菌门/拟杆菌门比例趋于平衡。具体而言,与AD组相比,GGQLT治疗组中Ruminococcaceae和Oscillospira的丰度呈现明显上调,而Prevotellaceae和Prevotella的丰度呈现明显下调(图4E-I)。
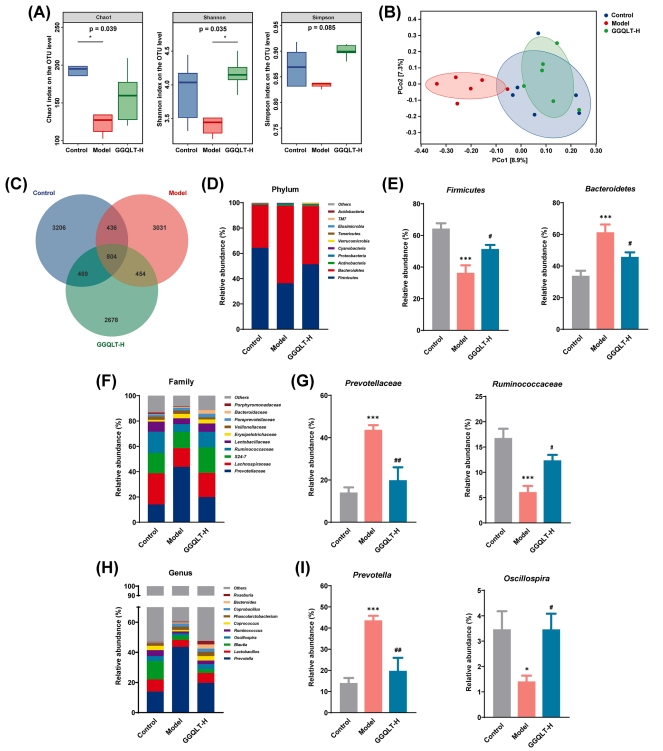
图4 GGQLT可调节AD大鼠异常的肠道真菌菌群
GGQLT减弱了海马中的神经胶质激活和神经炎症
Aβ引起的星形胶质细胞和小胶质细胞的激活是AD的核心神经病理因素。Iba-1和GFAP被广泛作为小胶质细胞和星形胶质细胞反应性的特异性标记。海马区,尤其是CA1、CA3和DG亚区,是学习和记忆的关键大脑区域(图5A)。IHC分析表明,在AD大鼠的海马CA1、CA3和DG区域中,Iba-1和GFAP的阳性密度显著增加。然而,GGQLT-L治疗显著降低了海马中Iba-1和GFAP的反应性,GGQLT-H治疗组的效果则更为显著。在形态学上,胶质细胞可分为静止亚型或反应亚型,后者通常与病理状态相关。与胶质增生减少一致,形态学分析显示AD大鼠海马中的小胶质细胞和星形胶质细胞呈现圆形和扩大的细胞体,伴有伪足,表现为反应状态。值得注意的是,GGQLT治疗恢复了反应性小胶质细胞和星形胶质细胞的病理形态(图5B-D)。
反应性小胶质细胞和星形胶质细胞能够产生多种促炎症细胞因子,包括TNF-α和IL-1β。研究检测了海马中这些炎症标志物的水平。结果显示,AD大鼠海马组织中IL-1β和TNF-α的mRNA水平及浓度均升高。相反,GGQLT组的数值明显较低(图5E)。此外,ELISA结果显示AD组海马组织中IL-1β和TNF-α的浓度升高,而GGQLT以剂量依赖性方式抑制了这些浓度(图5F),Western blot实验也进一步验证了这一结论(图5G-H)。表明GGQLT能够调节神经胶质细胞的活化,从而减少AD大鼠脑内的神经炎症。
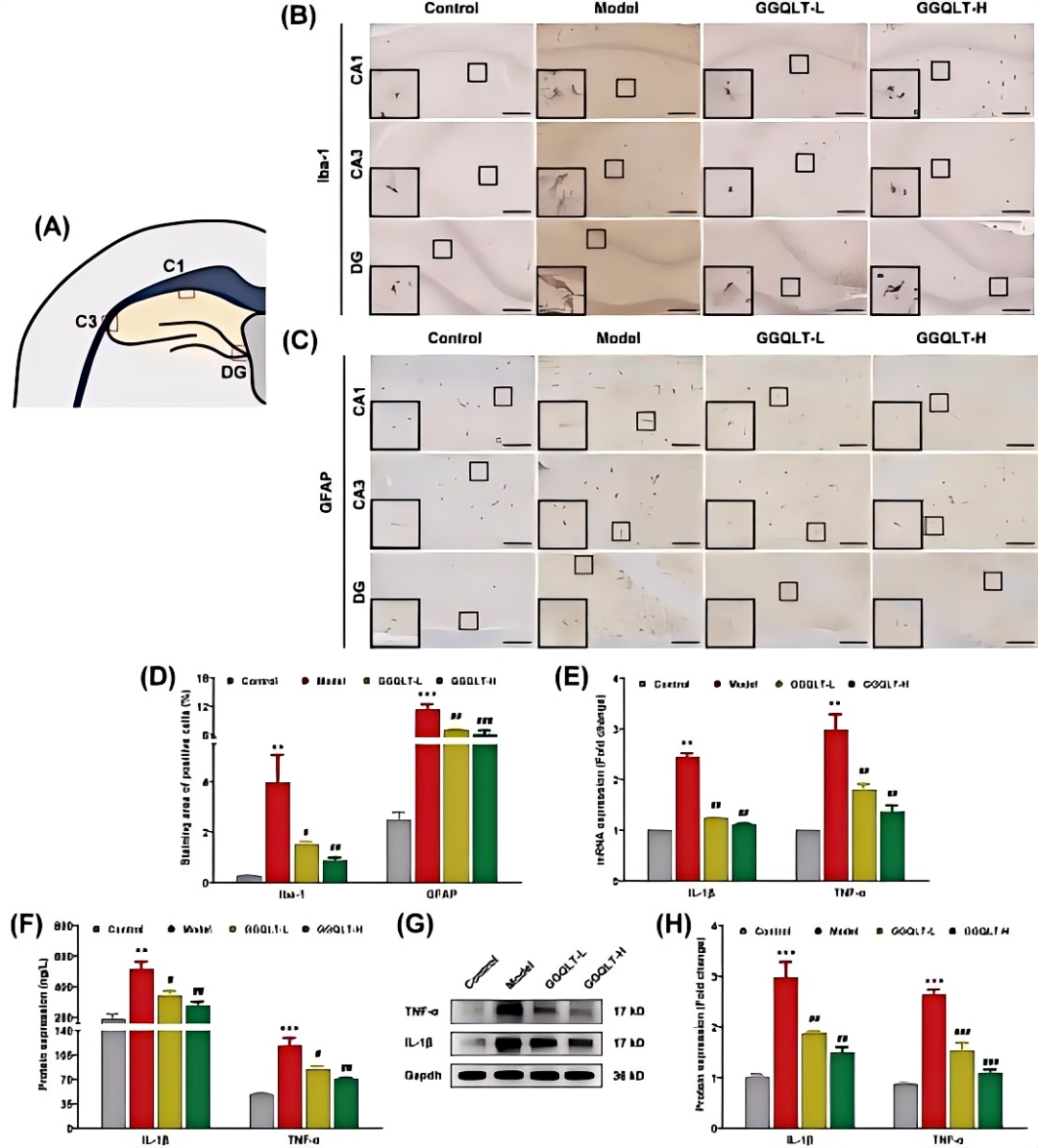
图5 GGQLT治疗减轻了海马神经胶质细胞的激活,减少了炎症细胞因子
结论
研究揭示,GGQLT通过抑制 NF-κB/MAPK 信号通路,能够显著改善AD大鼠的认知功能障碍,减少星形胶质细胞增生及微胶质细胞增生,同时减轻神经炎症反应。并通过部分纠正AD大鼠的肠道菌群失衡,展现出神经保护作用,表明其可能具备作为治疗AD的多靶点中药方剂的潜在价值。
参考文献:
Wang L, Lu Y, Liu J, Wang S, Fei Z, Zhang K, Zhang D, Jin X. Gegen Qinlian tablets delay Alzheimer's disease progression via inhibiting glial neuroinflammation and remodeling gut microbiota homeostasis. Phytomedicine. 2024 Jun;128:155394. doi: 10.1016/j.phymed.2024.155394


