食管胃癌检出CCNE1扩增有什么意义?关于预后和靶向/免疫治疗疗效
时间:2024-09-21 12:00:15 热度:37.1℃ 作者:网络
CCNE1 扩增导致的细胞周期蛋白 E 过表达是胃癌基因组不稳定的关键驱动因素,但其临床意义尚不清楚。因此,本研究对 7083 例食管胃肿瘤进行了基因组、转录组和免疫分析,探索了 CCNE1 扩增对分子特征和治疗结果的影响。在 6.2% 的食管腺癌、7.0% 的食管胃交界部癌、4.2% 的胃腺癌和 0.8% 的食管鳞状细胞癌样本中发现了 CCNE1 扩增。与原发性肿瘤相比,淋巴结和肝脏等转移部位的 CCNE1 扩增频率较高。与染色体不稳定性表型一致,CCNE1 扩增与较少的 CDH1 突变以及较多的 TP53 突变和 ERBB2 扩增有关。CCNE1 扩增和非扩增肿瘤的免疫生物标志物(如 PD-L1 表达和肿瘤突变负荷)没有差异,而从转录分析来看,CCNE1 扩增与免疫群体的改变有关,如较少的 B 细胞和较多的 M1 巨噬细胞。真实世界生存分析表明,CCNE1 扩增/HER2 阳性胃癌患者曲妥珠单抗治疗后生存较差,CCNE1 扩增胃癌患者免疫治疗后生存较好。这些数据提示,CCNE1 扩增胃癌具有独特的分子和免疫特征,这具有重要的治疗意义,需要进一步研究 CCNE1 扩增作为预测性生物标志物。
研究背景
胃腺癌是全球最常见的癌症之一,每年有超过 100 万新诊断病例和 70 万死亡病例。全面的分子检测已确定了胃癌的关键基因变异,定义了四种分子亚型:基因组稳定 (GS)、染色体不稳定性 (CIN)、微卫星不稳定性 (MSI) 和 EB 病毒阳性 (RRID:SCR_003193)。虽然对患者肿瘤进行基因检测已变得很普遍,但用于胃癌治疗的临床可操作生物标志物仅限于 HER2 阳性/扩增、微卫星不稳定性高 (MSI-H) 状态和 PD-L1 过表达。目前,PD1 抑制剂(如纳武利尤单抗和帕博利珠单抗)已获批与化疗联合用于一线治疗,但获益不大,中位生存期仍为 1 至 2 年(3-6 年)。最近的数据表明,对于 Claudin 18.2 阳性肿瘤患者(约占胃癌的 30%-40%),将 Claudin 18.2 抗体佐妥昔单抗加入化疗可改善预后;然而,该药物尚未获批,且将中位总生存期 (OS) 延长不超过 3 个月。因此,迫切需要确定胃癌患者中其他临床相关生物标志物。
可能影响治疗反应的一种改变是细胞周期调节因子细胞周期蛋白 E 过表达,通常是由基因 CCNE1 拷贝数扩增导致的。根据癌症基因组图谱 (TCGA) 分析,CCNE1 扩增已在多种肿瘤类型中被发现,包括约 12% 的食管胃癌 (EGC) 和 20% 的高级别浆液性卵巢癌。CCNE1 扩增会促进非计划的 S 期进入、DNA 复制应激和 CIN。先前的研究发现,CCNE1 扩增与部分胃癌患者肝转移增加以及生存率低相关。CCNE1 通常与 ERBB2 扩增/HER2 过表达有关,临床前和临床研究表明,CCNE1 扩增会促进对 HER2 靶向疗法(曲妥珠单抗和拉帕替尼)的耐药性。此外,免疫学上 T 细胞丰度低的“冷”食管胃 (EG) 腺癌表现出 CCNE1 扩增的富集,提示 CCNE1 扩增可能促进免疫耐药。然而,CCNE1 扩增在真实世界人群中的临床影响尚不清楚。本研究对 CCNE1 扩增的 EGC 进行了详细的分子分析,以了解这些肿瘤的基因组和免疫图谱并确定治疗结果。
研究结果
患者人口统计学和CCNE1扩增状态
研究人群由 7083 名患者组成,包括 751 名食管鳞状细胞癌 (ESCC) 患者,2276 名食管腺癌 (EA) 患者,1449 名食管胃交界部癌 (EJC) 患者和 2607 名胃腺癌患者。患者基线特征总结于表 1。我们进行了 NGS(包括靶向和全外显子组测序 [WES]),识别每个肿瘤样本中的突变和拷贝数 (CN) 变异 (CNA),使用 CCNE1 CN≥6 的阈值来定义 CCNE1 扩增。与腺癌相比,ESCC 显示出较窄的 CCNE1 扩增范围(图 1A)。我们在 6.2% 的 EA、7.0% 的 EJC 和 4.2% 的胃腺癌样本中发现了 CCNE1 扩增;相比之下,CCNE1 在 ESCC 中很少扩增(0.8%;图 1B)。EA、EJC、胃腺癌和 ESCC 的 CCNE1 CN 中位数分别为 2.05、2.05、1.97 和 1.98。我们比较了既往未接受过与接受过治疗的肿瘤的 CCNE1 扩增率,发现 CCNE1 扩增频率在未治疗的 EA 中较高,但在其他 EGC 亚型中没有差异,提示 CCNE1 扩增可能在治疗前诊断时就存在。
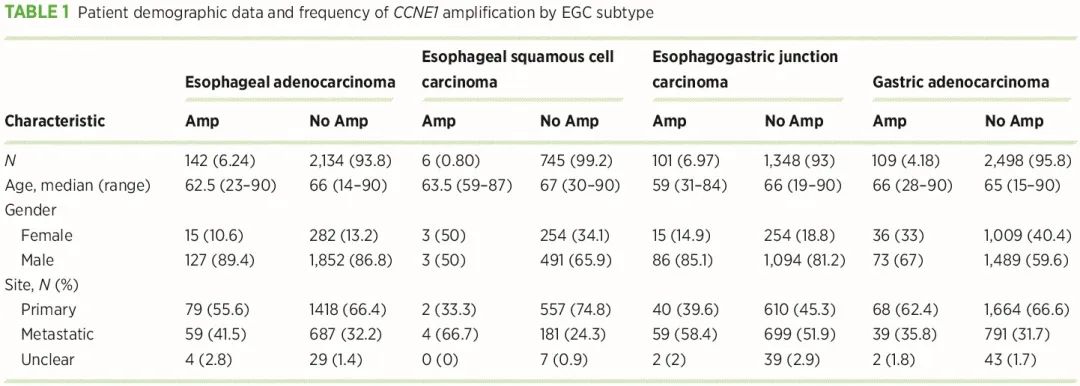
表1
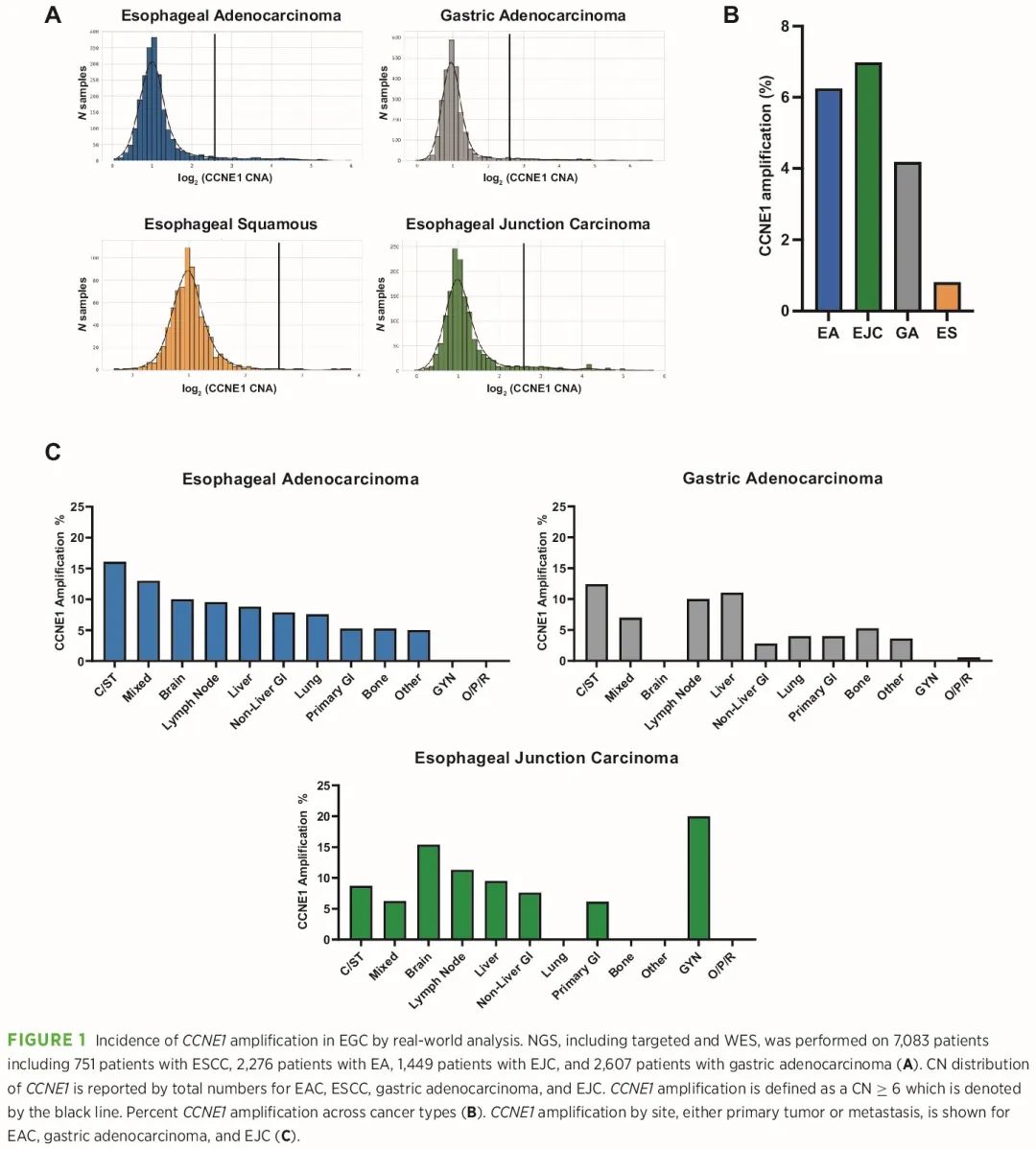
图1
4438 个样本来自原发性肿瘤(63%),2591 个样本来自转移性肿瘤(37%)。与原发性肿瘤相比,转移部位的 CCNE1 扩增频率往往更高(图 1C)。CCNE1 在 EA 原发性肿瘤中的扩增频率为 5.3%,而在转移性样本中为 9.1%(P = 0.0061,Fisher 精确检验),在肺转移中的扩增率为 7.6%,肝转移中为 8.8%,淋巴结转移中为 9.5%,脑转移中为 10%,结缔/软组织转移中为 16.1%。类似地,我们观察到胃腺癌转移部位(6.0%),如肝脏和淋巴结转移(分别为 11.1% 和 10.4%)的 CCNE1 扩增频率高于原发性肿瘤(3.9%;P = 0.037,Fisher 精确检验)。这些数据表明 CCNE1 扩增在 EG 腺癌中较常见,尤其是在转移性病变中。
共突变和肿瘤生物标志物发生率,根据CCNE1扩增分类
接下来使用 WES 数据和 IHC,评估了 CCNE1 扩增的常见共突变,并比较了 CCNE1 扩增和非扩增 EG 腺癌的分子谱。我们观察到关键致癌基因和肿瘤抑制因子的几个差异。EG 腺癌中最常见的共突变基因是 TP53,这与 CCNE1 扩增 EG 腺癌与 CIN 分子亚型最相关一致(图 2A)。我们观察到 TP53 突变在 CCNE1 扩增的胃腺癌中显著富集(87.0% vs. 54.6%,P = 3.2 × 1011),但在 CCNE1 扩增的 EA 中仅略有增加(90.6% vs. 85.6%,P = 0.10)。此外,CCNE1 扩增的 EG 腺癌中 FBXW7 突变增加,其中 CCNE1 扩增的 EA 显著增加(8.9% vs. 2.4%,P = 0.002),CCNE1 扩增的胃腺癌略有增加但不具有统计学意义(5% vs. 3.4%,P = 0.39;图 2A)。有趣的是,FBXW7 编码一种泛素连接酶复合物,该复合物已被证明在翻译后对多种关键蛋白质产生负向调节作用,包括 CCNE1。
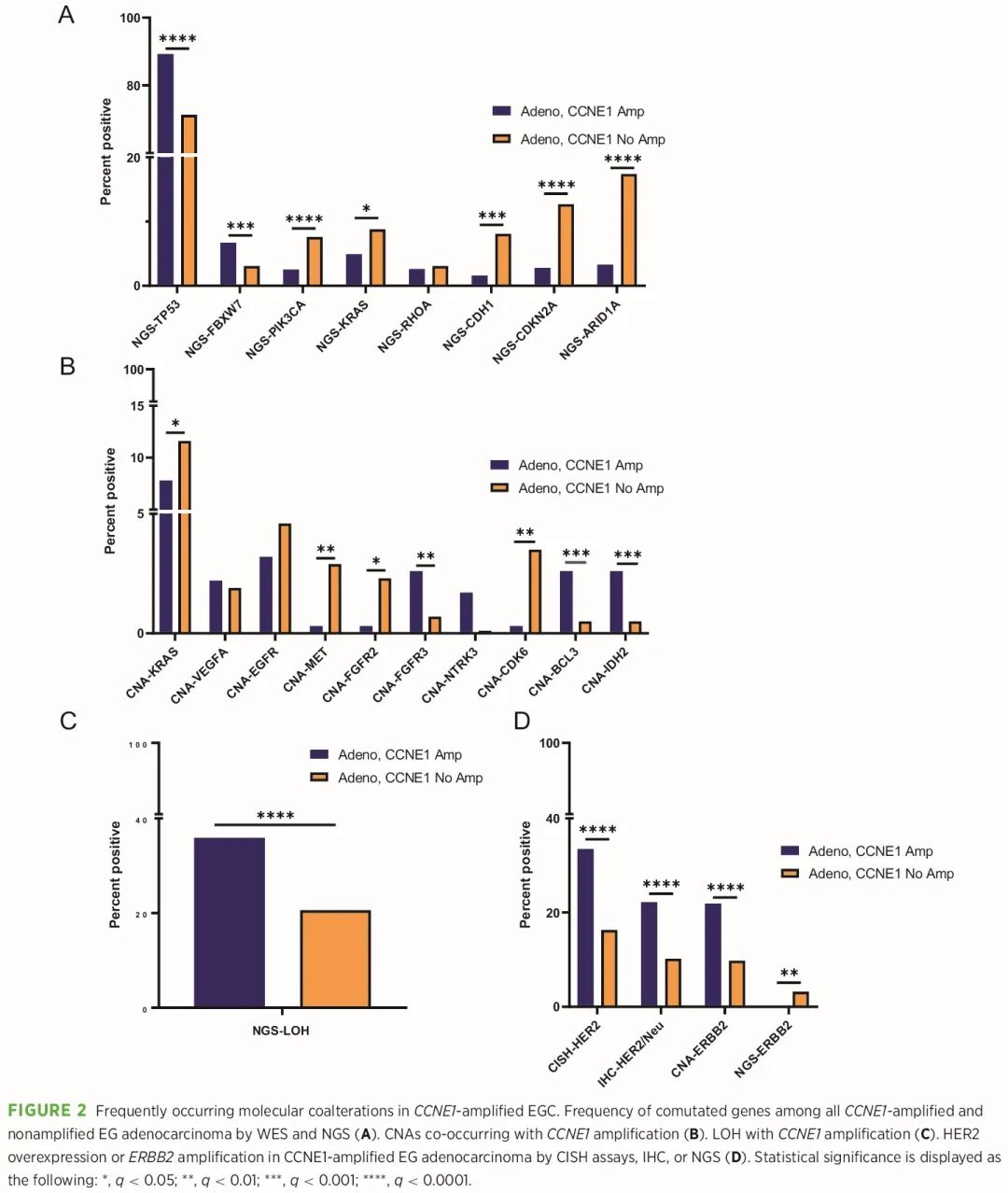
图2
TCGA 分析显示,GS 胃腺癌中描述了几种常见改变,包括 CDH1 和 RHOA 突变以及 CLDN18:ARHGAP 融合。我们观察到 CCNE1 扩增胃腺癌相比非扩增胃腺癌,CDH1 突变显著较少(2.9% vs. 16.4%,P = 0.0002),CLDN18:ARHGAP 融合也较少(0% vs. 6.8%);然而,RHOA 突变的频率相似。我们还观察到胃腺癌和 EA 中与 EBV+ 亚型相关的 PIK3CA 突变频繁发生,CCNE1 扩增胃腺癌相比非扩增胃腺癌发生率较低(1.9% vs. 9.2%,P = 0.01),CCNE1 扩增 EA 与非扩增 EA 发生率相似。最后,CCNE1 扩增 EG 腺癌中 ARID1A 和 CDKN2A 突变呈显著下降趋势。
CNA 分析显示 CCNE1 扩增 EG 腺癌中几个基因 CNA 存在差异(图 2B)。CCNE1 扩增相比非扩增 EG 腺癌,FGFR3、BCL3 和 IDH2 CNA 显著增加(图 2B)。探索了其他 CNA(除 ERBB2 外)作为潜在的驱动变异或可靶向生物标志物,发现在 CCNE1 扩增 EG 腺癌中频率降低,包括 KRAS(7.8% vs. 11.6%,P = 0.32)、EGFR(3.2% vs. 4.6%,P = 0.22)、MET(0.3% vs. 2.9%,P = 0.004)和 FGFR2(0.3% vs. 2.3%,P = 0.013),提示 CCNE1 扩增在分子上与其他驱动因素不同。LOH 是许多癌症中常见的遗传事件,也是 CIN 的标志。我们利用 WES 数据评估基因组 LOH,观察到 CCNE1 扩增的 EG 腺癌中 LOH 显著增加(35.9% vs. 20.6%,P = 3.1 × 106;图 2C)。
先前的研究表明,胃癌和乳腺癌中 CCNE1 和 ERBB2 同时存在局部扩增。与这些数据一致,我们也发现,显色原位杂交 (CISH)、IHC 或 NGS 显示 CCNE1 扩增 EG 腺癌中 HER2 过表达或 ERBB2 扩增显著增加(图 2D)。相比之下,CCNE1 扩增 EG 腺癌中 ERBB2 突变减少。
为了进一步确定 CN 水平是否与差异化基因组特征相关,我们比较了 CCNE1 CN≥6(扩增)、CN≥3 且 <6(增益)和 CN<3(中性)的肿瘤。有趣的是,我们观察到基于 CN 水平的特定变异的逐步差异。例如,与 CCNE1 中性和扩增肿瘤相比,CCNE1 增益的 EA 显示出中等频率的 TP53、CDKN2A、ARIDA 和 ERBB2 变异,CCNE1 增益的胃腺癌显示出中等水平的 TP53 突变、CDH1 突变、KMT2D 突变、LOH 和 ERBB2 扩增。这些数据提示,基于 CCNE1 CNA 的程度,分子表型可能存在差异。
将我们关于 EGC 中 CCNE1 扩增率的发现与纪念斯隆凯特琳癌症中心 (MSK) 癌症发现 2017 队列 [cBioPortal 中公开] 进行了比较。在接受 MSK-IMPACT 测序的 341 个食管胃肿瘤中,9.2% (32 个样本) 存在 CCNE1 扩增,包括 13/147 (8.8%) 个胃腺癌样本、12/137 (8.8%) 个 EAC 样本和 7/57 (12.3%) 个 EJC 样本。虽然样本量较小,但共突变分析显示,CCNE1 扩增组相比非 CCNE1 扩增组有以下趋势:FBXW7 突变增加(9.4% vs. 3.2%,P = 0.11),ERBB2 扩增增加(43.8% vs. 27.5%,P = 0.066),CDH1 突变减少(0% vs. 6.47%,P = 0.24),CDKN2A 突变减少(3.1% vs. 12.0%,P = 0.23),ARID1A 突变减少(0% vs. 14.2%,P = 0.022)。总体而言,这些发现与我们更大的真实世界队列的全面基因组分析基本一致,表明 CCNE1 扩增的 EG 腺癌与未扩增的肿瘤相比具有不同的分子图谱。
CCNE1扩增EGC的免疫微环境和转录图谱
CIN 与免疫细胞排斥有关,先前的 TCGA 肿瘤分析表明,“免疫冷”CIN 型 EG 腺癌富含 CCNE1 扩增,与低 CD8+ T 细胞丰度相关。因此,我们分析了 CCNE1 扩增 EGC 中的免疫相关生物标志物。我们观察到 CCNE1 扩增腺癌中 dMMR/MSI-H 肿瘤显著减少 (0.6% vs. 5.6%, P = 5.0 × 10−5),而 CCNE1 扩增和非扩增肿瘤之间的 TMB-H状态 (≥10 mt/Mb) 没有显著差异 (图 3A)。CCNE1 扩增和非扩增肿瘤的中位 TMB 均为 4.0。PD-L1 是一种经过验证的生物标志物,联合阳性分数 (CPS) 表达较高往往会赋予对抗 PD1 抑制剂的更高反应性,但我们发现 PD-L1 阳性 (CPS ≥1) 的比例或平均 PD-L1 CPS 没有差异 (图 3A)。
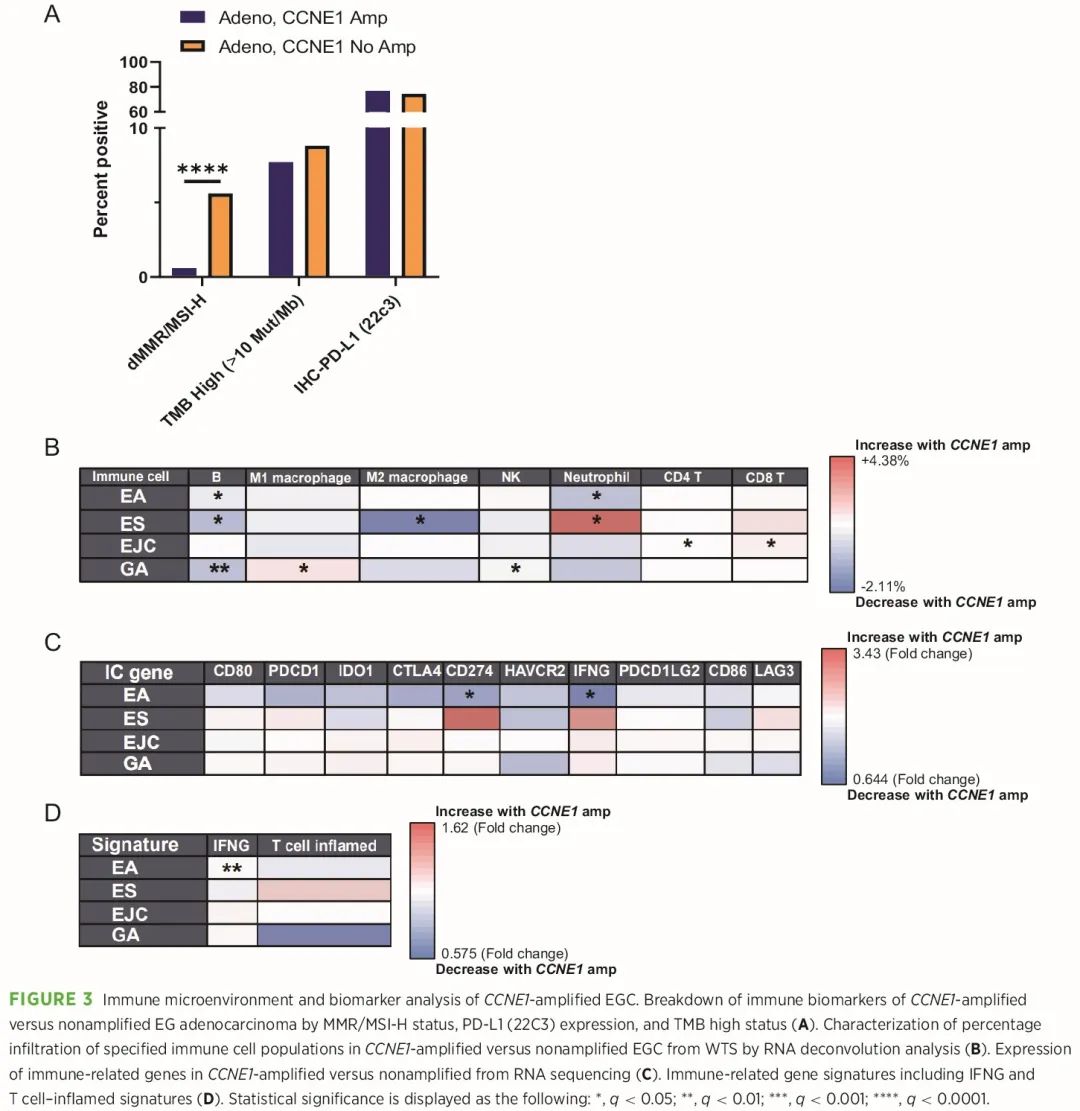
图3
接下来,我们利用全转录组测序 (WTS) 的 RNA 反卷积来表征 CCNE1 扩增肿瘤相比未扩增 EGC 的免疫微环境 (图 3B-D)。在 CCNE1 扩增的 EA 中,我们观察到 B 细胞和中性粒细胞显著较低 (图 3B)。类似地,我们发现 CCNE1 扩增的胃腺癌除了自然杀伤细胞外,B 细胞也减少,而 M1 巨噬细胞则较高。CCNE1 扩增与未扩增的 EA 或胃腺癌中 CD4+ 或 CD8+ T 细胞占比没有显著差异。对单个免疫相关基因的评估表明,CCNE1 扩增的 EA 中 IFNG 和 CD274 RNA 表达降低 (图 3C)。最后,我们分析了特定的免疫相关基因特征,发现 CCNE1 扩增的 EA 中 IFN 特征减少,以及 CCNE1 扩增的 EA 和胃腺癌中 T 细胞炎症特征呈减少趋势(图 3D)。
除了免疫微环境反卷积外,我们还对差异化表达基因进行了独创性通路分析。与 CCNE1 过表达在驱动细胞周期进展中的作用一致,我们观察到与细胞周期相关的通路的上调,包括动粒中期信号传导和 G1-S 检查点调节。CCNE1 扩增的胃腺癌和 EA 中最强烈的高占比通路之一是肝脏 X 受体/类视黄酸 X 受体激活,这与肿瘤生长、转移的调节和肿瘤先天免疫抑制的限制有关。总之,这些数据表明 CCNE1 扩增的 EG 腺癌具有独特的免疫和转录图谱。
CCNE1扩增EGC的治疗结果和CODEai生存分析
利用我们的真实世界证据 (RWE) 数据库分析治疗史和生存结局,比较 CCNE1 扩增和非扩增肿瘤患者。与非 CCNE1 扩增 EA 患者相比,CCNE1 扩增 EA 患者的 OS(定义为从组织采集到最后一次联系的时间)较长 [HR = 0.756,95% 置信区间 (CI):0.605–0.945,P = 0.014];在 EJC 患者中也观察到了类似的结果。虽然 CCNE1 扩增胃腺癌患者的 OS 没有差异(图 4A),但有趣的是,我们观察到特定疗法后的生存结局存在差异。奥沙利铂治疗后生存期没有差异(图 4B);而曲妥珠单抗治疗后,与非CCNE1扩增的胃腺癌患者相比,CCNE1扩增的胃腺癌患者生存期有较短的趋势(HR = 1.694,95% CI:0.873-3.289,P = 0.115;图 4C)。当将分析限制于 IHC(HR = 2.694,95% CI:1.146-6.336,P = 0.018)或 NGS(HR = 3.641,95% CI:1.442-9.194,P = 0.004)检测结果为 HER2 阳性的患者时,HER2+/CCNE1 扩增胃腺癌患者曲妥珠单抗治疗后的生存期显著差于 HER2+/非 CCNE1 扩增胃腺癌患者(图 4D 和 E)。相比之下,CCNE1 扩增胃腺癌患者在接受 PD1 或 PD-L1 抑制剂免疫治疗后,生存期有改善趋势(HR = 0.541,95% CI:0.239–1.226,P = 0.134;图 4F)。曲妥珠单抗或免疫治疗的生存结局差异仅限于 CCNE1 扩增胃腺癌,没有发现 CCNE1 扩增 EA 或 EJC 中曲妥珠单抗或免疫治疗后有显著的生存差异,尽管 CCNE1 扩增 EJC 在免疫治疗后生存略有改善趋势。尽管这些分析受到具有生存数据的患者样本量小的限制,但这些数据提示,CCNE1 扩增可能与 HER2 靶向治疗或免疫治疗的临床结果有关,特别是在胃腺癌患者中。
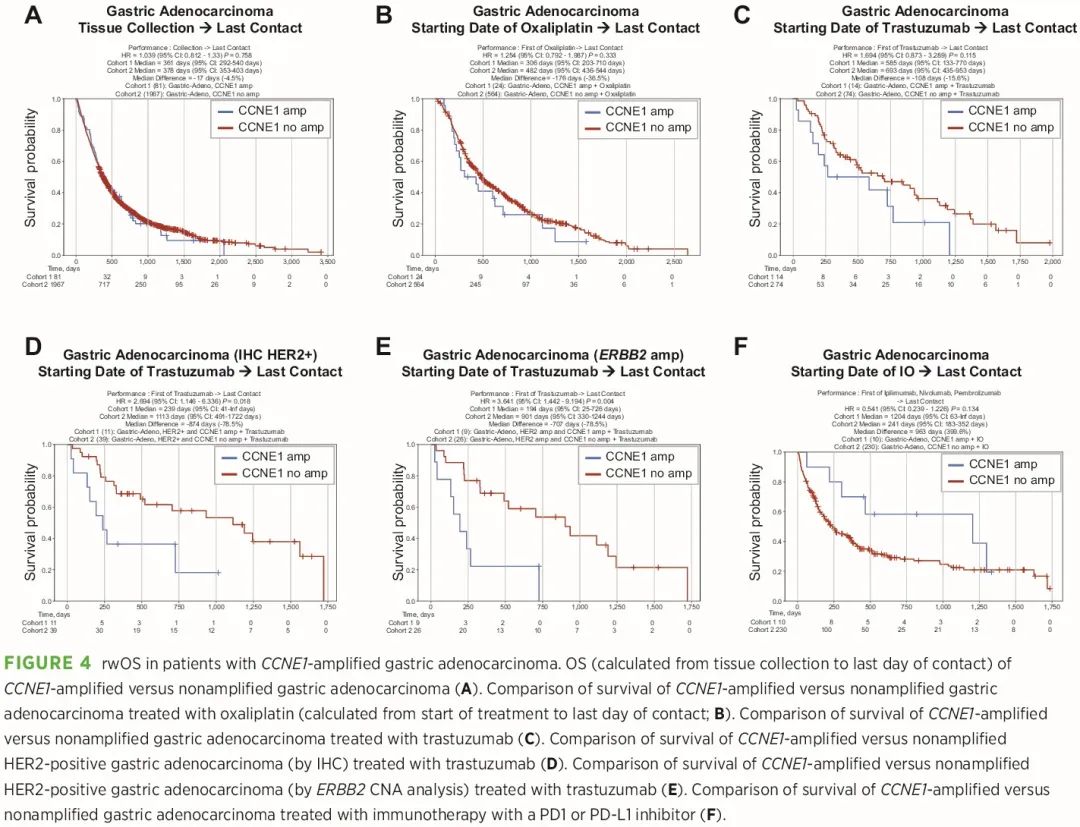
图4
讨 论
CCNE1 扩增是多种肿瘤类型中的常见改变,导致 G1-S 期检查点失调和基因组不稳定性,这是癌症的一个关键标志。虽然 CCNE1 扩增之前已在胃癌中发现,但其在真实世界环境中的临床相关性在很大程度上尚未得到表征。本研究利用全面的分子检测来确定 CCNE1 扩增胃癌的发生率和分子特征,以及对治疗结果的影响。
我们发现大约 7% 的 EA 和 4% 的胃腺癌存在 CCNE1 扩增。这一频率低于既往研究报道的 CCNE1 扩增存在于 10%–12% 的 EGC。一个差异可能是用于定义基因扩增的阈值,因为一些研究使用了 4 作为 CN 阈值,而本研究使用了 6 作为阈值。此外,研究人群的组织学组成会影响 CCNE1 扩增的总体频率,与弥漫型胃癌相比,肠型胃癌更可能存在该扩增。最后,组织部位可能会影响 CCNE1 扩增频率,我们观察到转移部位的 CCNE1 扩增频率高于原发性肿瘤。CCNE1 扩增与转移的相关性与其他提示 CCNE1 扩增胃癌患者更有可能出现肝转移的数据一致。人类转移瘤也已证实富含 CIN,而在临床前模型中,CIN 的基因抑制延迟了转移,提示 CIN 促进了转移进展。我们的数据支持 CCNE1 扩增是 EG 腺癌中常见的变异,可能与转移潜能增加有关的观点。
我们评估了 CCNE1 扩增的常见共突变,观察到频繁的 TP53 突变以及较少的 CDH1 突变。此外,CCNE1 扩增的肿瘤往往具有更多的 CNA,包括之前描述的 HER2 过表达/ERBB2 扩增的富集。这些数据与 CCNE1 扩增是 CIN 的关键驱动因素及其与 CIN 型胃癌的关联相一致。
重要的是,我们发现 CCNE1 扩增可能与胃癌的治疗相关。先前的研究表明,CCNE1 扩增是某些肿瘤类型的潜在预后因素。例如,在三阴性乳腺癌和卵巢癌患者中,CCNE1 扩增与较差的生存有关。在一小部分进行胃癌切除术的患者中,CCNE1 过表达与较差的无病生存率相关。此外,CCNE1 表达被认为是一种预测性生物标志物。在接受 CDK4/6 抑制剂哌柏西利治疗的转移性激素受体阳性、HER2 阴性乳腺癌患者中,高 CCNE1 RNA 表达与较短的无进展生存期相关。在乳腺癌和胃癌中,CCNE1 扩增还与对曲妥珠单抗的治疗耐药性有关。此外,在一项化疗加 HER2 抑制剂拉帕替尼用于胃癌的 II 期试验中,无反应者 CCNE1 扩增的发生率较高。利用保险理赔数据,我们发现 CCNE1 扩增与胃癌的 OS 无关。然而,HER2 阳性胃癌患者在接受曲妥珠单抗治疗后,同时伴有 CCNE1 扩增的患者预后比未同时伴有 CCNE1 扩增的患者差。这提示 CCNE1 扩增是一种预测性生物标志物,并进一步表明 CCNE1 扩增可能是降低疗效或促进对靶向疗法耐药的机制之一。最近的研究表明,CCNE1 扩增可能预测对 Wee1 激酶抑制剂 adavosertib 的敏感性。在体外,调节 HER2 阳性癌细胞系中的 CCNE1 表达可调节对 HER2 靶向抗体-药物偶联物德曲妥珠单抗 (T-DXd) 的敏感性,在体内,HER2 表达患者来源异种移植模型中,adavosertib 与 T-DXd 协同作用。
我们观察到,CCNE1 扩增的胃癌相比未扩增的胃腺癌,曲妥珠单抗治疗后的生存较差,但令人惊讶的是,我们注意到开始免疫治疗后,生存有改善的趋势。除了促进基因组不稳定性外,CCNE1 扩增还可能调节肿瘤免疫微环境。一方面,CIN 可以刺激炎症通路,例如通过产生微核和胞浆 DNA 导致 cGAS-STING 激活。然而,CIN,尤其是非整倍体,也可以促进免疫逃逸。TCGA CIN 型 EG 腺癌分析表明,CD8+ T 细胞浸润减少的免疫冷肿瘤富含 CCNE1 扩增,提示 CCNE1 扩增也可能促进胃癌的免疫耐药。值得注意的是,TCGA 样本大多为原发性肿瘤,而我们数据集中的样本主要为可能具有不同肿瘤免疫微环境的转移性肿瘤。有趣的是,从转录组分析中我们没有观察到 CCNE1 扩增胃癌中 T 细胞丰度的差异。然而,其他免疫细胞群有改变,包括 CCNE1 扩增肿瘤中 B 细胞和中性粒细胞减少,以及 CCNE1 扩增胃腺癌中 M1 巨噬细胞增加。我们还观察到 CCNE1 扩增肿瘤中 T 细胞炎症评分和 IFN 特征降低。虽然这些分析受到从bulk RNA 测序中提取的限制,但它们提示 CCNE1 扩增的 EGC 可能具有独特的肿瘤免疫微环境,应该进行探索。未来的研究,如单细胞 RNA 测序、空间转录组学或定量免疫荧光,可能会进一步确定 CCNE1 扩增胃癌中的免疫细胞组成和定位,以及独特的肿瘤微环境如何影响对治疗的反应。
尽管我们的数据集规模大且具有临床相关性,但我们承认本研究存在一些局限性。该患者群体存在较高的遗传和分子异质性,其中 EG 腺癌的 TCGA 亚型已得到充分研究(RRID:SCR_003193)。虽然 CCNE1 扩增肿瘤富含与 CIN 相关的变异(例如 TP53 和 ERBB2),但 CODEai 数据库中的分子数据是汇总的,因此我们无法基于单个样本分配 TCGA 亚型和评估与 CCNE1 扩增的关系。接受免疫疗法的 CCNE1 扩增肿瘤数量有限,因为 CCNE1 扩增肿瘤仅占样本的 4%-7%,并且并非所有样本都具有关联保险理赔数据用于真实世界生存分析。此外,最近根据 KEYNOTE-811,批准了化疗联合曲妥珠单抗和帕博利珠单抗,一些历史样本可能是在免疫疗法未获批时获得的,获批前,CCNE1 和 ERBB2 共扩增患者可能仅接受了曲妥珠单抗治疗。随着越来越多的转移性胃癌患者在一线环境中接受免疫疗法联合化疗(HER2+ 肿瘤接受曲妥珠单抗治疗),了解较大群体中 CCNE1 扩增是否会影响对治疗的反应,以及识别可能调节 CCNE1 表达影响的其他共突变将非常重要。我们需要前瞻性数据来评估在 CCNE1 和 ERBB2 共扩增的情况下是否应调整治疗范式。
总之,本研究表明,在胃癌中,CCNE1 扩增与独特分子特征有关,并可能影响对治疗的反应,包括靶向治疗和/或免疫治疗。虽然 CCNE1 还不能被直接抑制,但有研究正在探索几种药物通过合成致死策略靶向 CCNE1 扩增。目前,Wee1 抑制剂在临床上的应用受到限制,部分原因是毒性,有试验正在评估 PKMYT1 抑制剂(如 RP-6306)和 CDK2 抑制剂用于 CCNE1 扩增癌症。有必要进一步研究 CCNE1 扩增作为预测性生物标志物。
参考文献:
Rustgi N, Wu S, Samec T, Walker P, Xiu J, Lou E, Goel S, Saeed A, Moy RH. Molecular Landscape and Clinical Implication of CCNE1-amplified Esophagogastric Cancer. Cancer Res Commun. 2024 Jun 3;4(6):1399-1409. doi: 10.1158/2767-9764.CRC-23-0496. PMID: 38717153; PMCID: PMC11146286.



