方案与建议|胶质瘤化疗中国专家共识
时间:2024-11-08 06:02:33 热度:37.1℃ 作者:网络
摘 要 胶质瘤是最常见的颅内原发性恶性肿瘤。目前,治疗以手术切除为主,辅以放疗和化疗。临床实践证明,胶质瘤化疗极具意义,已被广泛应用于新诊断的胶质瘤术后辅助治疗和复发胶质瘤的挽救治疗。为进一步规范胶质瘤的化疗过程,提高治疗效果,中国抗癌协会神经肿瘤专业委员会组织相关专家,编写了《胶质瘤化疗中国专家共识》(以下简称《共识》),为广大同仁提供临床实际操作参考。《共识》从胶质瘤化疗相关的病理知识、化疗过程中患者管理、影像学评价、不同级别胶质瘤、新诊断或复发患者、如何结合其他治疗策略等角度对化疗方案进行了介绍。
关键词
胶质瘤;高级别胶质瘤;化疗策略;化疗方案;专家共识
胶质瘤是中枢神经系统最常见的原发性肿瘤,占颅内原发肿瘤的40%以上。目前,以手术切除为主,辅以放疗和化疗,已成为绝大多数实体瘤的标准治疗模式。神经系统肿瘤因肿瘤发生来源、血脑屏障(blood-brain barrier,BBB)等特殊性,对化疗药物的研发设计、临床选择、给药途径、评价方法等,均具有其特殊性。胶质瘤的化疗最早开始于20世纪70年代末期,以能透过BBB的亚硝基脲类单药等细胞毒化疗药物组成的联合方案仍有应用[1]。研究[2-3]显示,化疗对进一步杀灭残存肿瘤细胞起到非常重要的作用,可以显著延长胶质瘤患者的生存期。然而,胶质瘤的化疗效果还有很大提高空间,推荐以分子特征为依据的个体化化疗,联合分子靶向药物或其他新药,进一步提高胶质瘤化疗疗效。《胶质瘤化疗中国专家共识》(以下简称《共识》)参考了国内外的临床研究进展,结合国情和国内需求,从胶质瘤化疗相关的病理知识、化疗过程中患者管理、影像学评价、不同级别胶质瘤、新诊断或复发患者、如何结合其他治疗策略等角度对化疗方案进行了介绍,重点阐述各类型胶质瘤的化疗方案,为广大同仁提供临床实际操作参考。
1 制定方法学
1.1 《共识》发起机构与专家组成员 《共识》由中国抗癌协会神经肿瘤专业委员会牵头,成立《共识》编写小组(名单见正文后)。中山大学肿瘤防治中心陈忠平教授担任编写组长,14名胶质瘤化疗一线专家进行《共识》的执笔撰写,并有11名资深专家进行《共识》审稿修订。
1.2 《共识》制定过程 本《共识》的制定采用共识会议法,进行2次面对面共识会议,分别于2022年9月召开《共识》启动会、2023年4月召开《共识》审稿会。《共识》启动会前,由编写组长陈忠平教授牵头,各专家根据我国临床研究过程中的关键方法学问题,进行胶质瘤的临床诊疗指南、共识、综述类文献及高质量临床研究文章等证据检索与评价。在《共识》启动会上,专家们就目前胶质瘤化疗的临床问题、《共识》的初步框架、执笔撰写分工进行讨论。执笔专家根据《共识》启动会上决定的初步框架,按分工进行文献检索和《共识》撰写,由编写秘书负责汇总形成《共识》初稿。审稿专家对《共识》初稿进行审阅并提出修改意见,编写秘书汇总各审稿专家的修改意见。《共识》审稿会上,专家们对《共识》初稿及专家审稿意见进一步交流讨论,对推荐意见进行投票、确定推荐强度。最终,专家们就讨论结果进行修改完善,编写秘书汇总后再由编写小组全体通过定稿。本《共识》已在国际实践指南注册与透明化平台进行注册(注册号:PREPARE-2024CN881)。
续表1
表1 胶质瘤病理特征与化疗策略选择Tab.1 Pathological features of glioma and chemotherapy strategies selection

注:TMZ,替莫唑胺(Temozolomide);PCV,甲基苄肼、洛莫司汀、长春新碱联合化疗;BCNU,卡莫司汀(Carmustine);CCNU,洛莫司汀(Lomustine);VM-26,替尼泊苷(Teniposide);VP-16,依托泊苷(Etoposide);CBP,卡铂(Carboplatin);DDP,顺铂(Cisplatin);GBM,胶质母细胞瘤(glioblastoma);MGMT,O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase);HGG,高级别胶质瘤(high grade glioma);LGG,低级别胶质瘤(low grade glioma)BEV,贝伐珠单抗(Bevacizumab);BRAF, B-Raf原癌基因,丝氨酸/苏氨酸激酶(B-Raf proto-oncogene,serine/threnoine kinase);MEK,丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase);mTOR,雷帕霉素靶蛋白(mammalian target of rapamycin)。
1.3 《共识》使用者与应用目标人群 本《共识》使用者与应用目标人群包括但不限于各级医疗机构、医学院校和科研机构从事胶质瘤临床诊疗以及研究相关的医务人员、科研工作者和医学生。
1.4 证据分级与推荐意见强度 《共识》编写小组根据国内外证据及自身的临床研究经验,同时考虑我国胶质瘤临床化疗的真实情况及特点,采用2009牛津大学证据分级与推荐意见强度分级标准[4],拟定《共识》推荐。
2 胶质瘤病理特征与化疗策略选择
不同类型胶质瘤对应的病理特征,以及对应人群的化疗策略,见表1。
3 化疗过程中患者管理
3.1 症状的管理 胶质瘤患者在化疗过程中可能会发生癫痫、疲乏、疼痛、精神障碍等症状。癫痫建议根据患者情况使用非酶诱导的抗癫痫药物(如丙戊酸、加巴喷丁、拉莫三嗪或左乙拉西坦)治疗。有吞咽困难的终末期患者建议使用鼻饲咪达唑仑或氯硝西泮[5-7]。疲乏应鼓励非药物干预(如有氧训练),由药物引起继发性甲状腺功能减退而导致的疲乏,可以相应补充甲状腺激素(如左甲状腺素钠片)[5,8]。颅内压升高引起的头痛可以选择甘露醇、地塞米松等缓解,其他原因引起的头痛可以遵循世界卫生组织(World Health Organization,WHO)的“三阶梯止痛”原则给予镇痛药[5,9]。对于精神障碍患者,谨慎使用可能引起精神症状的药物(如类固醇、左乙拉西坦)[5]。
续表1
3.2 不良反应的管理 胶质瘤患者在化疗过程中可能有恶心、呕吐、骨髓抑制、肝脏毒性、肾脏毒性和膀胱毒性等不良反应。恶心和呕吐等一般选用地塞米松、5-羟色胺3(5-HT3)受体拮抗剂(如帕洛诺司琼、昂丹司琼、格拉司琼等)、神经激肽受体拮抗剂(如阿瑞匹坦、福沙匹坦)、甲氧氯普胺、奥氮平等药物治疗[10-11]。防治化疗引起的中性粒细胞减少症可选用粒细胞集落刺激因子,长效粒细胞集落刺激因子在每个化疗周期结束后48 h注射1次,不能在化疗药物前14 d至化疗后24 h内注射[12]。常用的护肝药物有:必需磷脂、葡醛内酯、甘草酸苷、还原型谷胱甘肽等。用肾毒性化疗药物[如顺铂(Cisplatin,DDP)、甲氨蝶呤、环磷酰胺(Cyclophosphamide,CTX)、异环磷酰胺(Ifosfamide,IFO)等]时,应避免合用其他有肾毒性的药物,如氨基糖苷类抗生素、头孢菌素类等。可通过充分水化和利尿来减轻药物的毒性。
3.3 合并症的管理 胶质瘤常见合并症有脑水肿、颅内压增高、血栓和感染等。治疗脑水肿最常用的药物有皮质类固醇激素(如地塞米松),但因其显著的不良反应不能长期使用。可选择甘露醇、甘油果糖、醋酸皮质酮等,但不排除也有毒副作用[6-7,13]。颅内压增高的治疗策略包括病因治疗(切除肿瘤)、镇静、控制血压、脱水利尿、糖皮质激素、低温等[14-15]。血栓的治疗药物有类固醇激素、血管内皮生长因子(vascular endothelial growth factor,VEGF)抑制剂[如贝伐珠单抗(Bevacizumab,BEV)]、DDP、沙利度胺类似物等。脑肿瘤患者静脉血管栓塞的治疗需要考虑可能导致颅内出血的风险而予以权衡,首选低分子肝素(达肝素、依诺肝素、亭扎肝素)、口服抗凝剂(利伐沙班、阿哌沙班、依度沙班),普通肝素通常用于高危、有症状的肺栓塞或肾功能不全患者[16-17]。感染最常见的预防方案是甲氧苄啶磺胺甲𫫇唑,如果对该药过敏,可以使用二线药物,如氨苯砜、喷他脒、阿托伐醌等。口咽念珠菌病建议使用克霉唑、咪康唑或制霉菌素进行7~14 d的局部治疗[6-7,18]。
4 化疗影像学评价
影像检查贯穿在胶质瘤诊断和治疗后随访的全过程。化疗影像评估内容主要包括治疗反应和治疗相关不良反应或继发改变。磁共振成像是首选和最常使用的影像评估手段。同一胶质瘤患者建议在同一机器、同一参数下扫描,尤其是每次扫描定位时的切面角度要尽量保持一致。神经肿瘤学反应评估(Response Assessment in Neuro-Oncology,RANO)2.0标准[19]是目前胶质瘤治疗的主要评估标准,评估结果分为4种(完全缓解、部分缓解、疾病稳定、疾病进展),见表2。化疗药物主要损伤脑白质,在长时间使用某些化疗药物后,两侧额顶叶深部脑白质可出现对称性T2高信号灶,一般没有强化。
表2 胶质瘤RANO 2.0标准Tab.2 RANO 2.0 criteria for glioma
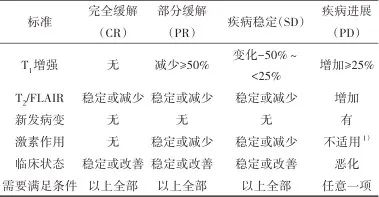
1)在出现持续的临床症状恶化时,即为疾病进展,但不能单纯地将激素用量增加作为疾病进展的依据。
5 高级别胶质瘤化疗
5.1 MGMT基因启动子甲基化阳性胶质瘤化疗 胶质母细胞瘤(glioblastoma,GBM),年龄≤70岁,O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)甲基化阳性患者根据卡氏评分(Karnofsky performance status,KPS)的不同治疗方案见图1,对KPS≥60 和KPS<60的患者各提供两种治疗方案参考。
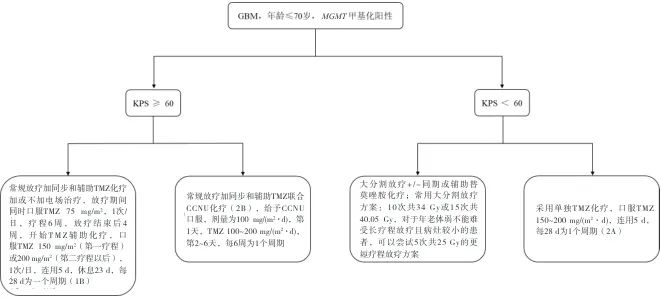
图1 GBM,年龄≤70岁,MGMT甲基化阳性患者治疗方案Fig.1 Treatment regimen for GBM patients aged 70 years or less with positive MGMT methylation
少突胶质细胞瘤,异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变,1p/19q杂合性缺失,WHO 3级患者根据KPS评分的不同治疗方案见图2。对KPS≥60 的患者提供3种治疗方案参考,对KPS<60的患者提供两种治疗方案参考。
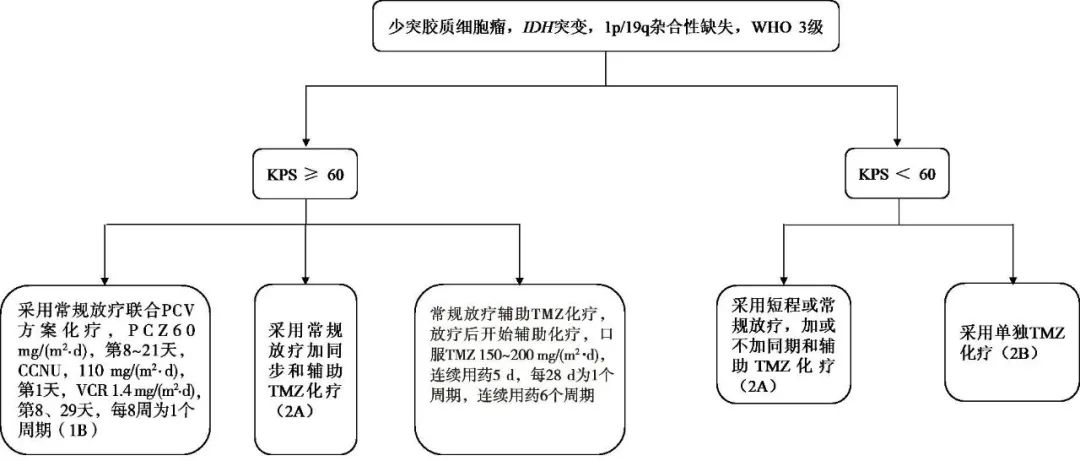
图2 少突胶质细胞瘤,IDH突变,1p/19q杂合性缺失,WHO 3级患者治疗方案Fig.2 Treatment regimen for oligodendroglioma,IDH mutation,loss of 1p/19q heterozygosity,WHO Grade 3 patients
星形细胞瘤,IDH突变,WHO 3级/4级患者根据KPS评分的不同治疗方案见图3。对KPS≥60 和KPS<60的患者各提供两种治疗方案参考。
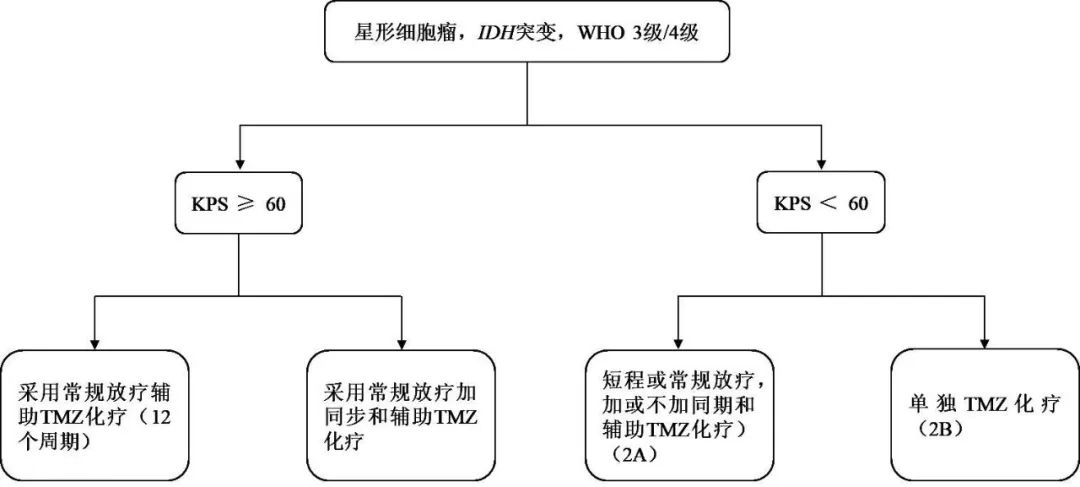
图3 星形细胞瘤,IDH突变,WHO 3级/4级患者治疗方案Fig.3 Treatment regimen for Astrocytoma,IDH mutation,WHO Grade 3/4
5.2 MGMT基因启动子甲基化阴性胶质瘤化疗 如何提高MGMT甲基化阴性患者的疗效,是胶质瘤治疗的一个关键问题。临床研究显示,替莫唑胺(Temozolomide,TMZ)剂量密集方案会消耗MGMT活性,可考虑在复发时进行二线化疗[20-22]。DDP和TMZ的协同作用能抑制MGMT的转录,从而下调MGMT表达,在DDP给药24 h后再服用TMZ有助于克服MGMT引起的耐药,但DDP对肿瘤细胞的毒性作用与MGMT无关[23-25]。
临床研究提示TMZ联合干扰素α(interferon-α,IFN-α)治疗可能逆转MGMT介导的耐药,增加TMZ的敏感性,从而使MGMT甲基化阴性患者的疗效接近MGMT甲基化阳性患者[15,26-29]。(1B)
去水卫矛醇(dianhydrogalactitol,DAG)是一种己糖醇衍生物,分子量为146.14 g/mol。注射用去水卫矛醇具体用药方案为剂量30 mg/(m2·d),给药途径为静脉给药,给药时间为第1~3天,每3周为1个周期。其主要作用机制是现有或衍生的环氧基团使DNA链交联,从而实现双官能团的N7 DNA烷化,具有不受MGMT影响、对胶质瘤细胞增殖有较高抑制率,BBB通过率较高等优点[30]。(2B)
有研究报道,对MGMT 蛋白表达阳性胶质瘤采用非甲基化类药物化疗效果明显优于TMZ和亚硝脲类甲基化类药物[31],其中替尼泊苷(Teniposide,VM-26)和DDP联合化疗在初治和复发胶质瘤都显示良好效果[24,32],可以参考。(2B)
6 成人低级别胶质瘤的化疗
成人低级别胶质瘤(low grade glioma,LGG)是好发于中青年幕上的WHO 2级胶质瘤。对于KPS>60分、具有高危因素(未达到完全切除或年龄>40岁)的LGG患者,PCV方案辅助化疗能够取得显著的生存获益。(1A)
患者在完成手术及54 Gy的放射治疗后,随后接受6疗程的PCV辅助化疗:丙卡巴肼(Procarbazine,PCZ)60 mg/(m2·d),第8~21天,洛莫司汀(Lomustine,CCNU)110 mg/(m2·d),第1天,长春新碱(Vincristine,VCR)1.4 mg/(m2·d)(最大剂量2.0 mg/(m2·d),第8、29天,8周为1个周期。(1B)在接受PCV辅助化疗后,WHO 2级胶质瘤患者的中位生存期由单纯放疗后的7.8年延长至13.3年,10年生存率则由单纯放疗后的41%提升至62%[33-34]。
进一步的分析表明,IDH突变型LGG较IDH野生型获益更为明显;少突胶质细胞瘤对PCV方案最为敏感。(2A)对于复发性LGG,若既往未行放疗,可以考虑在放射治疗后辅以PCV或TMZ方案化疗,或者行同期放化疗后辅助TMZ化疗。对于既往已行放疗患者,可行PCV、TMZ、卡莫司汀(Carmustine,BCNU)或CCNU化疗。(2A)
目前证据表明,BRAF抑制剂单用或与丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase,MEK)抑制剂联用能够使具有BRAF突变的LGG患者受益[35-36]。对于室管膜下巨细胞星形细胞瘤,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂能够抑制肿瘤生长[37]。(2A)
7 儿童胶质瘤化疗
卡铂(Carboplatin,CBP)联合VCR是治疗儿童LGG最常用的化疗方案[38-39]。对于MAPK通路异常激活的患者,可以考虑应用BRAF抑制剂(如达拉非尼,威罗菲尼)和(或)MEK抑制剂(司美替尼,曲美替尼),但停药后2~4个月易出现肿瘤进展[40-44]。(1A)mTOR的选择性抑制剂(依维莫司)对复发进展的儿童LGG也具有一定疗效[45]。(2B)对于脑干部位的弥漫中线胶质瘤,标准治疗方式仍然为放疗(54~59 Gy)[46-48]。(1A)传统细胞毒类药物无生存获益[49-51]。(2A)
对于儿童双侧丘脑胶质瘤,因具有高频的表皮生长因子受体(epidermal growth factor receptor,EGFR)第20号外显子插入突变,EGFR抑制剂可能有效,但仍需要更大规模的临床试验来证实[52]。(2B)
对于儿童幕上高级别胶质瘤(high grade glioma,HGG),年龄是影响辅助治疗选择的重要因素之一。对于年龄<3岁的患儿,因婴幼儿患者可能对化疗更敏感,应尽量推迟放疗,包括但不限于首选VCR、CTX、铂类及TMZ等化疗药物作为辅助治疗[53-55]。(1A)对于≥3岁的患儿,可以考虑接受单纯放疗或TMZ同步放化疗,TMZ联合CCNU可作为辅助治疗,MGMT基因启动子甲基化患者更有可能从此方案中获益[56]。
对于BRAF V600E突变阳性的儿童HGG患者,可选用BRAF/MAPK相关通路的抑制剂(如达拉非尼、维莫非尼、曲美替尼)治疗[57-58]。(2A)具备NTRK融合的患者,可以选用RTK抑制剂,如拉罗替尼、恩曲替尼等[59-60]。(2A)
8 老年胶质瘤化疗
将年龄>65岁患者定义为老年胶质瘤患者。在接受抗肿瘤治疗前,老年评估十分有必要,该评估包括各系统一般状况、认知能力、合并症、虚弱指数、日常生活能力、生活质量、营养状态、实验室检查指标等多个方面。
对于KPS≥60分与<60分的老年间变型星形细胞瘤和GBM患者应采用不同治疗手段,包括手术、放疗、TMZ化疗及肿瘤电场治疗[61]。(1A)
在年龄>70岁的GBM患者中,与为期6周的标准放疗方案相比,为期2周的大分割放疗方案或单一使用TMZ均能够使患者产生生存期的获益,同时研究也进一步证实了MGMT基因启动子甲基化状态对TMZ使用起到指导作用。(1A)
9 复发胶质瘤化疗
目前复发胶质瘤尚无标准挽救化疗方案,TMZ单药、伊立替康(Irinotecan,CPT-11)单药或联合BEV、BEV单用或联合化疗、PCZ、结合亚硝脲类方案如PCV方案、铂类为基础的方案均可用于挽救化疗方案。
采用TMZ剂量密集给药方案(剂量密集或剂量强化),例如TMZ每周交替[TMZ 150 mg/(m2·d),第1~7天和第15~21天,每28 d为1个周期]、TMZ连续21d[TMZ 75 mg/(m2·d) ,第1~21天,每28 d为1个周期]、低剂量持续TMZ[40~50 mg/(m2·d)]化疗方案等,TMZ的剂量强度是标准5 d方案的1.5~2.0倍,TMZ和细胞DNA作用形成的O6-甲基鸟嘌呤被MGMT修复,从而耗竭MGMT起到一定的自身克服耐药的作用。(2A)
在TMZ同期放疗及辅助化疗未成为一线标准化疗方案之前,亚硝基脲类[BCNU、CCNU、司莫司汀(Semustine,Me-CCNU)、尼莫司汀(Nimustine,ACNU)、福莫司汀等]单药或联合方案如PCV方案常用于恶性胶质瘤的一线化疗,在复发胶质瘤中也有应用,但其毒性不容忽视。CPT-11联合其他化疗药物或分子靶向药物在复发胶质瘤中显示有一定疗效。
以铂类为基础的方案包括DDP和CBP在复发间变性星形细胞瘤和GBM中显示有一定疗效,常联合依托泊苷(Etoposide,VP-16)或VM-26化疗[62],但需注意CBP导致的严重骨髓抑制、DDP导致的胃肠道毒性和肾毒性。(2B)
10 化疗联合放疗
若患者年龄>40岁和(或)未达肿瘤全切,少突胶质细胞瘤2级,1p/19q杂合性缺失,IDH突变型患者,推荐术后行放疗及辅助PCV化疗。(1A)对于难以耐受PCV化疗的老年患者,可以选择放疗联合辅助TMZ化疗(2A)或者TMZ化疗(2B)。对于IDH突变型星形细胞瘤WHO 2级,推荐参与临床试验、放疗+辅助TMZ化疗或者放疗+辅助PCV方案化疗。(1A)对于首程治疗没有接受放疗的复发LGG患者,术后优先推荐放疗联合化疗,联合方案包括放疗+辅助PCV化疗、放疗+辅助TMZ化疗和放疗+同期和辅助TMZ化疗。(1A)患者KPS评分很低或者不愿意接受化疗,可尝试单纯放疗。
对于KPS良好(KPS≥60)的少突胶质细胞瘤,WHO 3级,首选放疗后辅助PCV化疗[63]。(1A)对于难以耐受PCV方案的患者,可采用放疗后辅助TMZ化疗伴或者不伴同步TMZ化疗[64]。对于IDH突变型星形细胞瘤,WHO 3级或4级且KPS良好的患者,推荐放疗伴或不伴同步TMZ化疗,随后进行12个疗程TMZ辅助化疗;对于KPS评分<60的患者,可以采用大分割放疗或者常规放疗伴或者不伴同步或者辅助TMZ化疗;也可以采用单纯TMZ化疗或姑息治疗。(2B)
对于年龄≤70岁且KPS良好的GBM患者,无论MGMT基因启动子甲基化状态如何,建议采用放疗加同步和辅助TMZ化疗,伴肿瘤电场治疗(1A),以及采用放疗加同步和辅助TMZ化疗(1A);也可以采用放疗加同步和辅助TMZ联合CCNU化疗(2B)。对于MGMT基因启动子甲基化阴性的老年性新诊断GBM,可以采用单纯放疗,不联合化疗。
对于年龄>70岁、具有良好KPS和MGMT基因启动子甲基化的新诊断患者,采用大分割放疗加同步和辅助TMZ化疗或标准放疗加同步和辅助TMZ化疗以及肿瘤电场治疗(1A)[65];也可以采用单纯大分割放疗(2B)。
对于年龄>70岁、具有良好KPS和MGMT基因启动子甲基化阴性或不确定的新诊断患者,首选大分割放疗同步和辅助TMZ化疗[63];也可以采用标准放疗加同步和辅助TMZ和肿瘤电场治疗[66]。(1A)如果KPS差,推荐采用单一治疗模式:如对于MGMT基因启动子甲基化患者,可采用单纯大分割放疗或单纯TMZ化疗或最佳支持治疗。对于部分复发性患者,再程放疗也是治疗选项之一。(2B)
11 化疗结合靶向治疗
靶向治疗能对肿瘤实现精准治疗,从而降低肿瘤进展风险。化疗结合靶向治疗显示出一定的疗效,BEV联合其他化疗药物如CCNU、CPT-11、TMZ可部分延长复发胶质瘤母细胞的总生存期[27,67-68]。(2A)
BEV推荐剂量为5 mg/kg或10 mg/kg,上述两种治疗剂量产生的疗效类似,每2周静脉注射1次直至疾病进展。BEV的给药方式是输液给药,第一次给药大约需要90 min,以后每次给药需要30~60 min。BEV常见并发症有高血压、疲乏或乏力、腹泻和腹痛等,当出现严重的不良反应时应停止使用BEV。高血压和蛋白尿的发生可能具有剂量依赖性。
瑞戈非尼是一种口服的多激酶抑制剂,靶点包括VEGR、PDGFR、FGFR等基因。安罗替尼是一个多靶点的抗血管生成药物,可以全面覆盖GBM中血管生成相关靶点。阿帕替尼作为抗血管的小分子TKI类药物,对多种肿瘤均可产生治疗效果。(2A)
12 化疗联合免疫治疗
肿瘤免疫治疗具有特异高效、使机体免于伤害性治疗等优点。程序性细胞死亡蛋白/配体1(programmed cell death protein 1/programmed cell death protein-ligand 1,PD-1/PD-L1)是肿瘤细胞逃离机体免疫杀伤的重要免疫抑制靶点。临床使用的免疫检查点抑制剂PD-1/PD-L1抗体包括帕博利珠单抗、纳武单抗等,目前已有多项针对GBM的临床试验在进行中[69-72]。细胞免疫治疗包括过继免疫细胞治疗、肽疫苗、树突状细胞免疫治疗等。
Rindopepimut(CDX-110)是一种针对EGFR缺失突变EGFRvIII的疫苗,过继免疫细胞治疗静脉给药临床Ⅲ期研究结果显示,在标准TMZ化疗中添加Rindopepimut未能提高EGFRvIII阳性新诊断GBM患者的生存期[73]。(2B)
RANO提供的免疫疗法指导意见是,在免疫治疗的前6个月内,如果患者出现影像学进展,但临床症状稳定,则可以继续进行治疗,并在接下来的3个月内进行密切观察。
13 室管膜瘤和间变型室管膜瘤的化疗
手术全切除肿瘤是室管膜瘤的首选治疗方法。对于儿童或成人新诊断的室管膜瘤,无同质性随机对照试验研究证实化疗联合放疗与单纯放疗相比,对生存率有改善。但对于复发进展患者,化疗可作为挽救治疗。(2A)WHO 3级室管膜瘤患者,在手术及放疗后,可以考虑进行化疗[61,74-75]。(2A)年幼不宜行放疗的室管膜瘤患者,可术后行辅助化疗[61]。无化疗史的成人室管膜瘤复发患者,可选择的化疗方案包括基于铂类的方案(DDP或CBP)、鬼臼毒素类药物、基于亚硝脲的方案(CCNU或BCNU)和TMZ等。(2A)
14 脑室/蛛网膜下腔播散的化疗
对于复发播散的GBM患者,除少数可手术干预外,绝大多数只能考虑采用放化疗。若病灶在第1次放射野以外可考虑再次放疗,但放疗剂量和范围往往受到众多因素限制。
近来已经研究了多种化疗方案有可能可以使用:TMZ单独或与BCNU联合或CCNU、塞替派单用或联合PCZ、甲氨喋呤、阿糖胞苷、拓扑替康、CPT-11、铂类联合或不联合鬼臼毒素类药物等都有专家进行尝试。(2B)
可以尝试使用口服、静脉、鞘内注射或Ommaya囊内注射化疗药物等给药途径,但需要注意目前只有少数药物可通过鞘内注射或Ommaya囊脑室内注射的途径进行给药,如甲氨蝶呤、阿糖胞苷、拓扑替康等。(2B)
可尝试将广谱抗血管生成药与细胞毒药物联合应用于复发播散GBM,如抗血管生成药物(例如BEV)或与细胞毒性药物(例如CPT-11)联合使用。(2B)同步放化疗在特定的病例中也可考虑。
15 胶质瘤常用化疗方案
胶质瘤常用的化疗方案,包括药物、剂量、给药途径、给药时间和周期等,见表3。
表3 胶质瘤常用化疗方案Tab. 3 Common chemotherapy regimens for glioma
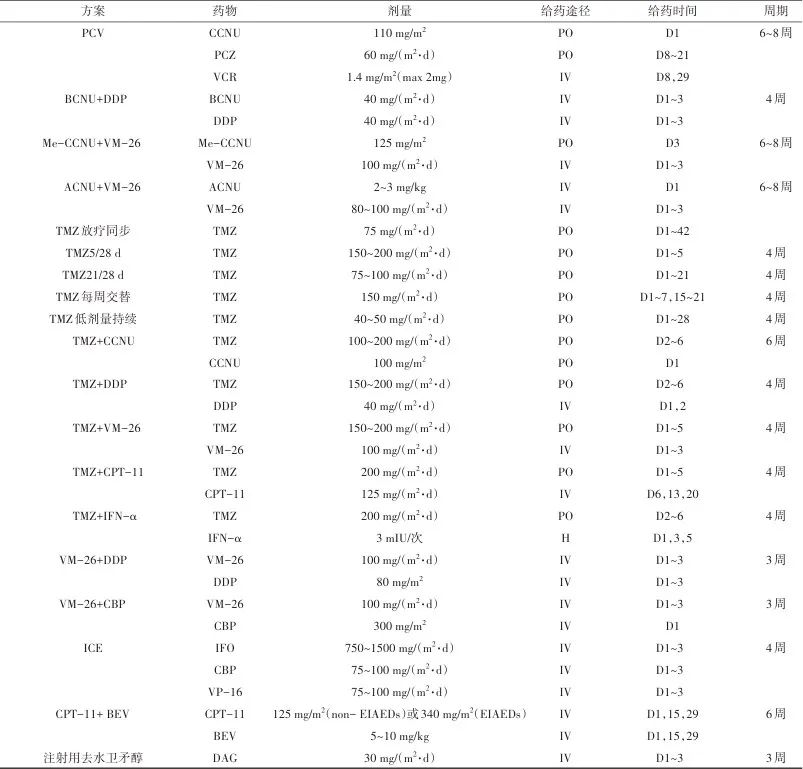
注:PO,口服给药;H,皮下注射;IV,静脉给药。EIAEDs,指酶诱导的抗癫痫(enzyme-inducing anti-epileptic drugs)。
参考文献:
1. SAI K,YANG Q Y,SHEN D,et al. Chemotherapy for gliomas in China: An overview[J]. Oncol Lett,2013,5(5):1448-1452.
2. FINE H A, DEAR K B, LOEFFLER J S, et al. Meta-analysis of radiation therapy with and without adjuvant chemotherapy for malignant gliomas in adults[J]. Cancer, 1993, 71(8): 2585-2597.
3. STEWART L A. Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomised trials[J]. Lancet, 2002, 359(9311): 1011-1018.
4. Centre for Evidence-Based Medicine (CEBM), University of Oxford. Oxford Centre for Evidence-Based Medicine: Levels of Evidence (March 2009) [EB/OL]. (2009-03) [2024-07-02]https://www.cebm.ox.ac.uk/resources/levels-of-evidence/oxford-centre-for-evidence-based-medicine-levels-of-evidence-march-2009.
5. KOEKKOEK J A F, van der MEER P B, PACE A, et al. Palliative care and end-of-life care in adults with malignant brain tumors[J]. Neuro Oncol, 2023, 25(3): 447-456.
6. YOUSSEF G, WEN PY. Medical and neurological management of brain tumor complications[J]. Curr Neurol Neurosci Rep, 2021,21(10): 53.
7. SCHIFF D, ALYAHYA M. Neurological and medical complications in brain tumor patients[J]. Curr Neurol Neurosci Rep, 2020, 20(8): 33.
8. FABI A, BHARGAVA R, FATIGONI S, et al. Cancer-related fatigue: ESMO clinical practice guidelines for diagnosis and treatment[J]. Ann Oncol, 2020, 31(6): 713-723.
9. DELA PENA J C,MARSHALL V D,SMITH M A. Impact of NCCN guideline adherence in adult cancer pain on length of stay[J]. J Pain Palliat Care Pharmacother, 2022, 36(2): 95-102.
10. RAZVI Y, CHAN S, MCFARLANE T, et al. ASCO, NCCN,MASCC/ESMO: a comparison of antiemetic guidelines for the treatment of chemotherapy-induced nausea and vomiting in adult patients[J]. Support Care Cancer, 2019, 27(1): 87-95.
11. BERGER M J, ETTINGER D S, ASTON J, et al. NCCN guidelines insights: Antiemesis, Version 2.2017[J]. J Natl Compr Canc Netw, 2017, 15(7): 883-893.
12. 中国临床肿瘤学会指南工作委员会.中国临床肿瘤学会(CSCO)肿瘤放化疗相关中性粒细胞减少症规范化管理指南(2021)[J]. 临床肿瘤学杂志, 2021, 26(7): 638-648.
13. ROTH P, REGLI L, TONDER M, et al. Tumor-associated edema in brain cancer patients: pathogenesis and management[J]. Expert Rev Anticancer Ther, 2013, 13(11): 1319-1325.
14. SUAREZ-MEADE P, MARENCO-HILLEMBRAND L,SHERMAN W J. Neuro-oncologic Emergencies[J]. Curr Oncol Rep, 2022, 24(8): 975-984.
15. TADEVOSYAN A, KORNBLUTH J. Brain herniation and intracranial hypertension[J]. Neurol Clin, 2021, 39(2): 293-318.
16. ELSHOURY A, SCHAEFER J K, LIM M Y, et al. Update on guidelines for the prevention of cancer-associated thrombosis[J]. J Natl Compr Canc Netw, 2022, 20(13).
17. DIAZ M, JO J. Venous thrombotic events and anticoagulation in brain tumor patients[J]. Curr Oncol Rep, 2022, 24(4): 493-500.
18. BADEN L R, SWAMINATHAN S, ANGARONE M, et al. Prevention and treatment of cancer-related infections, Version 2.2016,NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2016, 14(7): 882-913.
19. WEN P Y, van den BENT M, YOUSSEF G, et al. RANO 2.0: update to the response assessment in neuro-oncology criteria for high- and low-grade gliomas in adults[J]. J Clin Oncol, 2023, 41(33): 5187-5199.
20. BRANDES A A, TOSONI A, CAVALLO G, et al. Temozolomide 3 weeks on and 1 week off as first-line therapy for recurrent glioblastoma : phase II study from gruppo italiano cooperative di neuro-oncologia (GICNO)[J]. Br J Cancer, 2006, 95(9): 1155-1160.
21. WICK A, FELSBERG J, STEINBACH J P, et al. Efficacy and tolerability of temozolomide in an alternating weekly regimen in patients with recurrent glioma[J]. J Clin Oncol, 2007, 25(22): 3357-3361.
22. KONG D S, LEE J I, KIM J H,et al. Phase II trial of low-dose continuous (metronomic) treatment of temozolomide for recurrent glioblastoma[J]. Neuro Oncol, 2010, 12(3): 289-296.
23. HEGI M E, DISERENS A C, GORLIA T, et al. MGMT gene silencing and benefit from temozolomide in glioblastoma[J]. N Engl J Med, 2005, 352(10): 997-1003.
24. 李岩, 石蕊, 陈建新, 等.VM-26和DDP联合化疗对复发高级别脑胶质瘤的治疗体会[J]. 首都医科大学学报, 2015, 36(5): 786-790.
25. D'ATRI S, GRAZIANI G, LACAL P M, et al. Attenuation of O(6)-methylguanine-DNA methyltransferase activity and mRNA levels by cisplatin and temozolomide in jurkat cells[J]. J Pharmacol Exp Ther, 2000, 294(2): 664-671.
26. GUO C, YANG Q, XU P, et al. Adjuvant temozolomide chemotherapy with or without interferon alfa among patients with newly diagnosed high-grade gliomas: A randomized clinical trial[J]. JAMA Netw Open, 2023, 6(1): e2253285.
27. GILBERT M R, DIGNAM J J, ARMSTRONG T S,et al. A randomized trial of bevacizumab for newly diagnosed glioblastoma[J]. N Engl J Med, 2014, 370(8): 699-708.
28. DILLMAN R O, WIEMANN M, OLDHAM R K, et al. Interferon alpha-2a and external beam radiotherapy in the initial management of patients with glioma: a pilot study of the National Biotherapy Study Group[J]. Cancer Biother, 1995, 10(4): 265-271.
29. RAJKUMAR S V, BUCKNER J C, SCHOMBERG P J, et al. Phase I evaluation of radiation combined with recombinant interferon alpha-2a and BCNU for patients with high-grade glioma[J]. Int J Radiat Oncol Biol Phys, 1998, 40(2): 297-302.
30. GUO C, YANG Q,LI J, et al. Phase 2 clinical trial of VAL-083 as first-line treatment in newly-diagnosed MGMT-unmethylated glioblastoma multiforme (GBM): Halfway report[J]. Glioma, 2019, 2: 167-173.
31. 张俊平, 赛克, 魏大年, 等. MGMT阳性恶性脑胶质瘤病人的化疗(附51例体会)[J]. 中华神经外科杂志, 2007, 23(9): 672-674.
32. 张俊平, 陈建文, 牟永告, 等. VM-26和DDP联合化疗治疗恶性胶质瘤: 20例分析[J]. 中国神经肿瘤杂志, 2005, 3(1): 17-20.
33. BUCKNER J C, SHAW E G, PUGH S L, et al. Radiation plus Procarbazine, CCNU, and Vincristine in low-grade glioma[J]. N Engl J Med, 2016, 374(14): 1344-1355.
34. 郭鹏航, 谢东, 赵全堂, 等.低级别胶质瘤临床治疗进展[J]. 中国神经精神疾病杂志, 2024, 50(5): 310-314.
35. KALEY T, TOUAT M, SUBBIAH V, et al. BRAF inhibition in BRAFV600-mutant gliomas: Results from the VE-BASKET study[J]. J Clin Oncol, 2018, 36(35): 3477-3484.
36. WEN PY, STEIN A, VAN DEN BENT M, et al. Dabrafenib plus trametinib in patients with BRAFV600E-mutant low-grade and high-grade glioma (ROAR): a multicentre, open-label, single-arm, phase 2, basket trial[J]. Lancet Oncol, 2022, 23(1): 53-64.
37. FRANZ D N, BELOUSOVA E, SPARAGANA S, et al. Efficacy and safety of everolimus for subependymal giant cell astrocytomas associated with tuberous sclerosis complex (EXIST-1): a multicentre, randomised, placebo-controlled phase 3 trial[J]. Lancet, 2013, 381(9861): 125-132.
38. ATER J L, ZHOU T, HOLMES E, et al. Randomized study of two chemotherapy regimens for treatment of low-grade glioma in young children: a report from the Children's Oncology Group[J]. J Clin Oncol, 2012, 30(21): 2641-2647.
39. GNEKOW A K, WALKER D A, KANDELS D, et al. A European randomised controlled trial of the addition of etoposide to standard vincristine and carboplatin induction as part of an 18-month treatment programme for childhood (≤16 years) low grade glioma - A final report[J]. Eur J Cancer, 2017, 81: 206-225.
40. HARGRAVE D R, BOUFFET E, TABORI U, et al. Efficacy and safety of dabrafenib in pediatric patients with BRAF V600 mutation-positive relapsed or refractory low-grade glioma: results from a phase I/IIa study[J]. Clin Cancer Res, 2019, 25 (24):7303-7311.
41. NICOLAIDES T, NAZEMI K J, CRAWFORD J, et al. Phase I study of vemurafenib in children with recurrent or progressive BRAFV600E mutant brain tumors: pacific pediatric neuro-oncology consortium study (PNOC-002)[J]. Oncotarget, 2020, 11(21): 1942-1952.
42. FANGUSARO J, ONAR-THOMAS A, YOUNG POUSSAINT T, et al. Selumetinib in paediatric patients with BRAF-aberrant or neurofibromatosis type 1-associated recurrent,refractory,or progressive low-grade glioma: a multicentre, phase 2 trial[J]. Lancet Oncol, 2019, 20(7): 1011-1022.
43. SELT F, VAN TILBURG C M, BISON B, et al. Response to trametinib treatment in progressive pediatric low-grade glioma patients[J]. J Neurooncol, 2020, 149(3): 499-510.
44. MANOHARAN N, CHOI J, CHORDAS C, et al. Trametinib for the treatment of recurrent/progressive pediatric low-grade glioma[J]. J Neurooncol, 2020, 149(2): 253-262.
45. WRIGHT K D,YAO X, LONDON W B, et al. A POETIC Phase II study of continuous oral everolimus in recurrent, radiographically progressive pediatric low-grade glioma[J]. Pediatr Blood Cancer, 2021, 68(2): e28787.
46. COHEN K J, JABADO N, GRILL J. Diffuse intrinsic pontine gliomas-current management and new biologic insights. Is there a glimmer of hope? [J]. Neuro Oncol, 2017, 19(8): 1025-1034.
47. GAJJAR A, MAHAJAN A, ABDELBAKI M, et al. Pediatric central nervous system cancers, Version 2.2023, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2022, 20(12): 1339-1362.
48. 游鸿海, 俞挺, 陈人龙, 等. 儿童脑干pK27M突变型弥漫性中线胶质细胞瘤临床特点[J].中国神经精神疾病杂志, 2021, 47(5): 286-288.
49. FINLAY J L, ZACHAROULIS S. The treatment of high grade gliomas and diffuse intrinsic pontine tumors of childhood and adolescence: a historical - and futuristic - perspective[J]. J Neurooncol, 2005, 75(3): 253-266.
50. JENNINGS M T, SPOSTO R, BOYETT J M, et al. Preradiation chemotherapy in primary high-risk brainstem tumors: phase II study CCG-9941 of the Children's Cancer Group[J]. J Clin Oncol, 2002, 20(16): 3431-3437.
51. KORONES D N, FISHER P G, KRETSCHMAR C, et al. Treatment of children with diffuse intrinsic brain stem glioma with radiotherapy, vincristine and oral VP-16: a Children’s Oncology Group phase II study[J]. Pediatr Blood Cancer, 2008, 50(2):227-230.
52. MONDAL G, LEE J C, RAVINDRANATHAN A, et al. Pediatric bithalamic gliomas have a distinct epigenetic signature and frequent EGFR exon 20 insertions resulting in potential sensitivity to targeted kinase inhibition[J]. Acta Neuropathol, 2020, 139(6): 1071-1088.
53. COLEMAN C, STOLLER S, GROTZER M, et al. Pediatric hemispheric high-grade glioma: targeting the future[J]. Cancer Metastasis Rev, 2020, 39(1): 245-260.
54. DUFFNER P K,KRISCHER J P,BURGER P C,et al. Treatment of infants with malignant gliomas: the Pediatric Oncology Group experience[J]. J Neurooncol, 1996, 28(2-3): 245-256.
55. ESPINOZA J C, HALEY K, PATEL N, et al. Outcome of young children with high-grade glioma treated with irradiation-avoiding intensive chemotherapy regimens: Final report of the Head Start II and III trials[J]. Pediatr Blood Cancer, 2016, 63(10): 1806-1813.
56. JAKACKI R I, COHEN K J, BUXTON A, et al. Phase 2 study of concurrent radiotherapy and temozolomide followed by temozolomide and lomustine in the treatment of children with high-grade glioma: a report of the Children’s Oncology Group ACNS0423 study[J]. Neuro Oncol, 2016, 18(10): 1442-1450.
57. TOLL S A, TRAN H N, COTTER J, et al. Sustained response of three pediatric BRAF(V600E) mutated high-grade gliomas to combined BRAF and MEK inhibitor therapy[J]. Oncotarget, 2019, 10(4): 551-557.
58. HARGRAVE D R, MORENO L, BRONISCER A, et al. Dabrafenib in pediatric patients with BRAF V600–positive high-grade glioma (HGG) [J]. J Clin Oncol 2018, 36: 10505-10505.
59. DOZ F, van TILBURG CM, GEOERGER B, et al. Efficacy and safety of larotrectinib in TRK fusion-positive primary central nervous system tumors[J]. Neuro Oncol, 2022, 24(6): 997-1007.
60. DESAI A V, ROBINSON G W, GAUVAIN K, et al. Entrectinib in children and young adults with solid or primary CNS tumors harboring NTRK,ROS1,or ALK aberrations (STARTRK-NG)[J]. Neuro Oncol, 2022, 24(10): 1776-1789.
61. 刘岩红, 国家卫生健康委员会医政医管局.脑胶质瘤诊疗规范(2018年版)[J].中华神经外科杂志, 2019, 35(3): 23.
62. 李刚, 牟永告, 魏大年, 等.替尼泊苷与尼莫司汀联合治疗MGMT阴性表达的恶性胶质瘤: 附18例经验[J].中国神经肿瘤杂志, 2009, 7(1): 53-57.
63. CAIRNCROSS G, WANG M, SHAW E, et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402[J]. J Clin Oncol, 2013, 31(3): 337-343.
64. PANAGEAS K S, IWAMOTO F M, CLOUGHESY T F, et al. Initial treatment patterns over time for anaplastic oligodendroglial tumors[J]. Neuro Oncol, 2012, 14(6): 761-767.
65. PERRY J R, LAPERRIERE N, O'CALLAGHAN C J, et al. Short-course radiation plus temozolomide in elderly patients with glioblastoma[J]. N Engl J Med, 2017, 376(11): 1027-1037.
66. STUPP R, TAILLIBERT S, KANNER A, et al. Effect of tumor-treating fields plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma: a randomized clinical trial[J]. JAMA, 2017, 318(23): 2306-2316.
67. TAAL W, OOSTERKAMP H M, WALENKAMP A M, et al. Single-agent bevacizumab or lomustine versus a combination of bevacizumab plus lomustine in patients with recurrent glioblastoma (BELOB trial): a randomised controlled phase 2 trial[J]. Lancet Oncol, 2014, 15(9): 943-953.
68. FRIEDMAN H S, PRADOS M D, WEN P Y, et al. Bevacizumab alone and in combination with Irinotecan in recurrent glioblastoma[J]. J Clin Oncol, 2023, 41(32): 4945-4952.
69. REARDON D A, BRANDES A A, OMURO A, et al. Effect of nivolumab vs bevacizumab in patients with recurrent glioblastoma: the checkmate 143 phase 3 randomized clinical trial[J]. JAMA Oncol, 2020, 6(7): 1003-1010.
70. OMURO A, BRANDES A A, CARPENTIER A F, et al. Radiotherapy combined with nivolumab or temozolomide for newly diagnosed glioblastoma with unmethylated MGMT promoter: An international randomized phase III trial[J]. Neuro Oncol, 2023, 25(1): 123-134.
71. LIM M, WELLER M, IDBAIH A, et al. Phase III trial of chemoradiotherapy with temozolomide plus nivolumab or placebo for newly diagnosed glioblastoma with methylated MGMT promoter[J]. Neuro Oncol, 2022, 24(11): 1935-1949.
72. CLOUGHESY T F, MOCHIZUKI AY, ORPILLA J R, et al. Neoadjuvant anti-PD-1 immunotherapy promotes a survival benefit with intratumoral and systemic immune responses in recurrent glioblastoma[J]. Nat Med, 2019, 25(3): 477-486.
73. WELLER M, BUTOWSKI N, TRAN D D, et al. Rindopepimut with temozolomide for patients with newly diagnosed,EGFRvIII-expressing glioblastoma (ACT IV): a randomised,double-blind,international phase 3 trial[J]. Lancet Oncol, 2017, 18(10): 1373-1385.
74. MASSIMINO M, MICELI R, GIANGASPERO F, et al. Final results of the second prospective AIEOP protocol for pediatric intracranial ependymoma[J]. Neuro Oncol, 2016, 18(10): 1451-1460.
75. RUDÀ R, REIFENBERGER G, FRAPPAZ D, et al. EANO guidelines for the diagnosis and treatment of ependymal tumors[J]. Neuro Oncol, 2018, 20(4): 445-456.
【引用格式】中国抗癌协会神经肿瘤专业委员会. 胶质瘤化疗中国专家共识[J]. 中国神经精神疾病杂志,2024,50(8):449-462.
【Cite this article】Chinese Society of Neuro-oncology.Chinese experts consensus on chemotherapy for glioma[J]. Chin J Nervous Mental Dis,2024,50(8):449-462.
DOI:10.3969/j.issn.1002-0152.2024.08.001


