溃疡性结肠炎合并持续性妊娠期恶心呕吐1例
时间:2024-11-17 11:00:42 热度:37.1℃ 作者:网络
1 病例资料
患者女性,39岁,因“溃疡性结肠炎(UC)2年,拟备孕”于2021年3月就诊于北京协和医院临床营养科孕期营养门诊。
患者身高165 cm,体质量53.3 kg,体质量指数(BMI) 19.6 kg/m2,体脂率12.6%。长期练习瑜伽,饮食以素食为主,已自行补充叶酸片(400 μg/d)2个月。
既往史:2019年于外院诊断为UC,服用5-氨基水杨酸(5-ASA)颗粒1 g、每日4次,临床症状缓解,排成形软便1~2次/d,无黏液、脓血,以5-ASA颗粒1 g、每日1次+5-ASA栓剂1 g、每晚1次维持治疗。
2021年2月初患者就诊于北京协和医院消化内科,结肠镜检查示:距肛门40~50 cm横结肠黏膜明显充血水肿伴弥漫性糜烂,未见明确溃疡,距肛门10 cm以下直肠黏膜可见弥漫性糜烂伴浅溃疡,诊断为UC全结肠型(Mayo 1分)。将5-ASA颗粒加量至1 g、每日4次,继续5-ASA栓剂局部治疗。
孕产史:孕2产0,2012年孕26+4周先兆流产并于外院行硫酸镁治疗5 d后规律宫缩流产,胎儿外观无畸形,孕期未服用任何药物,外院考虑宫颈机能不全;2013年孕4周起出现恶心、呕吐,程度剧烈,饮水亦可诱发恶心、呕吐,自诉未行补液支持治疗,体质量下降,至孕16周胚胎停育,胎膜早破自然流产,外观无畸形,未查病理,自诉孕期未服用任何药物;2018年于外院确诊单角子宫。
2021年2月中旬因不良孕史就诊于北京协和医院风湿免疫科,抗核抗体谱检查示ANA H 1:80(+),系统性血管炎相关自身抗体谱检查示 IF-ANCAP 1:10(+),抗磷脂抗体谱、狼疮抗凝物(-),考虑无明确结缔组织病或抗磷脂综合征表现。
后就诊于北京协和医院临床营养科,实验室检查示:铁缺乏,铁蛋白(ferritin,Fer) 8 μg/L;维生素D缺乏,总25羟维生素D[T-25(OH)D]10.0 μg/L。予多糖铁复合物口服补铁治疗,维生素D 1000~2000 IU/d,嘱患者适当增加主食和油脂摄入量,以孕期复合营养素制剂代替叶酸片,可补充孕妇奶粉25 g、每日2次。
患者2021年4月怀孕。孕8+3周于北京协和医院临床营养科随诊,体质量53.2 kg,较孕前减轻0.1 kg。继续5-ASA颗粒1 g、每日4次+5-ASA栓剂1 g、每晚1次治疗UC。诉自孕5周起出现食欲差、恶心、干呕、呕吐,下午及晚上较为严重,诱因包括坐车(否认晕动病史)、饥饿、上下楼梯、特殊气味(如油烟味、花香味),口服孕期复合营养素、复合维生素B片、维生素B6片、铁剂、钙剂、维生素D胶囊等营养补充剂后亦可诱发呕吐,无明显腹痛、腹胀,排便无异常。
实验室检查:血红蛋白(HGB)121 g/L,Fer 22 μg/L,T-25(OH)D 17.1 μg/L,尿酮体微量,血钾4.2 mmol/L,血钠136 mmol/L。产科超声示宫内早孕,未见异常。
改良妊娠期恶心呕吐专用量表(PUQE):9分(每项均为3分,平均每天2~3 h感到恶心呕吐,平均每天呕吐3~4次,平均每天干呕3~4次),符合中度妊娠期恶心呕吐(NVP);医院焦虑抑郁量表(HADS)焦虑评分0分、抑郁评分2分,提示无明显焦虑抑郁情绪。
嘱居家饮食,记录饮食日记,不食加工食品,少油少盐,少食多餐,避免长时间空腹或进餐过饱,保证优质蛋白质摄入,补充孕妇奶粉75~100 g/d。
NVP是影响孕妇及胎儿健康的常见疾病[1],其可能与雌激素、孕激素引起的上消化道动力异常有关[2]。约70%的孕妇会经历NVP,症状通常始于孕6~8周,在孕10~16周达峰,孕16~20周缓解,但20%~25%的患者在孕20周后仍存在NVP[2-3]。若孕妇产次更高、年龄更大、应激因素更多、每晚睡眠时间更少,则NVP持续至孕20周之后的风险更高[3]。
Gadsby 等[4]研究显示,在伴有严重NVP的孕妇中,63.2%既往妊娠时有过类似症状,说明NVP有复发倾向。本例孕妇高龄妊娠,既往妊娠时曾有NVP,可能有妊娠剧吐并最终出现胚胎停育,本次妊娠发生NVP风险较高。NVP可能导致孕期体质量增加不足[5],孕早期、孕中期发生NVP可能增加低出生体重儿的风险,但仅在孕晚期出现恶心、呕吐并不增加此风险[6]。
补充维生素B6是NVP的一线治疗方案,但NVP的管理首先应尽量避免症状诱因;饮食应少食多餐,避免饱腹感,避免辛辣或油腻食物[1];与以碳水化合物或脂肪为主的饮食相比,以蛋白质为主的饮食更有助于减轻恶心、呕吐症状[7];暂停口服铁剂可能有助于改善NVP[1]。本例孕妇对口服维生素B6片无法耐受,服用后诱发恶心、呕吐,限制了维生素B6的服用,应注意避免症状诱因,调整饮食。
炎症性肠病(IBD)是一种慢性自身免疫性肠道疾病,主要包括UC和克罗恩病(CD)。值得注意的是,吡哆醛是维生素B6的生物活性形式,研究显示活动期IBD患者的血浆维生素吡哆醛水平较缓解期患者和健康对照组显著减低,缓解期IBD患者的血浆维生素吡哆醛水平较健康对照组有减低趋势但差异不显著[8]。因此,IBD是否会增加NVP风险值得进一步探究。
患者孕20+3周随诊时体质量56.9 kg,较孕前增加3.6 kg,增重不足。产科超声示宫内中孕,胎儿孕周偏小,建议孕22~24周复查。主诉恶心、呕吐症状至孕16~19周达峰,每日7~8次。虽食欲差,患者基本可做到每日5~6餐,总主食量约150 g/d,肉类150~200 g/d。
孕20周后虽仍有间断恶心、干呕、呕吐,但程度较前减轻。实验室检查示白蛋白(ALB)38 g/L,尿酮体(-)。嘱患者多食用软面条、发面主食等,避免粗硬、生冷食物,关注消化道症状变化。
患者孕23+2周随诊时体质量57.0 kg,较孕前增加3.7 kg,仍增重不足。每日呕吐和干呕总次数3~4次,食欲较前好转,烹饪方法以蒸、炖、煮为主,主食逐渐增至200~250 g/d,鸡蛋60 g/d,肉类(主要为鱼肉、虾肉、鸡肉、瘦牛肉)250~300 g/d,常吃豆腐(50~150 g/d),水果(200~300 g/d),有时进食牛奶、酸奶或奶酪。为减轻干呕,自行停服铁剂。实验室检查示轻度贫血、铁缺乏、维生素D缺乏、维生素B12缺乏(表1)。
表1 患者孕前、妊娠期、产后营养相关实验室指标
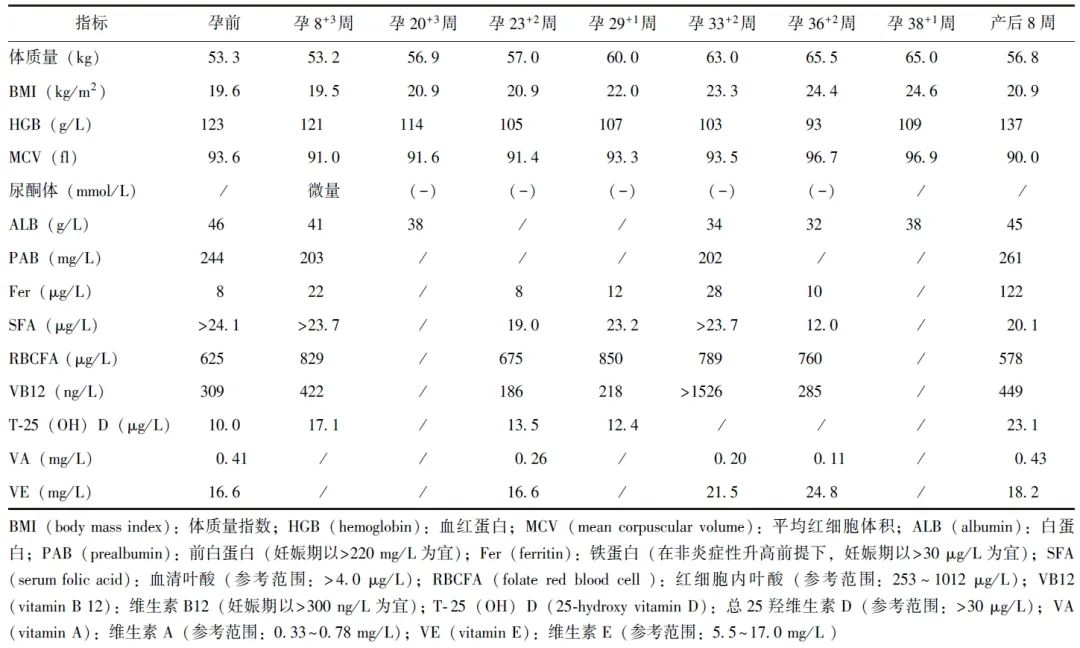
孕23+2周所行产科超声提示胎儿大小与孕周相符。嘱静脉输注蔗糖铁100 mg、隔日1次,甲钴胺0.5 mg肌注、每日1次,口服维生素D 2000 IU、每日1次,监测血常规、铁蛋白、维生素B12水平,孕妇奶粉增加为每日150 g。
饮食习惯干预对改善UC症状有重要价值。Kyaw等[9]针对处于疾病活动期的UC患者研究显示,分别给予对照组UC患者常规健康饮食建议和干预组UC患者如下饮食建议:
少食多餐(每日4~6餐次),足量饮水,低脂肪(尤其需避免饱和脂肪和反式脂肪),低碳水化合物(尤其需避免精制简单碳水化合物、高FODMAP食物,如洋葱、韭菜、豆类、卷心菜、干果、蘑菇),低纤维(尤其需避免不溶性纤维),高蛋白(避免加工肉类,减少红肉摄入),补充益生菌,限制咖啡因、酒精、快餐和即食食品,烹饪方式建议蒸、煮、煲、焯、炖,干预时间持续4~6周,结果显示干预组症状评分减低、生活质量评分升高,而对照组与此相反。
我科对本例患者提供的营养建议与上述研究有相似之处,且患者依从性较好,可做到居家饮食,烹饪方法以蒸、炖、煮为主,口味清淡,保证优质蛋白质摄入量且不吃加工肉,很少摄入精致碳水化合物、饱和脂肪和反式脂肪,不摄入酒精、咖啡,虽间断恶心、呕吐,但可通过少食多餐达到目标进食量。
患者孕29+1周随诊时体质量60.0 kg,较孕前增加6.7 kg。产科超声示宫内晚孕,臀位,未见明显异常。
孕28周连续服用动物肝脏3 d后出现黏液脓血便3~4次/d,自行服用5-ASA颗粒1 g、每日3次3 d后便血好转,1周后恢复成形软便1次/d,无黏液、脓血,自行将5-ASA颗粒减至1 g、每日2次。
追问患者UC用药史,主诉自孕12周起即自行停用5-ASA颗粒及5-ASA栓剂,至本次病情加重前,每日排成形软便1次,无黏液、脓血。嘱患者至我院消化内科评估病情。
患者孕33+2周随诊时体质量63.0 kg,较孕前增重9.7 kg,排便无异常。每日呕吐和干呕总次数3~4次,进食量基本同前。于外院静脉补蔗糖铁共200 mg,Fer由12 μg/L回升至28 μg/L,仍轻度贫血,维生素A缺乏(0.20 mg/L)。停用甲钴胺,嘱维生素A软胶囊 25 000 U、每日2次,继续补充维生素D 2 000 IU/d。
患者孕36+2周随诊时体质量65.5 kg,较孕前增加12.2 kg。
孕36周起恶心、呕吐进一步减轻,每日呕吐和干呕总次数1~2次。因服用维生素A软胶囊可诱发患者恶心,患者未服用。检查示维生素A缺乏加重(VA 0.11 mg/L)、铁缺乏(Fer 10 μg/L)、贫血较前加重(HGB 93 g/L)。于我院产科静脉输注蔗糖铁100 mg、每日1次,共输注2次,第2次输注后可疑过敏,表现为输注侧前臂皮疹,遂停止补充,蔗糖铁总量200 mg。孕36周起再次自行停用5-ASA,诉排便无异常。
维生素和矿物质缺乏是IBD患者常见的营养问题,最常见为铁、维生素D、维生素B12、叶酸缺乏[10]。UC患者维生素D缺乏风险是健康人群的2倍[11],而维生素B12、叶酸缺乏主要见于CD患者[10]。即使在处于临床缓解期的IBD患者中,仍有29%维生素D缺乏,14%维生素B6缺乏,11%维生素B12缺乏,8%铁缺乏,8%叶酸缺乏[12]。
本例患者孕前已评估脂溶性维生素、维生素B12、叶酸、铁蛋白基线水平,对不足者进行补充,并在妊娠期间进行监测以便及时予以干预。患者孕前虽无贫血,但已存在铁缺乏,且孕期铁缺乏未完全纠正,一方面与患者存在NVP,孕早、中期口服补铁不足有关;另一方面,患者孕前UC未达黏膜愈合,可能导致经结肠黏膜缓慢少量失血,且患者孕12周自行停用UC药物,可能加重孕期贫血和铁缺乏。对于此类口服铁剂受限患者,应及时予静脉补铁治疗。本例患者孕晚期静脉补铁后,贫血明显减轻。
妊娠结局:孕38+1周体质量65.0 kg,HGB 109 g/L,ALB 38 g/L,孕期增重11.7 kg。于孕38+2周剖宫产分娩一男婴,体质量3640 g,评分好。剖宫产后患者恶心、呕吐情况即缓解。患者各项指标变化见表2。
表2 患者孕前、妊娠期、产后体成分监测
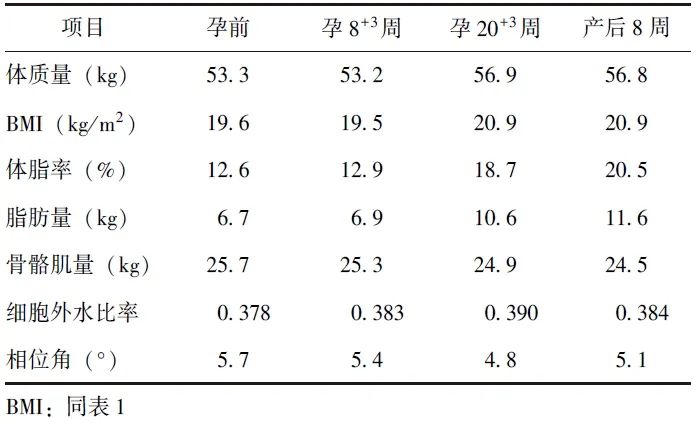
产后随诊:产后8周体质量56.8 kg。予婴儿混合喂养,6周龄时体质量5565 g。患者产后9周UC症状复发,黏液脓血便4~5次/d,就诊于北京协和医院消化内科,嘱5-ASA颗粒1 g、每日4次+5-ASA栓剂1 g、每晚1次,1周后症状好转,排成形软便1次/d,无黏液、脓血,继续规律随诊。产后1年,患者体质量53 kg,继续规律服用5-ASA颗粒1 g、每日2次,UC病情稳定;婴儿体质量10.5 kg,身长80 cm,世界卫生组织(WHO)身高别体质量Z评分为0分。
有研究显示,IBD患者妊娠期血清炎症因子和粪便钙卫蛋白水平减低,提示妊娠可能降低IBD患者的炎症水平[13-14]。孕激素对肠道炎症有抑制作用[15],且妊娠期下消化道蠕动减慢的生理改变可能减轻腹泻症状,这些因素可能对IBD患者有一定的保护作用。孕前处于病情活动期的UC患者中,55%在妊娠期病情仍持续活动;而孕前处于病情缓解期的UC患者中,仅29%在妊娠期病情复发[16]。
妊娠期处于病情活动期的IBD患者更易出现妊娠并发症,包括自然流产、小于胎龄儿、早产以及分娩并发症[17],而妊娠期处于病情缓解期的IBD患者发生上述事件的风险则与对照人群类似[18]。因此,在孕前控制疾病活动、在妊娠期防止疾病复发是拟妊娠或合并妊娠的IBD患者管理重点,IBD患者宜在病情缓解期妊娠。
部分IBD常规治疗药物在患者妊娠期具有良好的安全性,中华医学会消化病学分会炎症性肠病学组2019年发布的《炎症性肠病妊娠期管理的专家共识意见》指出,采用5-ASA、硫嘌呤类药物、抗TNFα单克隆抗体维持疾病缓解的患者,妊娠期可继续使用该类药物;妊娠期UC患者如在5-ASA维持治疗期间出现轻中度疾病活动,可考虑足量口服5-ASA,并联合直肠局部5-ASA治疗以诱导病情缓解;大部分 IBD 治疗药物在母乳中可被少量检出,然而其影响甚微,推荐哺乳期 IBD 患者继续使用常规剂量5-ASA[19]。
妊娠期停药是IBD病情复发的独立危险因素,近期一项研究显示,在单用5-ASA的UC合并妊娠患者中,36.2%依从性较差,其中有52.9%在妊娠期间停药,依从性差将显著增加妊娠期间病情复发及不良妊娠结局的风险(包括自发流产、早产、低出生体重儿)[20]。本例患者孕前UC临床症状缓解,但肠镜下仍存在结肠黏膜糜烂和浅溃疡,治疗依从性欠佳,妊娠期反复自行停药,孕晚期和产后出现病情复发。
本例患者对5-ASA应答良好,每次病情发作后应用5-ASA可控制症状,及时的症状控制有助于减轻IBD对妊娠的不利影响。对于IBD合并妊娠的患者,应宣教妊娠期维持IBD治疗的重要性,及时在消化内科随诊,避免妊娠期自行停药,降低病情复发及不良妊娠结局的风险。
本例孕妇高龄妊娠、有不良孕史,基础病为UC。NVP持续时间长,从孕5周持续至妊娠结束,孕晚期恶心、呕吐、干呕虽仍存在,但较前减轻,分娩后恶心、呕吐立即缓解,考虑妊娠期雌激素、孕激素水平的升高可能在该患者的持续性NVP中发挥重要作用。该患者孕期出现多重营养素(包括铁、维生素D、维生素B12及维生素A)缺乏,孕中晚期持续性轻度贫血。经饮食指导、营养指标监测、营养素补充支持,妊娠期体质量增加适宜,妊娠结局良好。
综上,对于合并复杂营养问题的孕妇,妊娠期监测患者体质量、血常规、白蛋白、营养素水平等指标并及时给予医学营养治疗,对维持妊娠期良好的营养情况、降低不良妊娠结局风险并最终促进母婴健康有重要作用。
参考文献
[1]Committee on Obstetric Practice. ACOG practice bulletin No. 189: nausea and vomiting of pregnancy[J]. Obstet Gynecol, 2018, 131(1): e15-e30.
[2]Liu C, Zhao G, Qiao D N, et al. Emerging progress in nausea and vomiting of pregnancy and hyperemesis gravidarum: challenges and opportunities[J]. Front Med (Lausanne), 2021, 8: 809270.
[3]Linseth G, Vari P. Nausea and vomiting in late pregnancy[J]. Health Care Women Int, 2005, 26(5): 372-386.
[4]Gadsby R, Barnie-Adshead A M, Jagger C. A prospective study of nausea and vomiting during pregnancy[J]. Br J Gen Pract, 1993, 43(371): 245-248.
[5]Gu L J, Mo M J, Si S T, et al. Association of nausea and vomiting of pregnancy with infant growth in the first 24 months of life[J]. Arch Gynecol Obstet, 2021, 304(2): 429-438.
[6]Petry C J, Ong K K, Beardsall K, et al. Vomiting in pregnancy is associated with a higher risk of low birth weight: a cohort study[J]. BMC Pregnancy Childbirth, 2018, 18(1): 133.
[7]Jednak M A, Shadigian E M, Kim M S, et al. Protein meals reduce nausea and gastric slow wave dysrhythmic activity in first trimester pregnancy[J]. Am J Physiol, 1999, 277(4): G855-G861.
[8]Saibeni S, Cattaneo M, Vecchi M, et al. Low vitamin B(6) plasma levels, a risk factor for thrombosis, in inflammatory bowel disease: role of inflammation and correlation with acute phase reactants[J]. Am J Gastroenterol, 2003, 98(1): 112-117.
[9]Kyaw M H, Moshkovska T, Mayberry J. A prospective, randomized, controlled, exploratory study of comprehensive dietary advice in ulcerative colitis: impact on disease activity and quality of life[J]. Eur J Gastroenterol Hepatol, 2014, 26(8): 910-917.
[10]Weisshof R, Chermesh I. Micronutrient deficiencies in inflammatory bowel disease[J]. Curr Opin Clin Nutr Metab Care, 2015, 18(6): 576-581.
[11]Del Pinto R, Pietropaoli D, Chandar A K, et al. Association between inflammatory bowel disease and vitamin D deficiency: a systematic review and meta-analysis[J]. Inflamm Bowel Dis, 2015, 21(11): 2708-2717.
[12]MacMaster M J, Damianopoulou S, Thomson C, et al. A prospective analysis of micronutrient status in quiescent inflammatory bowel disease[J]. Clin Nutr, 2021, 40(1): 327-331.
[13]Van Der Giessen J, Binyamin D, Belogolovski A, et al. Modulation of cytokine patterns and microbiome during pregnancy in IBD[J]. Gut, 2020, 69(3): 473-486.
[14]Kim E S, Tarassishin L, Eisele C, et al. Longitudinal changes in fecal calprotectin levels among pregnant women with and without inflammatory bowel disease and their babies[J]. Gastroenterology, 2021, 160(4): 1118-1130.e3.
[15]Chen G, Shi J X, Qi M, et al. Effects of progesterone on intestinal inflammatory response, mucosa structure alterations, and apoptosis following traumatic brain injury in male rats[J]. J Surg Res, 2008, 147(1): 92-98.
[16]Abhyankar A, Ham M, Moss A C. Meta-analysis: the impact of disease activity at conception on disease activity during pregnancy in patients with inflammatory bowel disease[J]. Aliment Pharmacol Ther, 2013, 38(5): 460-466.
[17]Ali M F, He H, Friedel D. Inflammatory bowel disease and pregnancy: fertility, complications and treatment[J]. Ann Gastroenterol, 2020, 33(6): 579-590.
[18]Beaulieu D B, Kane S. Inflammatory bowel disease in pregnancy[J]. Gastroenterol Clin North Am, 2011, 40(2): 399-413.
[19]何瑶, 李玥, 谭蓓, 等. 炎症性肠病妊娠期管理的专家共识意见[J]. 协和医学杂志, 2019, 10(5): 465-475.
[20]Watanabe C, Nagahori M, Fujii T, et al. Non-adherence to medications in pregnant ulcerative colitis patients contributes to disease flares and adverse pregnancy outcomes[J]. Dig Dis Sci, 2021, 66(2): 577-586.


