近2万例晚期前列腺癌分析PIK3CA基因变异特征,或能筛选靶向/免疫治疗获益人群
时间:2024-11-17 11:00:52 热度:37.1℃ 作者:网络
在乳腺癌中,携带两个或以上 PIK3CA 短变异(SV)(“多次打击”)的肿瘤与抗 PIK3CA 靶向治疗结局较好相关。在临床晚期前列腺癌(CAPC)中,多次打击 PIK3CA 变异的图谱和临床意义仍不明确。本研究旨在评估 CAPC 中一次打击和多次打击 PIK3CA 基因变异的基因图谱。在 Foundation Medicine FoundationCore 数据库中,19978 例 CAPC 肿瘤进行了基于杂交捕获的全面基因组测序,评估所有类别的基因变异(GA)并确定肿瘤突变负荷(TMB)、微卫星不稳定性(MSI)、基因组祖先、单碱基替换突变特征和同源重组缺陷特征(HRDsig)。通过 IHC(Dako 22C3)测定肿瘤细胞 PD-L1 表达。18741 例(93.8%)肿瘤为 PIK3CA 野生型(WT),1155 例(5.8%)为单个 PIK3CA SV,82 例(0.4%)为多次打击 PIK3CA SVs。与 PIK3CA WT CAPC 相比,一次打击(6.6 vs 3.8;p < 0.0001)和多次打击(12.8 vs 3.8;p < 0.0001)CAPC 中每个肿瘤具有更多的驱动 GA,MMR 突变特征、MSI-H 和 TMB-H 发生率更高(p < 0.0001)。其他 GA 差异包括:多次打击的 BRCA2 GA 频率高于 WT(18.3% vs 8.5%;p = 0.0191),多次打击的 ATM GA 频率高于 WT(13.4% vs 5.6%;p = 0.02),一次打击的 PTEN GA 频率高于 WT(40.2% vs 30.1%;p < 0.0001)。PIK3CA WT 的同源重组缺陷特征高于一次打击(11.2% vs 7.6%;p = 0.0002)。三组间的 PD-L1 表达无显著差异。CAPC 中多次打击 PIK3CA GA 的识别突出了一种可能的独特表型,该表型可能对抗 PIK3CA 靶向治疗和检查点抑制剂有反应,支持相关临床试验设计。
研究背景
在美国男性中,前列腺癌是最常见的恶性肿瘤。局限性前列腺癌男性的 5 年生存率接近 100%,但在非区域转移性前列腺癌男性中,这一比例显著下降至约 30%。转移性去势敏感性前列腺癌(mCSPC)的治疗包括雄激素剥夺疗法(ADT)加第二代抗雄激素(AA)或多西他赛,或最近的三联疗法;然而,几乎所有患者都在 2-3 年内进展为转移性去势抵抗性前列腺癌(mCRPC),此时全身治疗通常疗效有限。
美国国家综合癌症网络(NCCN)指南推荐对区域或远处转移性前列腺癌患者进行基因和生物标志物检测,主要关注胚系突变、DNA 损伤反应基因、微卫星不稳定性、错配修复缺陷和肿瘤突变负荷。虽然前列腺癌的分子生物标志物已经取得了进展,但仍迫切需要准确和预测性生物标志物来辅助指导治疗决策。
磷脂酰肌醇 3-激酶(PI3K)激活是哺乳动物雷帕霉素靶标(mTOR)通路的初始信号之一,与前列腺癌进展和转移密切相关。先前的研究表明与雄激素受体(AR)信号通路存在显著的相互作用,PI3K 抑制通常与 AR 相关基因激活有关,反之亦然,提示 PI3K 轴可能提供潜在的替代治疗靶点。尽管如此,泛 PI3K 联合 AR 抑制剂的疗效不佳。然而,PIK3K通路中的致癌基因PIK3CA的多个突变会产生单个突变的累加效应,对PI3K抑制剂高度敏感。靶向 PIK3CA 致癌突变在前列腺癌中研究相对不足,在其他恶性肿瘤中更成功。我们假设,PIK3CA 可能成为难治性临床晚期疾病男性患者的药物靶点。因此,我们试图确定临床晚期前列腺癌(CAPC)中一次和多次打击 PIK3CA 变异的基因图谱和临床意义。
研究结果
19978 例 CAPC 的临床和基因特征见表 1。18741 例(93.8%)CAPC 为 PIK3CA 野生型(WT),1155 例(5.8%)具有单个 PIK3CA SV 突变,82 例(0.4%)具有不止一个(“多次打击”)PIK3CA SV 突变(图 1)。PIK3CA WT(68;IQR 61–74)、一次打击 PIK3CA SV(70;IQR 62-76)和多次打击 PIK3CA SV(69;IQR 63-73)CAPC患者的中位年龄似乎相似。与 PIK3CA WT CAPC 相比,一次打击(6.6 vs 3.8;p < 0.0001)和多次打击(12.8 vs 3.8;p < 0.0001)CAPC 中每个肿瘤具有更多的驱动 GA (图 2A-C)。非洲遗传血统在 PIK3CA WT CAPC(14.0%)中的频率高于一次打击(10.4%;p = 0.0010)和多次打击(10.2%;不显著)病例。东亚、南亚和美国混血血统的频率从不到 1% 到 6% 不等,并且在本研究的所有组中都相似。
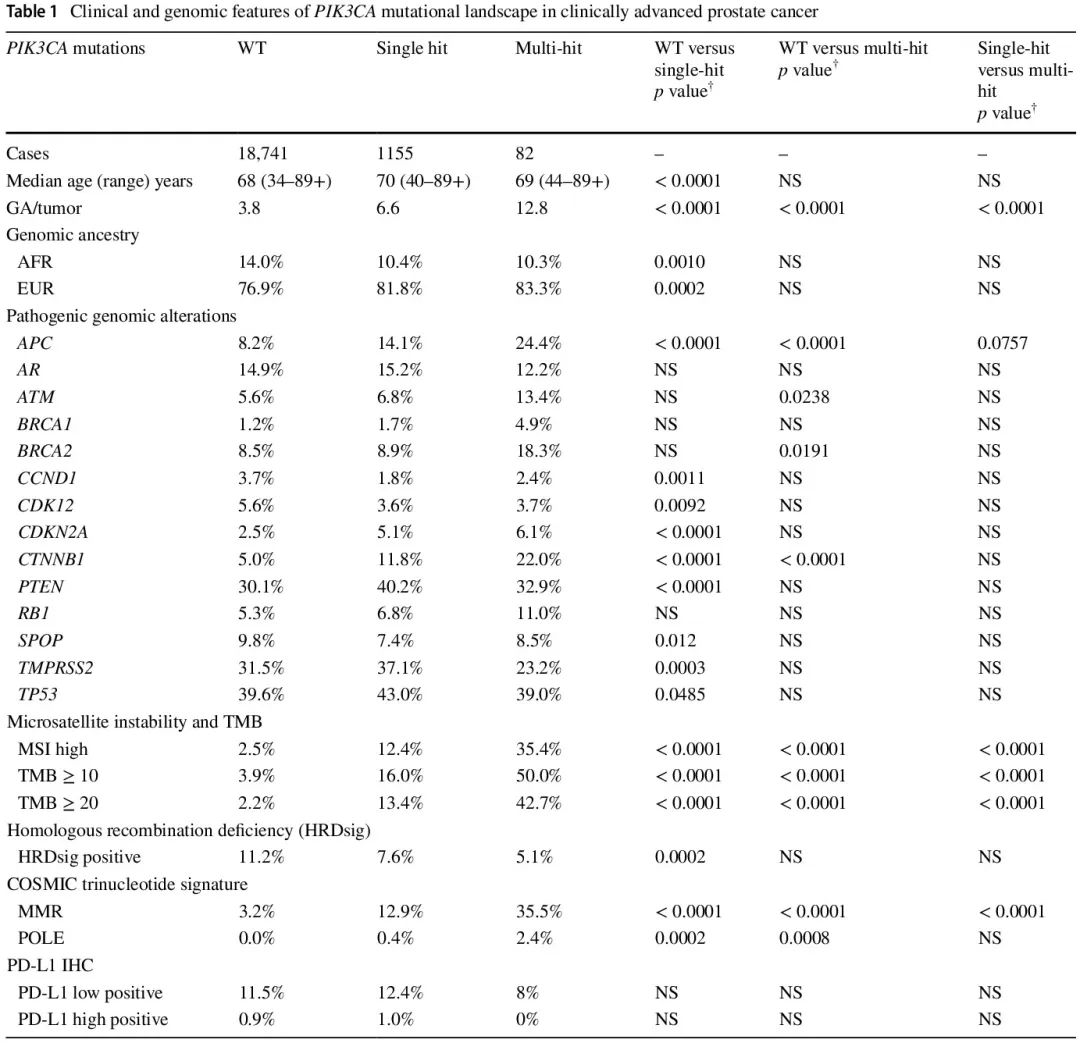
表1
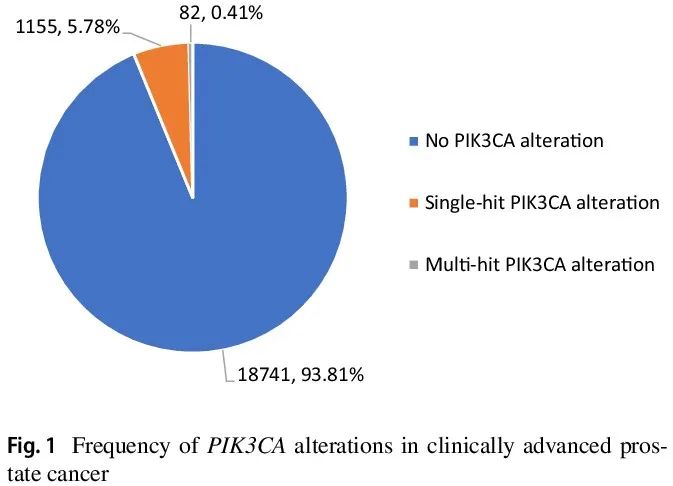
图1
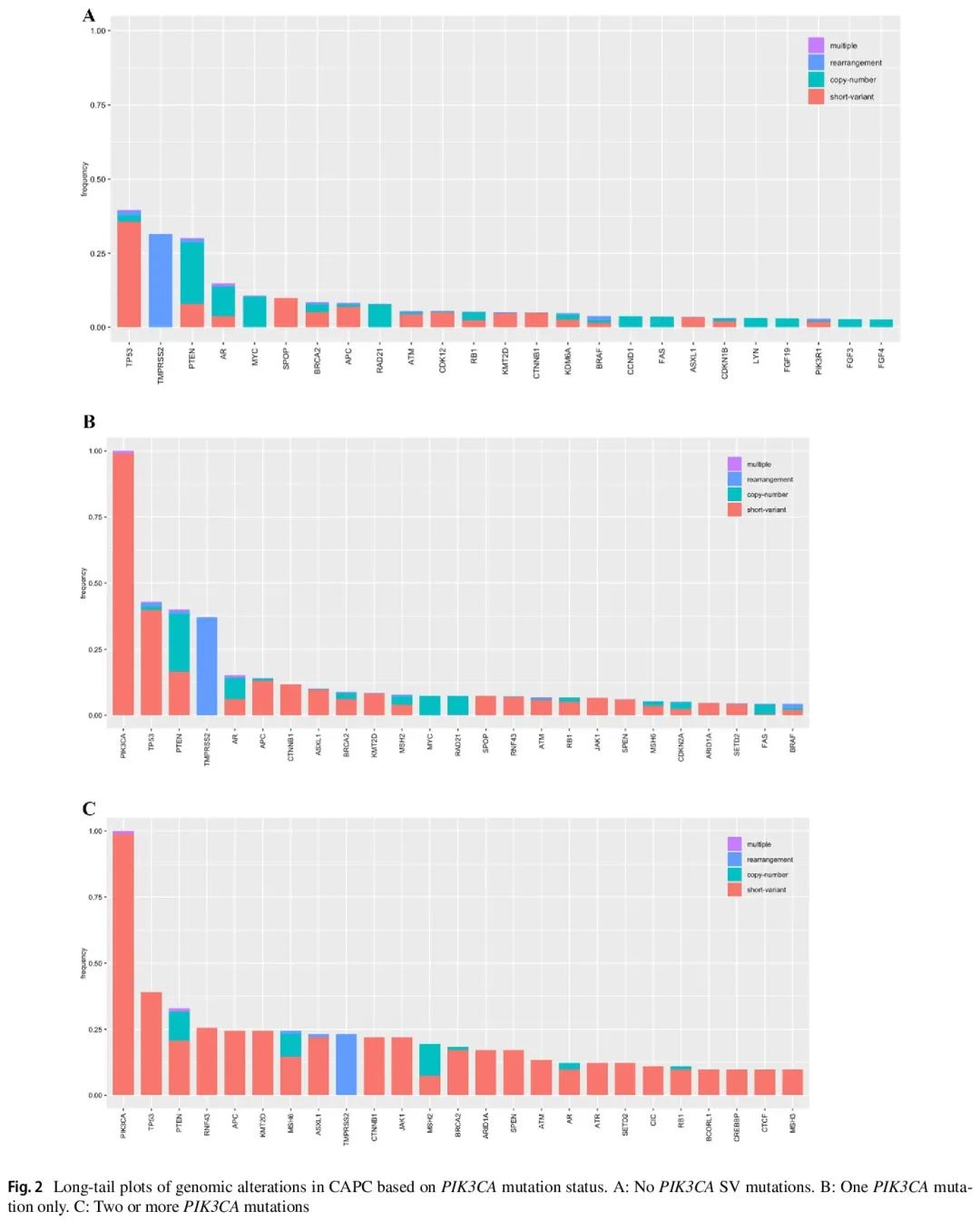
图2
一次打击(12.9%;p < 0.0001)和多次打击(35.4%;p < 0.0001)PIK3CA SV CAPC 的 MMR 突变特征发生率显著高于 PIK3CA WT(3.2%)。一次打击(0.4%;p = 0.0002)和多次打击(2.4%;p = 0.0008)PIK3CA SV CAPC 的 POLE 突变特征发生率也显著高于 PIK3CA WT(0.0%)。与 PIK3CA WT 相比,MSI-H 状态在 PIK3CA 一次打击(12.4% vs 2.5%;p < 0.0001)和多次打击(35.4% vs 2.5%;p < 0.0001)中显著更常见。一次打击(2.5 mut/Mb;IQR 1.25–5.00)和多次打击(7.5 mut/Mb;IQR 1.74–45.02)PIK3CA 突变的中位肿瘤突变负荷(TMB)也高于 PIK3CA WT(1.7 mut/Mb;IQR 0.87–3.60)。具有潜在重要性的 GA 的显著差异包括:多次打击的 BRCA2 GA 频率高于 WT(18.3% vs 8.5%;p = 0.0191),多次打击的 ATM GA 频率高于WT(13.4% vs 5.6%;p = 0.0238),一次打击的 PTEN GA 频率高于 WT(40.2% vs 30.1%;p < 0.0001),以及一次打击的 CDK12(3.6% vs 5.6%;p = 0.0092)和 SPOP(7.4% vs 9.8%;p =0.0122)GA 频率低于 WT。PIK3CA WT 的同源重组缺陷特征高于一次打击(11.2% vs 7.6%;p = 0.0002)。三组间的 PD-L1 表达无显著差异。二次打击 PIK3CA 突变 CAPC 的示例如图 3 和图 4 所示。最后,虽然本研究中包括的患者未进行正式的胚系检测,但通过分析测序数据预测了胚系状态,在任何前列腺癌组的前列腺癌样本中,没有特定的胚系变异与 PIK3CA 状态相关。
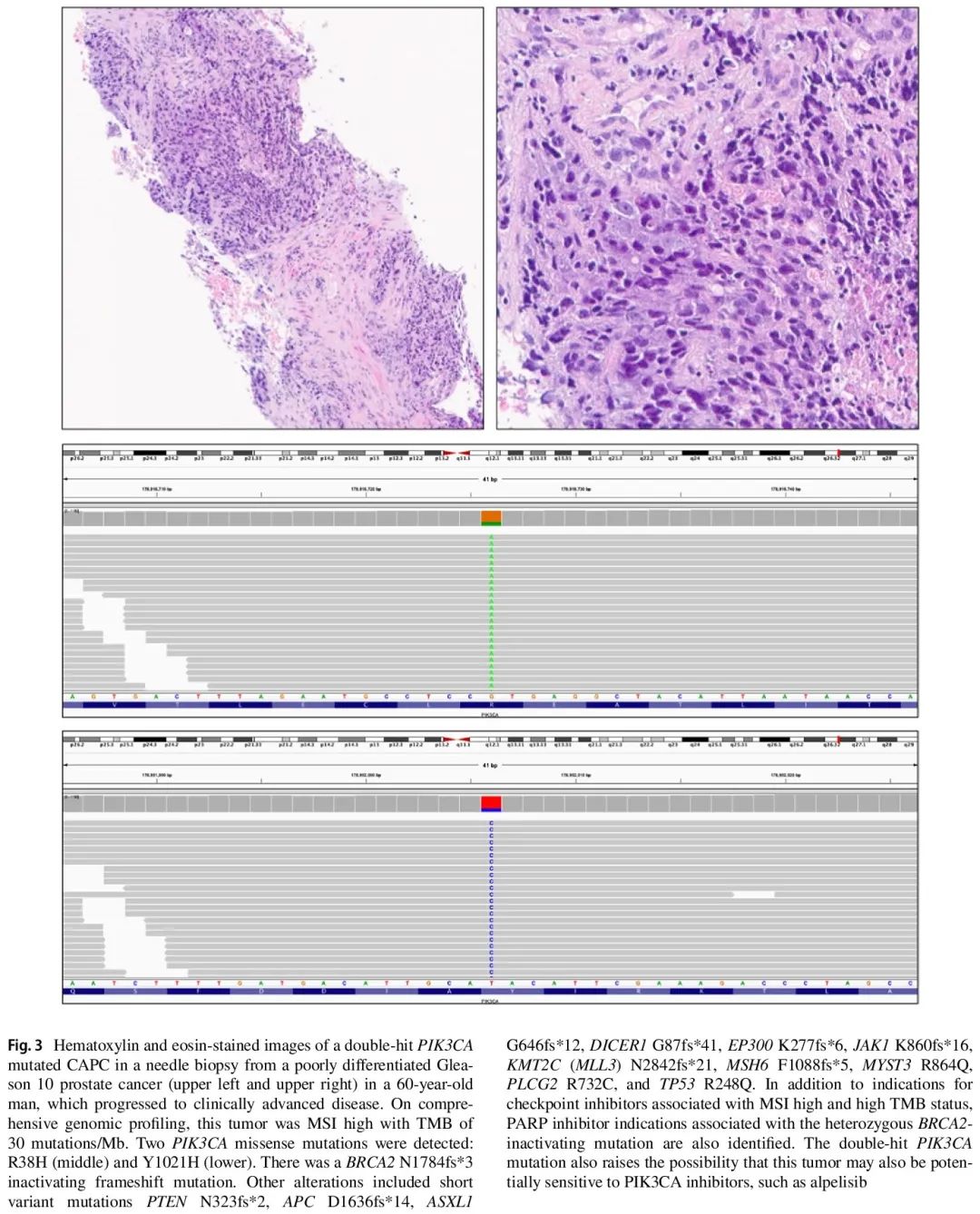
图3. 一名 60 岁男性进展为CAPC,低分化 Gleason 10 前列腺癌,携带二次打击 PIK3CA 突变,左上和右上为穿刺活检样本苏木精和伊红染色图像。全面基因组测序显示,该肿瘤 MSI-H,TMB 为 30 个突变/Mb。检测到两个 PIK3CA 错义突变:R38H(中)和 Y1021H(下)。有一个 BRCA2 N1784fs*3 移码失活突变。其他改变包括短变异 PTEN N323fs*2、APC D1636fs*14、ASXL1 G646fs*12、DICER1 G87fs*41、EP300 K277fs*6、JAK1 K860fs*16、KMT2C(MLL3)N2842fs*21、MSH6 F1088fs*5、MYST3 R864Q、PLCG2 R732C 和 TP53 R248Q。除了与 MSI-H 和 TMB-H 状态相关的检查点抑制剂适应症外,还识别了与BRCA2 杂合失活突变相关的 PARP 抑制剂适应症。二次打击 PIK3CA 突变也增加了该肿瘤对 PIK3CA 抑制剂(如阿培利司)敏感的可能性。
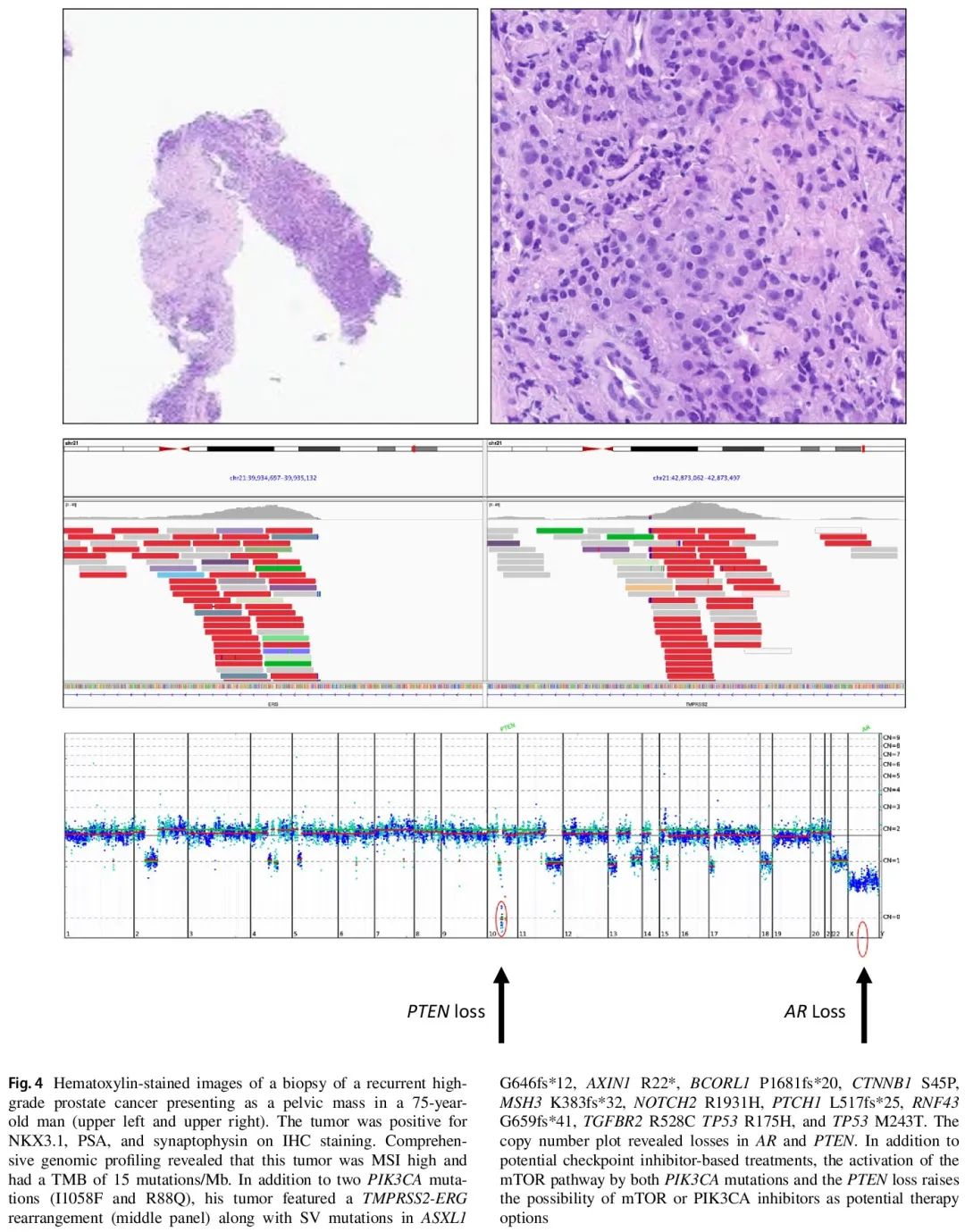
图4. 一名 75 岁男性出现盆腔肿块,复发性高级别前列腺癌活检样本的苏木精染色图像见左上和右上。IHC 染色显示肿瘤 NKX3.1、PSA 和突触素阳性。全面基因组测序显示,该肿瘤为 MSI-H,TMB 为 15 个突变/Mb。除了两个 PIK3CA 突变(I1058F 和 R88Q)外,还检出 TMPRSS2-ERG 重排(中图)以及 ASXL1 G646fs*12、AXIN1 R22*、BCORL1 P1681fs*20、CTNNB1 S45P、MSH3 K383fs*32、NOTCH2 R1931H、PTCH1 L517fs*25、RNF43 G659fs*41、TGFBR2 R528C TP53 R175H 和 TP53 M243T 这些 SV。拷贝数图显示 AR 和 PTEN 缺失。除了潜在的基于检查点抑制剂的治疗外,PIK3CA 突变和 PTEN 缺失导致的 mTOR 通路激活增加了 mTOR 或 PIK3CA 抑制剂作为潜在治疗选择的可能性。
讨 论
随着肿瘤基因组学的进展和前列腺癌的可及疗法,对生物标志物驱动的治疗的需求越来越大。例如,最近批准将聚(ADP-核糖)聚合酶(PARP)抑制剂用于晚期前列腺癌,这为个性化治疗带来了希望,特别是对于 DNA 损伤反应基因突变的患者。然而,仍然需要其他可靠的生物标志物和治疗靶点。
在 70-100% 的晚期前列腺癌病例中观察到 PI3K 通路异常。研究表明,AR 和 PI3K/AKT 通路之间存在相互反馈机制,其中一种通路的抑制导致另一种通路的激活。因此,人们认为去势抵抗性前列腺癌可能通过 PI3K/AKT 通路(特别是通过 PI3KCA 激活突变)对抗雄激素耐药。文献中 PI3KCA 突变的发生率在 5.5% 到 11.5% 之间,这与我们研究的 6.2% 相似。PIK3K 通路中的致癌基因 PIK3CA 的多个突变已被证明结合了单个突变的作用。PIK3CA 突变与前列腺癌预后不良有关,并且与 PTEN 缺失一起加速去势抵抗性癌症的生长。与既往研究一致,我们发现,与野生型 PIK3CA 相比,分子变异(一次和多次打击 PIK3CA)可能与诊断时更晚期的前列腺癌相关。
尽管最初持乐观态度,但抑制 PI3K 通路的首批研究并未在前列腺癌治疗方面取得预期的成功。由于无效或无法逆转耐药性,单用泛 I 类 PI3K 抑制剂或联合阿比特龙/恩扎卢胺的试验提前停止。选择性 PI3Kβ 和 PI3Kδ 抑制剂在前列腺癌以及其他恶性肿瘤中几乎没有疗效。然而,在一项使用靶向 AKT 通路的 AKT 抑制剂 ipatasertib联合阿比特龙的 3 期随机临床试验中,PTEN 缺失的转移性 CRPC 患者的影像学无进展生存期改善,提示在特定患者中靶向该通路可能有用。此外,使用靶向 PIK3CA 的阿培利司联合雌激素受体降解剂氟维司群可以改善 PIK3CA 突变的雌激素受体阳性乳腺癌的无进展生存期,该疗法已获得 FDA 批准。与其他 PI3K 亚基相比,PIK3CA 特异性抑制可能是较好的生物学靶向。此外,在细胞中多次打击 PIK3CA 突变对 PI3K 抑制剂高度敏感,强调需要进一步评估其作为生物标志物的作用。早期试验表明了PIK3CA 抑制剂在其他实体瘤(例如头颈部癌、结直肠癌和卵巢癌)中的疗效。目前,阿培利司仍然是唯一获批用于实体瘤的选择性 PI3K 抑制剂,鉴于提出的 PI3K 通路导致 AR 耐药通路,评估 PIK3CA 抑制剂用于特定患者可能是一种替代甚至协同治疗策略。
前列腺癌通常被描述为“免疫冷肿瘤”,几项试验评估了程序性配体-1(PD-L1)抑制剂用于生物标志物未经选择的前列腺癌患者,未取得成功。然而,帕博利珠单抗已获得 FDA 批准用于MSI-H 或 TMB-H(TMB ≥10 mut/Mb)肿瘤。MSI-H 和 TMB-H 前列腺癌很少见,但在我们的多次打击 PIK3CA 肿瘤队列中,超过三分之一的患者 MSI-H,一半患者 TMB ≥10 mut/Mb。我们证明了 PIK3CA 突变与 MSI-H、TMB-H 以及 MMR 和 POLE 单碱基替换突变特征之间存在很强的相关性。然而,目前尚不清楚这是否是一种因果关系,可以帮助选择接受免疫治疗的患者,或者更有可能只是相关性。
本研究存在几个固有的局限。它是回顾性的,缺乏有关临床参数、结局和所用疗法的数据,这些数据可能有助于更好地分析和描述我们的分子生物标志物发现的临床相关性。不幸的是,我们不知道患者之前是否接受过癌症治疗或活检标本的位置,它是从原发部位还是转移部位获得的,这些信息将有助于我们更好地了解癌症的演变,甚至为治疗提供一些启示。尽管多次打击 PIK3CA 突变的样本量较低,限制了普遍性,但我们的研究具有显著的一次打击 PIK3CA 突变样本量,表明多次打击人群中共突变的频率呈持续趋势。这有利于 PIK3CA 抑制剂以及 PD-1 和 PD-L1 抑制剂在 PIK3CA 改变的前列腺癌中的研究,无论是一次打击还是多次打击状态。此外,我们的数据是基于转诊的性质收集的,因此受到临床晚期病例的选择偏倚的影响;此外,我们无法解释无法衡量的混杂因素。尽管存在一些局限性,但我们的研究可以为前列腺癌患者的选择和研究产生相关假设,尤其是具有 PIK3CA 突变的患者,并有助于为临床试验设计提供信息。
本研究表明,前列腺癌中 PI3K 通路激活可导致更具侵袭性和去势抵抗性生长趋势。PIK3CA 突变 CAPC 在非洲基因组血统的患者中发生频率较低,与 PIK3CA 野生型 CAPC 相比,MSI-H、TMB-H 和错配修复缺陷相关 COSMIC 突变特征的频率更高。一次打击和多次打击 PIK3CA 突变可能是 PIK3CA 和 PD-L1 抑制剂的潜在生物标志物。需要进一步的研究来评估 PIK3CA 突变作为前列腺癌靶向治疗和免疫治疗的生物标志物。
参考文献:
Basin, M.F., Miguel, C.M., Jacob, J.M. et al. Single-Hit and Multi-hit PIK3CA Short Variant Genomic Alterations in Clinically Advanced Prostate Cancer: A Genomic Landscape Study. Targ Oncol (2024). https://doi.org/10.1007/s11523-024-01100-w



