Molecular Psychiatry:中前额叶皮层中GABA能控制对慢性压力适应的转录组特征
时间:2024-11-24 16:00:47 热度:37.1℃ 作者:网络
慢性压力是抑郁症、创伤后应激障碍(PTSD)和精神分裂症等多种精神疾病的主要诱因,但个体在应对压力时表现出显著的易感性差异,即压力适应性。研究表明,中前额叶皮层(mPFC)的生长抑素(SST)阳性GABA能中间神经元在调控压力相关疾病易感性方面起关键作用。压力暴露后,SST神经元功能下降会导致焦虑和认知功能受损,而增强这些神经元的功能可能促进抗压力能力。本研究旨在通过转录组分析探讨GABA能神经元对压力适应性的分子机制,特别是对雄性和雌性个体在基因表达和行为上的差异影响。

本研究使用小鼠模型,通过Cre重组技术敲除SST神经元中的GABAA受体γ2亚基,从而增加SST神经元的活性,生成抗压力能力显著增强的SSTCre:γ2f/f小鼠。研究采用慢性可变压力(CVS)模型,对SSTCre和SSTCre:γ2f/f小鼠进行为期21天的多种压力刺激。通过RNA测序技术,分析CVS暴露后小鼠mPFC中的差异表达基因(DEGs)及相关的信号通路。行为学测试包括新异环境抑制进食测试(NSFT)、蔗糖偏好测试(SPT)等,用以评估压力暴露对焦虑和快感缺失行为的影响。
转录组数据处理包括mRNA的提取、文库构建及高通量测序,随后进行差异表达分析、主成分分析(PCA)及信号通路富集分析。实验进一步比较不同性别小鼠的基因表达变化及其对CVS的行为和分子反应差异。
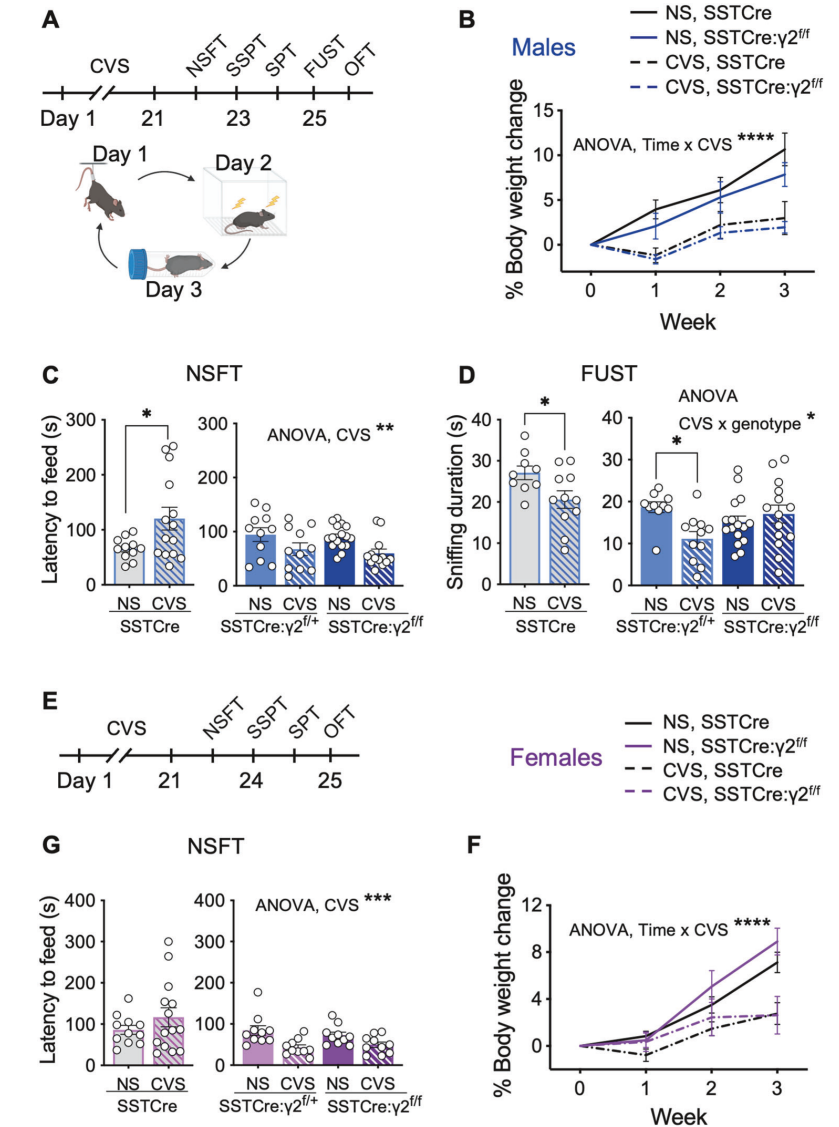
图1.SSTCre:γ2f/f小鼠在行为学和mPFC转录组水平上对CVS的压力适应性
行为学分析表明,SSTCre:γ2f/f小鼠表现出对CVS的显著抗压力能力。与SSTCre对照组相比,SSTCre:γ2f/f小鼠在NSFT中的进食潜伏期减少,在SPT中的蔗糖偏好增加,显示抗焦虑和抗快感缺失行为。转录组分析揭示,CVS诱导的DEGs在SSTCre:γ2f/f小鼠中显著少于SSTCre小鼠,表明抗压力能力伴随着基因表达变化的减少。在雄性小鼠中,CVS暴露诱导的基因表达变化主要涉及mRNA翻译的增强,而压力易感性小鼠中则表现为信号传导和细胞粘附相关通路的下调。
性别差异分析显示,SSTCre:γ2f/f雌性小鼠在行为和转录组水平上的压力反应与雄性小鼠存在显著差异。雄性小鼠的抗压力能力主要与mPFC中SST神经元的活性增强相关,而雌性小鼠的转录组变化对CVS暴露的反应更类似于SSTCre对照组。
此外,基因共表达分析发现,压力适应性基因在抗压力小鼠和压力易感小鼠中的调控方向相反,表明这些基因可能在压力适应机制中具有关键作用。进一步的信号通路富集分析显示,抗压力能力主要通过增强mRNA翻译和核糖体相关通路实现,而压力易感性则与多种细胞内信号传导通路的下调相关。
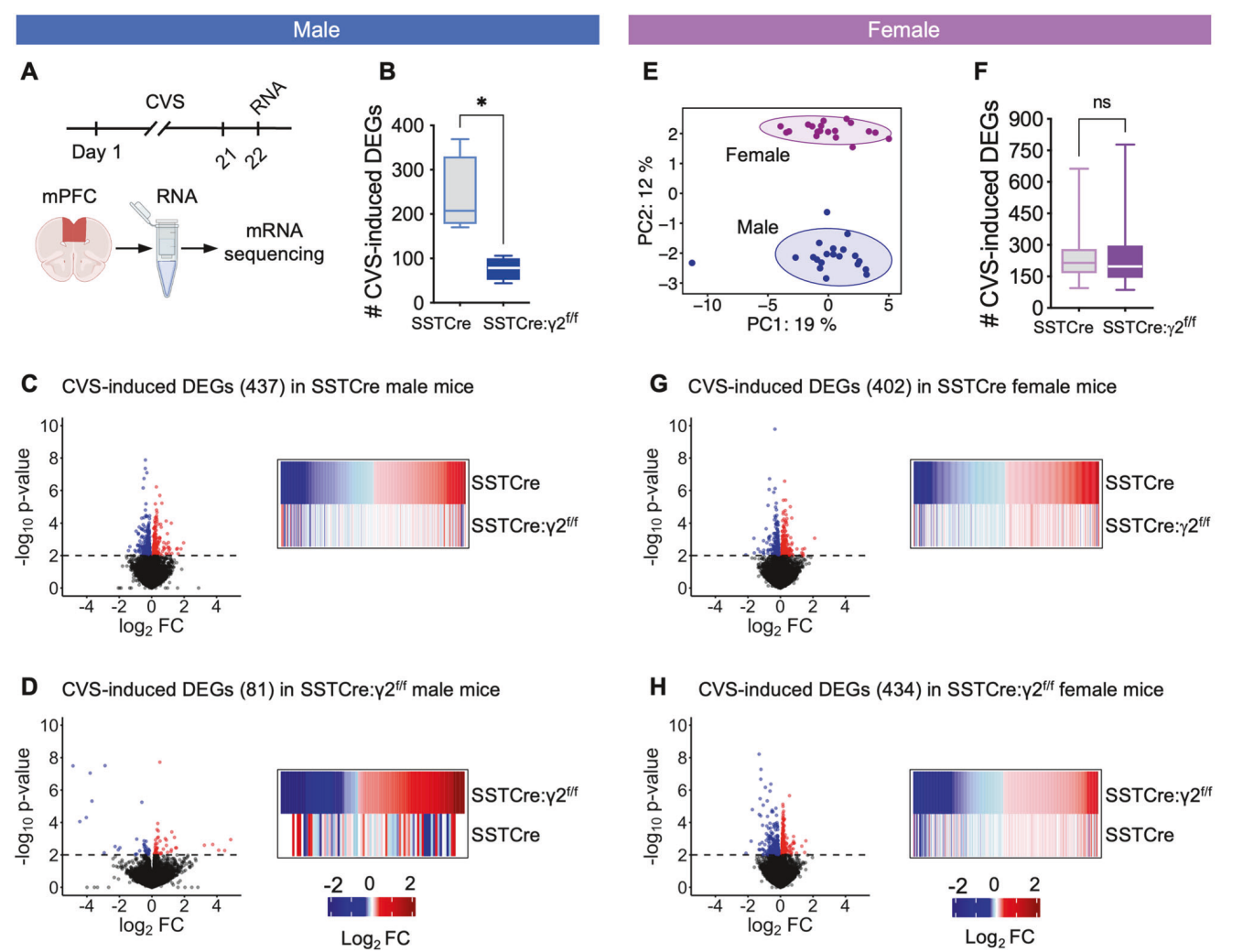
图2.雄性和雌性小鼠的mPFC转录组主成分分析(PCA)
本研究首次系统揭示了SST神经元调控的压力适应性机制,尤其是在雄性小鼠中通过增强mRNA翻译实现抗压力能力。研究还指出,压力适应性是一种动态过程,涉及对基因表达和信号通路的双向调控。这些发现为理解压力相关精神疾病的病理机制提供了新视角,并可能为开发针对性治疗策略提供靶点。
原始出处:
Shao M, Botvinov J, Banerjee D, Girirajan S, Lüscher B. Transcriptome signatures of the medial prefrontal cortex underlying GABAergic control of resilience to chronic stress exposure. *Molecular Psychiatry*. 2024. https://doi.org/10.1038/s41380-024-02832-x


