Science:情绪相关受体-GPR158的发现可能成为抗抑郁新靶点
时间:2023-04-20 19:16:28 热度:37.1℃ 作者:网络
GPR158是一个孤儿GPCR,在大脑中高度表达,它控制突触的形成和功能。GPR158也被认为与抑郁症、致癌和认知有关。然而,GPR158的结构组织和信号传导机制在很大程度上是未知的。
2023年3月30日美国佛罗里达州斯克里普斯研究中心神经科学系主任Kirill Martemyanov博士发表在Science杂志上的一项研究《Orphan receptor GPR158 serves as a metabotropic glycine receptor: mGlyR》表示,甘氨酸GPR158是一种常见的氨基酸,具有向大脑传递“抑制”信号的能力,该信号可能是引发重度抑郁等情绪障碍的因素之一。
其团队在21年利用低温电镜以大约十亿分之一米的分辨率解析出GPR158的不寻常的脑细胞受体及其与一组介导其活性的蛋白结合在一起时的原子结构图,其中该受体与抑郁症和焦虑症有关。它使得开发通过阻断GPR158来治疗抑郁症、焦虑症和可能的其他情绪障碍的潜在疗法成为可能。它通过调节离子通道和第二信使来塑造突触组织和功能与 GPR158 结合可增强 RGS 活性,这两种蛋白质共同作用以调节第二信使 (cAMP) 的体内平衡,从而控制神经元活动,对大脑生理学产生显着影响。然而,其信号机制和结构组织仍然难以捉摸。有缓存结构域的GPCR只有两个,包括GPR158 和夜盲相关受体 GPR179。

甘氨酸是存在哺乳动物中最简单的氨基酸,具有向大脑传递“抑制”信号的能力,该信号可能是引发重度抑郁等情绪障碍的因素之一。甘氨酸能传递与病理状况有关,包括抑郁症。2018年,Martemyanov团队发现了一种新的甘氨酸受体GPR158。在被诊断为重度抑郁症的人死亡时,GPR158在他们的前额皮层中存在异常高的水平。他们还发现,将小鼠暴露在慢性应激下,会增加小鼠前额叶皮层中GPR158受体的水平,导致类似抑郁症的行为,如若阻断遭受慢性应激小鼠中的GPR158活性,则会使它们对抑郁症和应激影响产生抵抗力。
因此猜测GPR158可能是治疗情绪疾病的靶点。但不清楚是如何作用的,其信号传递分子又是什么。研究人员发现它与RGS复合物的结合方式,与大部分受体和常规信号转导蛋白结合的方式相同,因此研究人员猜测,RGS蛋白可能就是GPR158受体传递信号的分子。最后,在GPR158面向细胞外的一侧,发现了一个不寻常的模块,称为缓存结构域(cache domain)。研究人员认为缓存结构域是激活GPR158的分子的捕捉器,而且缓存结构域以前从未在这些类型的受体中被观察到,这也展现了GPR158这种“孤儿受体”的独特生物学特性。
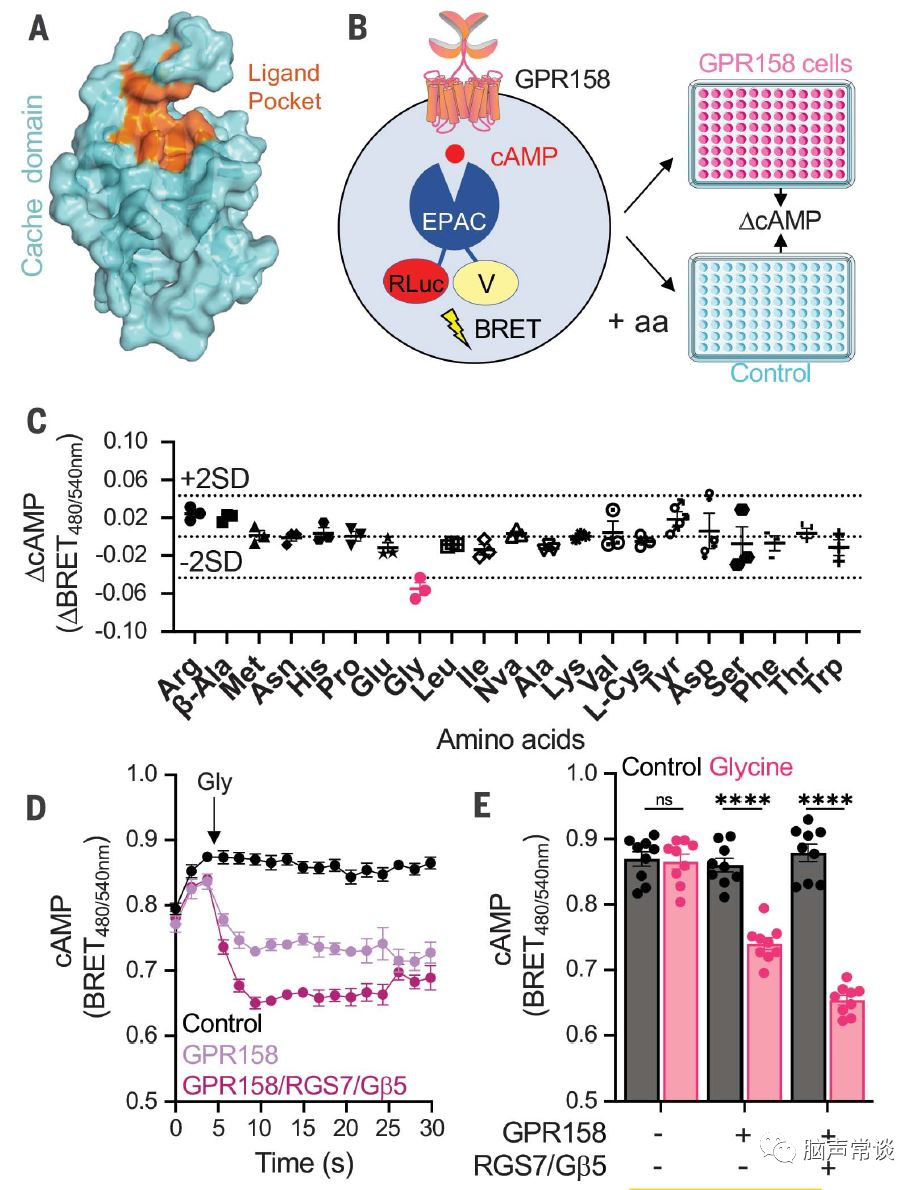
图一 甘氨酸信号通过GPR158调节cAMP
作者假设GPR158有氨基酸配体,筛选了一系列氨基酸来改变GPR158介导的信号。因为GPR158可以调控脑内cAMP,基于cAMP biosensor的生物发光共振能量转移进行测试,与未转染细胞相比,应用于表达 GPR158的HEK293细胞时,只有甘氨酸使cAMP 含量显着降低。为了更详细地研究这种效应,作者以动力学模式分析了个体对甘氨酸的反应。甘氨酸应用于表达 GPR158 的 U87 胶质母细胞瘤细胞导致 cAMP 减少。在缺乏 GPR158 的细胞中未观察到甘氨酸诱导的 cAMP 变化。GPR158的抑制性效应由于共表达RGS7-Gβ5进一步增强,表明GPR158 信号通过这种蛋白质复合物影响 cAMP 水平。

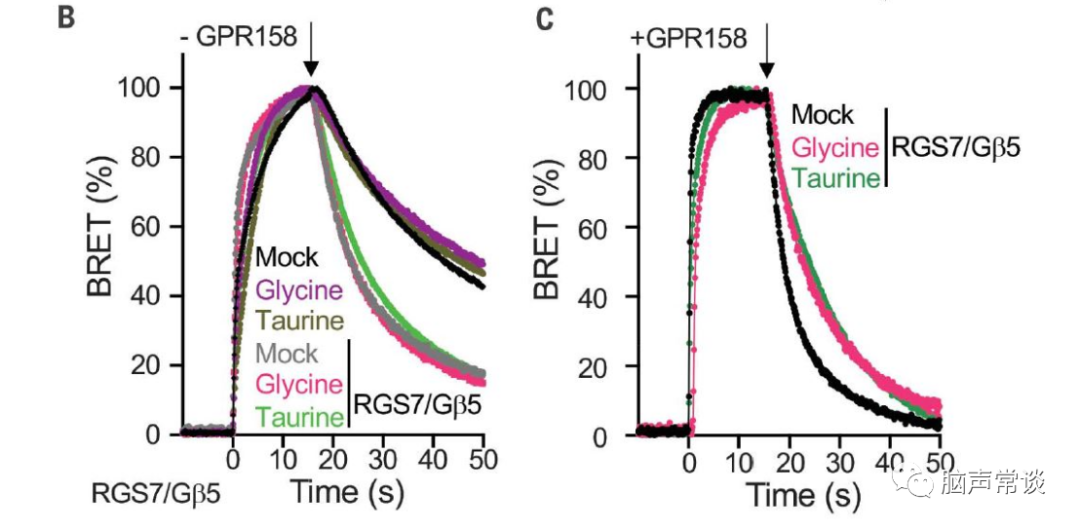
图二 甘氨酸抑制GPR158对RGS7-Gβ5的调节
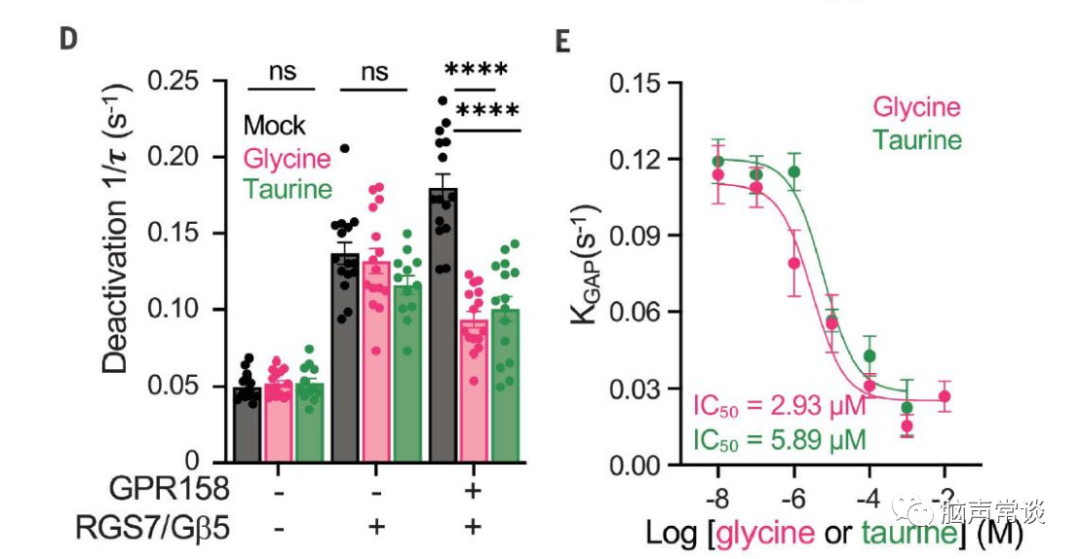
为了进一步理解甘氨酸如何作用于GPR158调控胞内cAMP,GTP酶激活蛋白(GAP)是已知调节cAMP产生的Gai/o蛋白,GPR158与RGS7-Gβ5两种蛋白相互作用调节第二信使环磷酸腺苷 (cAMP) 的稳态,从而控制神经元活动。作者使用基于细胞assay通过跟踪G蛋白失活的动力学来监测GAP活性,通过GPCR刺激激活G蛋白会在释放的Gβγ亚基与 masGRK3CTNluc报告基因相互作用时产生 BRET(生物发光共振能量转移)信号。当 GPCR 拮抗作用触发 Gα与 Gβγ重组形成无活性异源三聚体时,该信号被淬灭。
然后通过 BRET 信号的淬灭监测 G 蛋白失活,发现引入RGS7-Gβ5加速了底物的失活(B,C)。当 GPR158 与 RGS7-Gβ5共表达时,甘氨酸显着减缓了Gao失活(C)。表明甘氨酸通过结合 GPR158 特异性抑制 RGS7-Gβ5 的 GAP 活性。甘氨酸在GPR158的IC50是3μM。进一步测试了甘氨酸或牛磺酸是否可以诱导 GPR158 像典型的 GPCR 那样激活 G 蛋白,我们观察到用甘氨酸或牛磺酸测试的任何G蛋白都没有显着激活。使用 BRET 试验测试了甘氨酸是否可以诱导 b-arrestin 募集到 GPR158,也没有获得显着反应。


图三 GPR158直接结合甘氨酸
为了确定GPR158是甘氨酸直接靶标,作者设计了一种基于流式细胞术的检测方法来监测异硫氰酸荧光素的结合,当表达GPR158的HEK293细胞与 FITC标记的甘氨酸一起孵育时,观察到大量细胞的标记(A,B)。当 FITC 甘氨酸与未转染 GPR158 的细胞一起孵育时,没有明显的标记。且该结合效应成剂量依赖性增加(C),进一步证实该结合具有甘氨酸选择性。作者分离了细胞膜并进行了经典的放射性配体滴定实验,检测到 [3H]甘氨酸与不同浓度的 GPR158 表达细胞的显着结合。发现明显超过没有 GPR158 的线性非特异性结合(E)。斯卡查德分析估计 GPR158 的甘氨酸解离常数KD为3 mM,该直线表明是专一性结合(F)。作者使用纯化蛋白通过等温滴定量热法 (ITC) 检测甘氨酸与 GPR158 结合(G)。使用ITC技术可以敏锐检测到生物分子相互作用(包括分子间和分子内部)过程中热量的变化。ITC 结合概况显示甘氨酸在纯化样品与GPR158结合,GPR158与甘氨酸作用后释放的热量饱和,产生的 KD 范围为2至16μM(H,I),在直接结合实验中获得的甘氨酸亲和力与功能性GAP测定中测量的亲和力非常一致,表明与甘氨酸的结合是导致 GPR158活性变化的原因。

图四 甘氨酸与 GPR158 的缓存域结合并调节RGS7-Gβ5复合体的 GAP 活性
接下来进行了分子对接实验,将甘氨酸拟合到AlphaFold2预测的GPR158 缓存域中假定配体结合口袋的模型中,甘氨酸可以很好地容纳在一个口袋中,通过与 S172、R173、E271 和 D307 侧链的氢键相互作用网络稳定甘氨酸(A,B)。为了测试在 GPR158 缓存域中形成假定甘氨酸袋的残基的作用,作者进行了定点诱变,在放射性配体结合测定中,R173A、E271A 和 Y269A 突变体显示 [3H]甘氨酸结合几乎完全丧失,证实了这些残基在配体协调中的重要作用。甘氨酸突变也失去了抑制 RGS7-Gβ5 GAP 活性的能力。通常与甘氨酸结合的S266A突变体的活性不受其调节,表明结合口袋中的一些残基参与了配体相互作用引发的构象转变。突变E271残基导致甘氨酸反应性丧失的机制也不同于其他突变。在没有甘氨酸的情况下,该突变体表现出更慢的失活动力学。

图五 甘氨酸通过GPR158调节神经元兴奋性
最后评估了甘氨酸调节GPR158对神经元活动的影响,其中GPR158在边缘皮层显着表达并调节神经元兴奋性,且甘氨酸在整个神经系统中的代谢作用尚未得到很好的表征。甘氨酸应用未能改变GPR158 KO小鼠前额叶皮层 II 层和 III 层神经元的兴奋性。甘氨酸与mGlyR的缓存结构域结合会改变细胞内表面的构象,进而影响RGS7-Gβ5的构象,这种变化降低了RGS7-Gβ5刺激Ga GTPase的能力。从这个意义上讲,甘氨酸通过降低其活性作为 GPR158-RGS7-Gβ5 复合物的拮抗剂。由于 RGS7-Gβ5 是抑制性 Gi/o 蛋白的选择性 GAP,可调节cAMP的产生,因此通过GPR158抑制RGS7-Gβ5活性会影响cAMP水平。甘氨酸信号通过mGlyR抑制抑制性G蛋白调节,从而产生兴奋性影响。当GPR158受体结合甘氨酸时,它并未与G蛋白连接,而是与一种叫做RGS蛋白的分子结合,作为抑制剂起到抑制细胞活动的作用。这两个系统可能重叠并参与自动调节和稳态反馈,正如其他对离子型和代谢型系统所指出的那样。在完整的神经回路的情况下,甘氨酸可能会触发更复杂的反应,这些反应可能涉及离子型和代谢型系统之间的相互作用。
综上所述,甘氨酸在 GPR158 上充当真正的配体,包括直接结合和由此引起的受体活性变化,从而引发细胞反应。mGlyR不激活G蛋白,而是招募 RGS7-Gβ5复合物,将其对接到细胞内袋中。这一发现意味着GPR158不再是孤儿受体,该团队将其重命名为“mGlyR”。引发人体情绪变化的机关可能藏在脑细胞受体GPR158中,使mGlyR受体(GPR158)成为与情绪治疗相关的新靶点成为可能。
原始出处:
Thibaut Laboute, et al. Orphan receptor GPR158 serves as a metabotropic glycine receptor: mGlyR. full text links. Science. 2023 Mar 31;379(6639):1352-1358.


