【JHO】非去T细胞单倍体相合移植联合移植后环磷酰胺治疗继发和原发AML:ALWP/EBMT研究结果
时间:2023-07-02 13:03:18 热度:37.1℃ 作者:网络
非去T细胞单倍体相合移植
继发性急性髓系白血病(sAML)是一种与前期血液系统疾病或既往细胞毒性化疗或放疗并发症相关的特殊类型急性髓系白血病(AML),与原发AML相比,sAML患者的预后较差。异基因造血干细胞移植(HSCT)是一种可能具有治愈效果的治疗方法,可挽救高达40%的患者。但与原发AML相比,sAML中使用相合同胞供者(MSD)和相合无关供者(MUD)移植的预后仍明显较差,总生存率(OS)、无病存活率(LFS)和无移植物抗宿主病、无复发生存率(GRFS)较低,主要是由于较高的非复发死亡率(NRM)和复发率(RI)。
而使用非去T细胞单倍体相合干细胞移植(HaploSCT)联合移植后环磷酰胺(PTCy)可能有所不同,该方案在AML中已经被广泛使用,且在预防移植物抗宿主病和减少非复发死亡率方面非常有效,从而改善了移植结局。CR1时HaploSCT治疗sAML的2年无病生存率为49%,总生存率为57%,且由于广泛的人类白细胞抗原(HLA)差异,HaploSCT可能具有更强的移植物抗白血病效应(GVL效应),这对于高复发率的sAML可能尤为重要。
可以想象得到,HaploSCT在sAML中的结局可以达到与原发AML一致,但目前还没有进行相关对照研究。因此以色列Sheba Medical Center的Arnon Nagler教授牵头开展了一项回顾性研究,使用的是欧洲血液和骨髓移植学会(EBMT)的急性白血病工作组(ALWP)数据库1711例数据,旨在比较sAML与原发AML患者的HaploSCT结局。研究近日发表于《Journal of Hematology & Oncology》。

研究结果
该研究为回顾性、多中心分析,使用EBMT的ALWP数据库,患者为≥18岁、原发或sAML、在CR1接受首次HSCT(来自非去T细胞单倍体相合供者)联合PTCy作为预防GVHD的一部分。
患者、移植和疾病特征
共1711例患者符合标准,其中231例为sAML患者,1480例为原发AML患者,表1为基线人口统计学和临床特征。sAML和原发AML患者分别中位随访24.6个月和26.3个月(p=0.52)。原发AML患者较年轻,中位年龄为55.8岁,而sAML患者为60.8岁 (p<0.0001)。两组患者的移植年份中位数均为2019年,而男性患者分别占原发AML和sAML患者的57.5%和61.9%(p=0.21)。
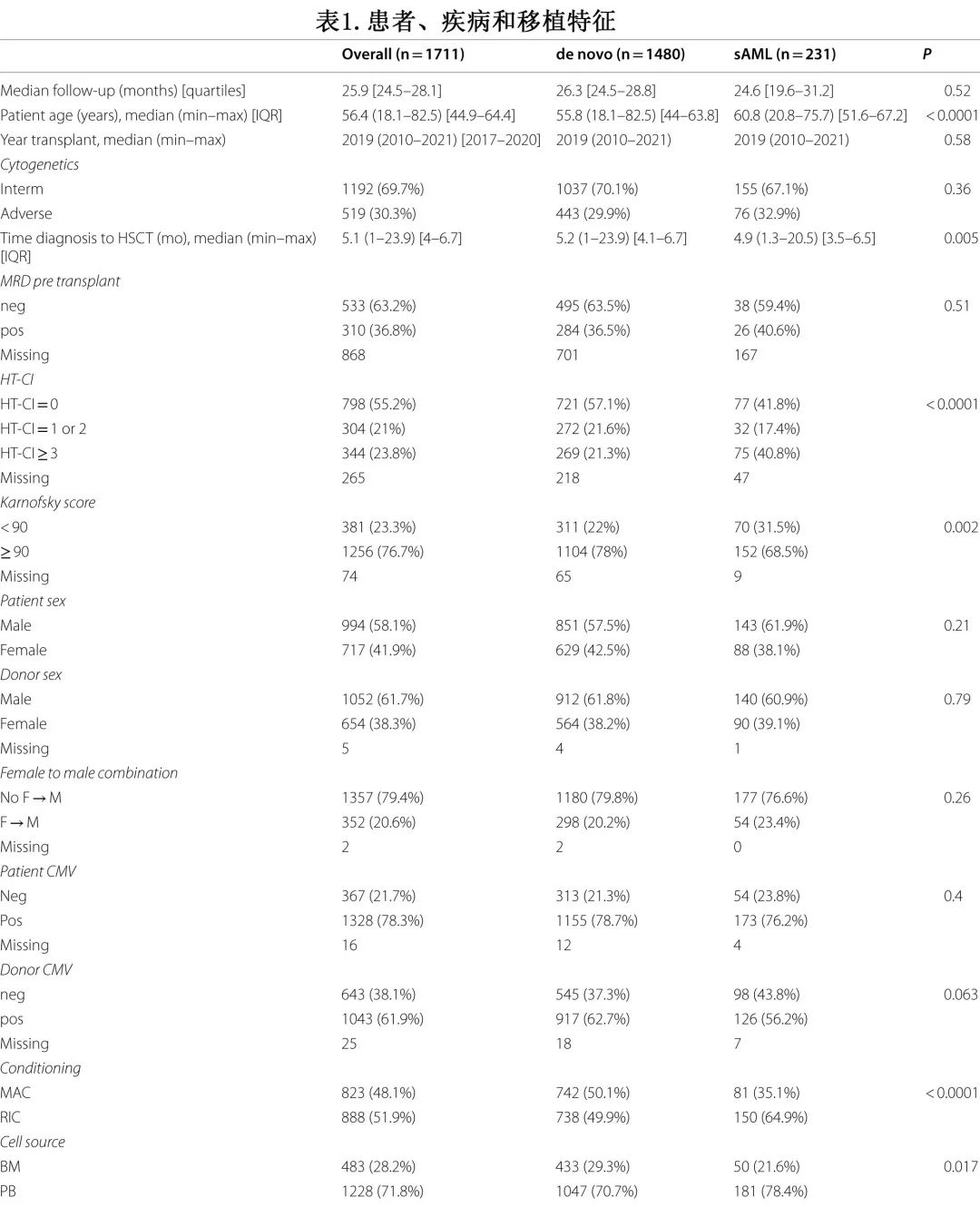
在sAML患者中,64%的患者的先前血液疾病是MDS/MPN,16.7%是其他血液疾病,其次是实体瘤(17%)和非恶性血液疾病(2.3%)。原发AML和sAML患者中的细胞遗传学风险为中等(70.1% vs 67.1%)、不良(29.9% vs 32.9%)(p=0.36)。原发AML组的KPS高于sAML,KPS ≥ 90患者分别占78%和68.5%(p=0.002)。sAML组的移植相关并发症指数(HCT-CI)高于原发AML,HCT-CI ≥ 3分别占40.8%和21.3%(p<0.0001)。两组患者的巨细胞病毒(CMV)血清阳性率没有差异(分别为78.7%和76.2%),供者之间也没有差异(分别为62.7%和56.2%)。男性患者使用女性供者的比例分别为20.2%和23.4%(p=0.26)。从诊断到HaploSCT的时间,原发AML患者中比sAML患者更长,中位数分别为5.2个月和4.9个月(p=0.005)。sAML患者接受MAC预处理的比例低于原发AML,分别为35.1%和50.1%(p<0.001)。对于两组患者来说,最常见的预处理方案是塞替派/白消安/氟达拉滨,分别为50.2%和45.9%,其次是白消安/氟达拉滨(17.6%和16.5%),以及氟达拉滨/低剂量全身放射疗法(16.2%和19.9%)。移植来源主要是外周血干细胞,原发AML组为70.7%,sAML组为78.4%。在原发AML和sAML患者中,分别有53.9%和53.7%的患者联合环孢素A (CSA)和霉酚酸酯(MMF),分别有30%和27.7%联合MMF和他克莫司(Tacro)。
移植后结局
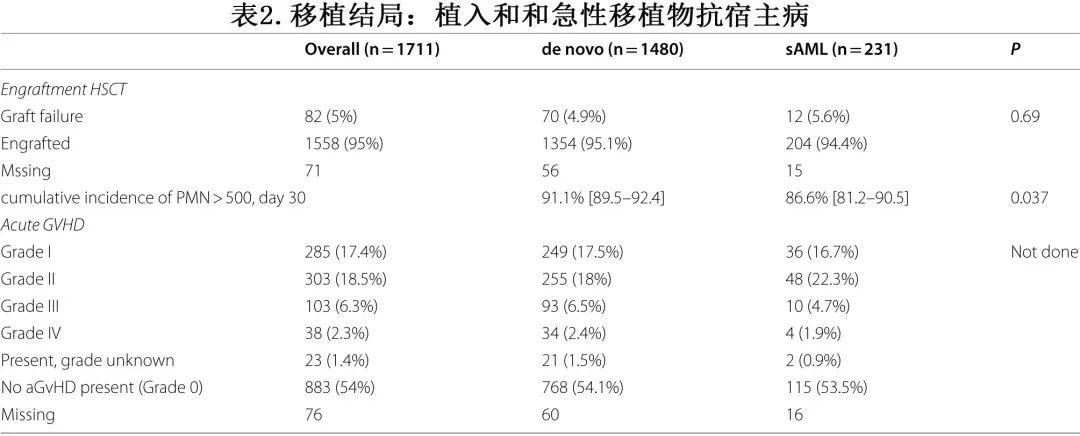
如表2所示,sAML与原发AML组在植入和移植后GVHD发生率没有差异。原发AML和sAML患者中分别有95.1%和94.4%的患者实现了中性粒细胞恢复(ANC> 0.5 × 109/L)(p=0.69);在+180天时,II-IV级aGVHD的发生率分别为27.2%和29.1%(p=0.55),III-IV级为9.2%和6.6%(p=0.23);两年总的和广泛cGVHD的发生率分别为32.2% vs 33.3%(p=1)和11.9% vs 11.3%(p=0.48)。
两组在2年NRM、RI、LFS、OS和GRFS也上没有差异:在原发AML和sAML组中,2年NRM分别为21.1%和20.8%(p=0.72),2年RI分别为19.5%和21.3%(p=0.39),两年LFS、OS和GRFS分别为59.5% vs 58%(p = 0.28)、65.4% vs 66.7%(p=0.35)和49.9% vs 47%(p=0.5)(表3A)。此外,MDS/MPN/BMFS后的sAML vs原发AML和其他恶性血液疾病(OMHD)/实体瘤(ST)后的sAML vs原发AML之间,也没有观察到任何移植结局参数的差异(表3B)。
多变量分析
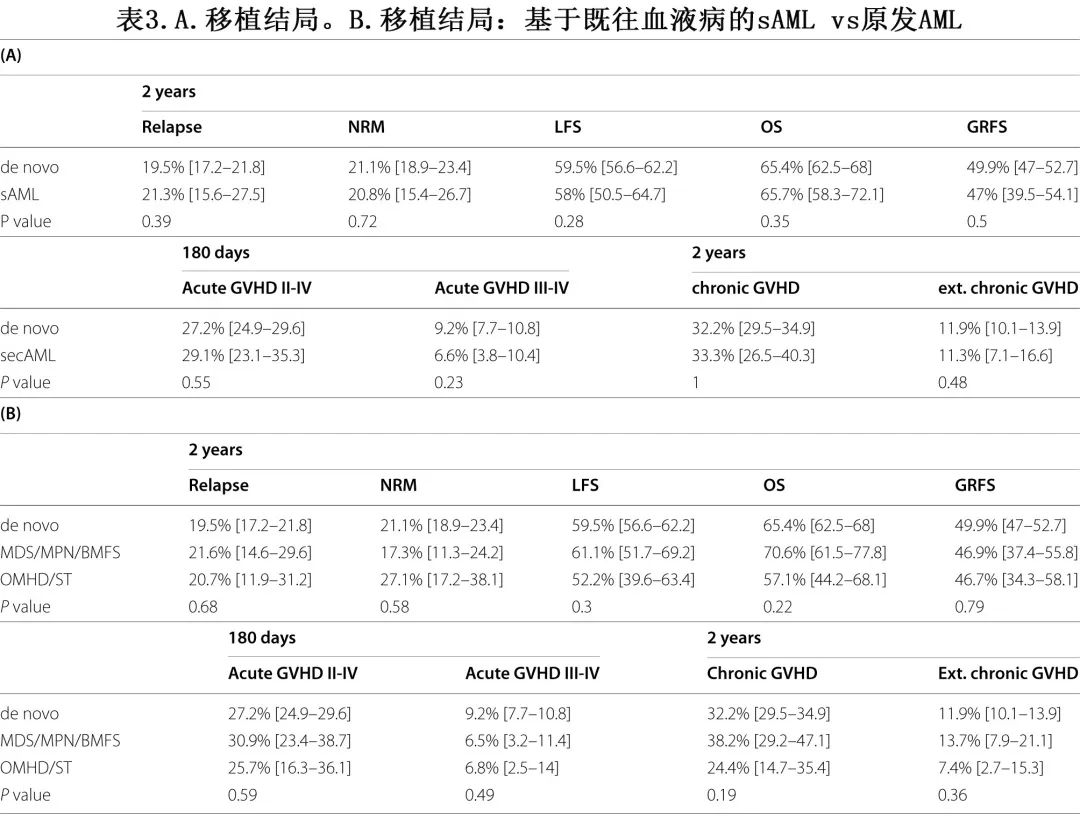
在多变量分析中(表4A),sAML与原发AML组在任何移植结局参数上都无差异;NRM的风险比(HR)为0.87(p=0.87),RI的HR为1.02(p=0.9),LFS的HR为1(p=0.99),OS的HR为0.95(p=0.72),GRFS的HR为0.94(p=0.57)(表4)。同样,sAML与原发AML组之间II-IV级aGVHD发生率的HR为1.04(p=0.8)、III-Iv级aGVHD的HR为0.73(P=0.3)、所有级别cGVHD的HR为0.96(p=0.78),广泛cGVHD的HR为0.65(p=0.097)(表4A)。并且在MDS/MPN/BMFS后sAML与原发AML以及OMHD/ST后sAML与原发AML之间,也没有观察到任何移植结局参数的差异(表4B)。其他显著的预后因素包括:不良细胞遗传学风险可预测RI较高和LFS、OS、GRFS较低;年龄(每增加10岁)可预测NRM较高和LFS、OS、GRFS较差;KPS>90是NRM较低和LFS、OS、GRFS较高的预后因素;RIC与RI较高以及LFS和OS较差相关;女性供者-男性受者的配对与LFS、OS、GRFS较低以及广泛cGVHD较高相关;外周血造血干细胞移植与II-IV级和III-IV级aGVHD以及总体cGVHD的发生率较高相关(表4)。
死亡原因
研究期间共有485例(32.8%)原发AML患者和79例(34.2%)sAML患者死亡(表5)。原发疾病是死亡的主要原因,分别占死亡人数的36.3%和42.1%,其次是感染(30.5%和26.3%),其后是GVHD(14.6%和9.2%)。多器官衰竭分别为2.4%和3.9%。其他死亡原因较少,包括肝窦阻塞性疾病、心脏毒性、出血、移植失败和中枢神经系统毒性,每种原因占总死亡人数的比例均低于2%,且两组之间没有差异(表5)。
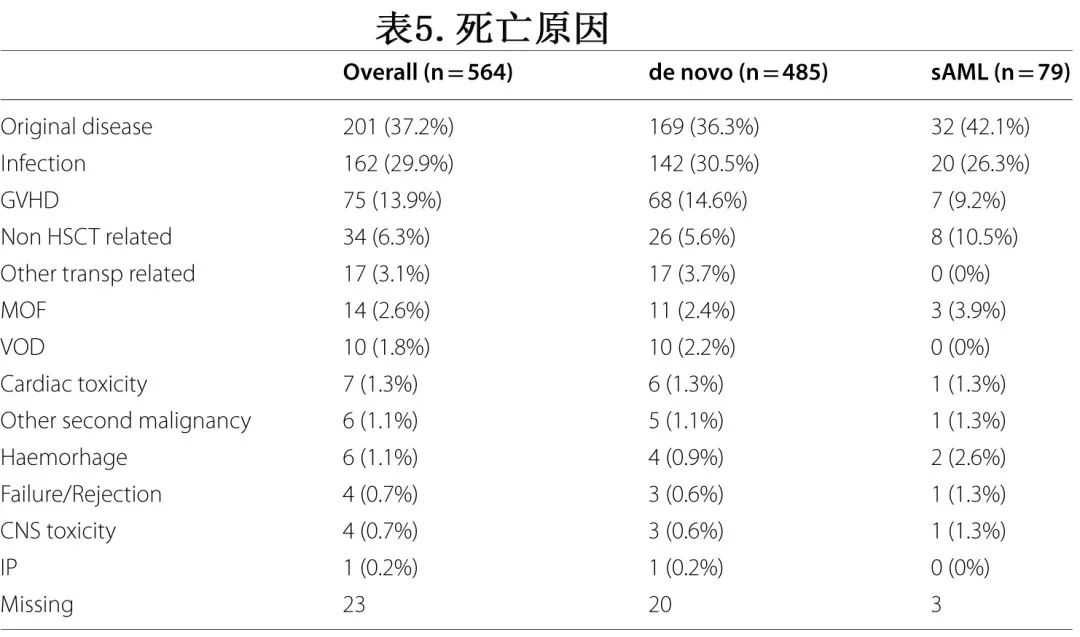
配对分析
为了减小混杂因素的影响进行了配对分析(2:1比例)。根据上述标准确定了621个匹配良好的配对(原发AML=410;sAML=211)。141例sAML患者的前驱血液疾病是MDS或MPN或BMFS,70例患者是其他恶性血液疾病(OMHD)或实体瘤(ST)。配对分析的结果与整个人群的前述结果一致。原发AML和sAML的植入率分别为93.4%和94.9%(p=0.47);两组之间的急性和cGVHD发生率均相似:II-IV级aGVHD 27.6% vs 27.7% (HR=0.99,p=0.96),III-IV级aGVHD 9.5% vs 6.7%(HR=0.7,p=0.29),总cGVHD 31.8% vs 32.8%(HR=1.03,p=0.84),广泛cGVHD 10.2% vs 10.6%(HR=0.93,p=0.79)(表6A)。对于原发AML和sAML的HaploSCT,2年NRM和RI没有差异:分别为23.4% vs 20.6%(HR=0.92,p=0.67)和21.4% vs 21%(HR=0.98,p=0.9)(表6A)。原发AML组和sAML组的LFS、OS和GRFS也没有差异,分别为55.2% vs 58.4%(HR=0.95,p=0.67)、61.4% vs 66.4%(HR=0.91,P=0.51)、和46.3% vs 48.2% (HR=0.92,P=0.48)(表6A,图1)。
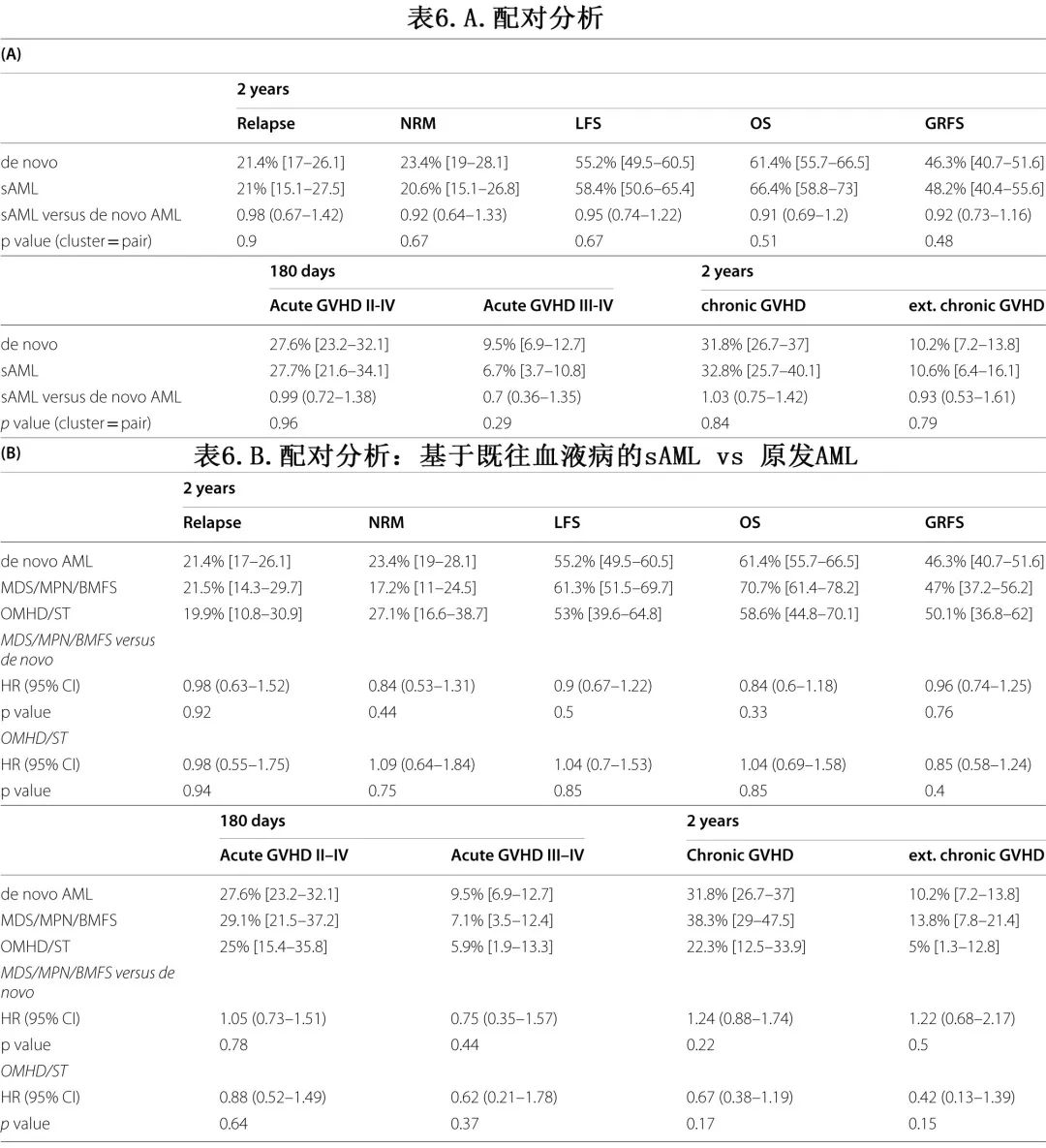
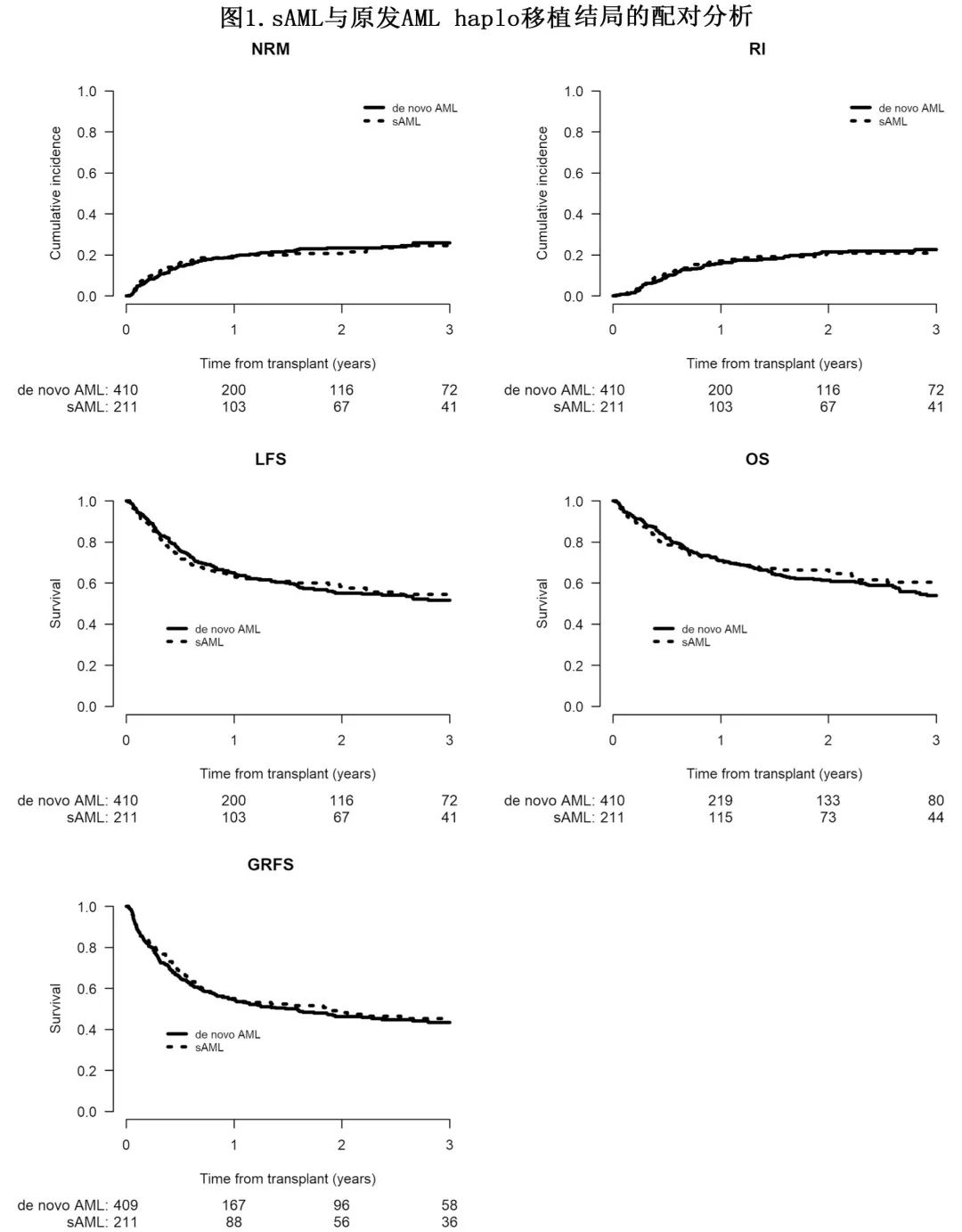
MDS/MPN/BMFS后的sAML vs原发AML之间,以及OMHD/ST后的sAMLvs原发AML之间,移植结局参数同样没有差异(表6B,图2)。
总结
该研究证明接受非去T细胞单倍体相合移植和PTCy治疗的sAML患者与原发 AML患者在移植结局方面相似,且无论先前的血液系统疾病如何,sAML的移植结局都没有差异。此外令人难忘的是,sAML患者在2年时约有三分之二的患者获救(2年OS为66.7%),且其中半数无复发和无移植物抗宿主病(GVHD)。
参考文献
Arnon Nagler,et al. Non‑T‑depleted haploidentical transplantation with post‑transplant cyclophosphamide in patients with secondary versus de novo AML in first complete remission: a study from the ALWP/EBMT.J Hematol Oncol . 2023 May 29;16(1):58. doi: 10.1186/s13045-023-01450-4.


