Nature:北大肖俊宇团队阐明免疫球蛋白IgM被特异性受体FcμR识别的分子机制
时间:2023-03-26 10:34:28 热度:37.1℃ 作者:网络
IgM是人体内五类免疫球蛋白之一,在免疫应答早期阶段发挥重要功能。IgM在人体中以多种形式存在,包括B细胞受体(BCR)复合体中的膜结合型IgM单体,分泌到血清中的IgM五聚体和六聚体以及处于黏膜表面、包含分泌组分(secretory component)的分泌型IgM。
2023年3月22日,北京大学生命科学学院肖俊宇团队在 Nature 期刊发表了题为:Immunoglobulin M Perception by FcμR 的研究论文,揭示了FcμR识别不同形式IgM的分子机制。
该研究通过结构生物学、生物化学和细胞生物学等手段揭示了FcμR特异性感知不同形式IgM的分子机制,为深入理解IgM的生物学功能奠定了基础。

在之前工作中,肖俊宇团队阐明了IgM五聚体组装和黏膜转运的分子机制,发现IgM以非对称的方式形成五聚体,并揭示了J链调节IgM五聚体组装、介导其与黏膜转运受体pIgR相互作用的结构基础。
Fc受体是人类免疫系统中一类重要受体,其主要功能是识别和结合免疫球蛋白的Fc区域。Fc受体在调节免疫应答、介导细胞毒性等方面发挥着重要的作用。不同的免疫球蛋白利用不同的Fc受体,因而特异性地引发不同的信号通路和免疫反应。
FcμR(也称为Toso或Faim3)是哺乳动物中唯一的IgM特异性受体,主要存在于B细胞表面,在T细胞等其他免疫细胞表面也有表达。FcμR可以与不同形式的IgM结合,包括膜结合型IgM单体、血清中的IgM五聚体和六聚体以及分泌型IgM,从而参与B细胞发育、免疫系统稳态调控和抗原呈递等过程。在慢性淋巴细胞白血病患者中,B细胞表面FcμR的高表达也体现了其在免疫系统和疾病发生中的重要性。但是FcμR发挥功能的分子机制并不清晰。
FcμR的胞外域包含一个Ig样结构域(D1结构域)和一段高度糖基化的内在无序区(Stalk区)。为了探究FcμR对不同形式IgM的识别机制,该研究首先重组表达了FcμR-D1结构域和IgM-Cμ4结构域的复合体,并解析了其晶体结构。结果表明,2个FcμR-D1分别结合在1个IgM-Cμ4二聚体的两侧。与最近解析的IgM型BCR复合体结构进行比较,发现FcμR的存在不影响IgM与Igα/Igβ(CD79α/CD79β)亚基的结合,与之前研究结果一致。
接下来,研究团队进一步利用冷冻电镜技术解析了IgM五聚体核心区和FcμR胞外域组成的复合体结构。结果表明,FcμR能够以4:1的比例结合在IgM五聚体的同一侧,暗示IgM五聚体可能通过诱导FcμR四聚体的形成起始下游信号。Stalk区可能进一步介导4个FcμR分子之间的相互作用,促进其结合于IgM五聚体的同一侧。有趣的是,在上述4个FcμR结合位点中,高亲和力R1位点与分泌型IgM中分泌成分D1结构域的结合位点基本重叠;但之前研究表明FcμR可以结合携带分泌成分的分泌型IgM并调节其在黏膜侧的逆向转运,从而参与抗原呈递过程。
那么FcμR是如何结合分泌型IgM的?为了回答这一问题,该研究进一步利用冷冻电镜技术解析了FcμR与分泌型IgM核心区形成的复合物结构,发现当分泌成分存在时,4个FcμR则同时结合在IgM平面的另外一侧。值得一提的是,结构分析表明J链在IgM平面两侧以不同方式引发了不对称性,使得不管在哪一侧,IgM五聚体最多都只能结合4个FcμR分子。
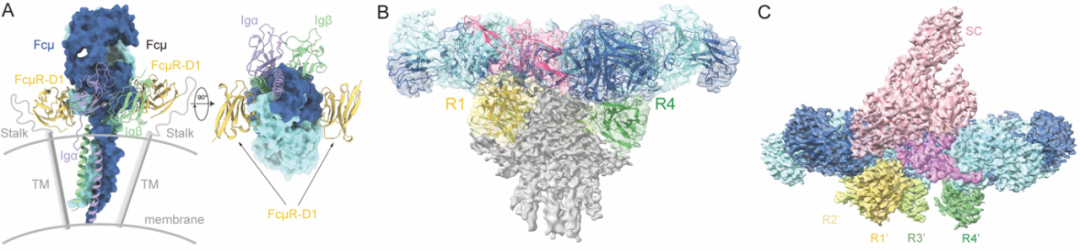
图1:FcμR受体对膜结合型 IgM、IgM五聚体和分泌型IgM的识别模型
为了评估上述研究的功能相关性,研究团队进一步设计了FcμR突变体,并通过体外蛋白互作、荧光共聚焦显微镜、流式细胞术等手段对上述结果进行了验证。总之,该研究通过结构生物学、生物化学和细胞生物学等手段揭示了FcμR特异性感知不同形式IgM的分子机制,为深入理解IgM的生物学功能奠定了基础。


