Nature Nanotechnology:松弛素通过肝巨噬细胞外泌体缓解肝纤维化
时间:2021-04-12 18:01:27 热度:37.1℃ 作者:网络
外泌体(Exosome)是由活细胞分泌的直径约为30-150 nm的小囊泡,具有典型的脂质双分子层结构,广 泛存在于血液、唾液、尿液、脑脊液和乳汁等体液中,携带有多种蛋白质、脂类、RNA等重要信息,在细胞与细胞间的物质和信息传递中起重要作用。近日,北卡罗来纳大学黄力夫教授团队在Nature Nanotechnology杂志(IF 31.538)上发表文章,揭示了松弛素诱导的巨噬细胞外泌体miR-30a-5p通过靶向ASK1使肝星状细胞失活,从而达到缓解肝纤维化的作用机制。
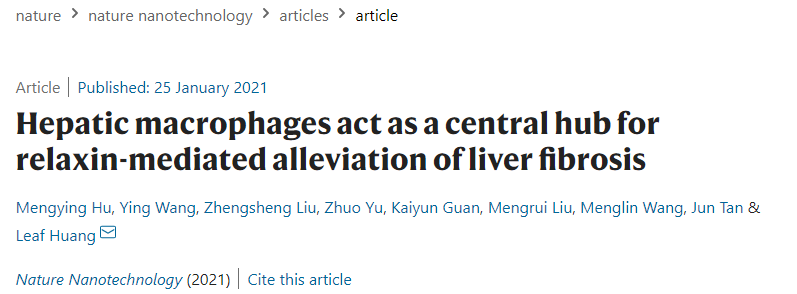
活化的肝星状细胞(aHSCs)是肝纤维化的主要效应细胞,通过产生过多的细胞外基质(ECM)来应对慢性肝损伤。松弛素(RLN)是一种抗纤维化的肽类激素,之前被认为可以直接逆转肝星状细胞的激活,从而解决肝纤维化问题。在纤维化解决期间,骨髓来源的Ly6Chi巨噬细胞发生表型转换,成为Ly6C低表达(Ly6Clo)亚型。探究巨噬细胞表型转换的机制以及其随后与aHSC相互作用以缓解肝纤维化的机制可为肝脏抗纤维化治疗提供新的策略。
利用纳米粒子介导的递送,黄力夫教授团队发现,虽然在体内纤维化肝脏中增强松弛素的表达具有很强的抗纤维化功效,但体外治疗无法逆转激活的肝星状细胞为静态表型,表明aHSCs周围的微环境促进了松弛素介导的抗纤维化作用。进一步探究发现,RXFP1在肝巨噬细胞表面表达,而松弛素与RXFP1结合后通过激活孤核受体Nur77促进了巨噬细胞表型从Ly6Chi转变为Ly6Clo,而这一切都是巨噬细胞释放的外泌体在其中发挥作用。
具体来说,松弛素处理的巨噬细胞分泌的外泌体中miR-30a-5p的表达上调,被aHSCs吸收后靶向凋亡信号调节激酶1(ASK1),同时还可以对抗aHSCs促纤维化激活引起的过氧化物酶体增殖体激活受体-γ(PPAR-γ)的表达不足。而PPAR-γ表达上调后会使aHSCs对松弛素介导的失活敏感。最后,研究团队还证实,miR-30a-5p靶向递送aHSCs后可增强松弛素的基因治疗疗效。
松弛素诱导的巨噬细胞外泌体miR-30a-5p通过靶向ASK1使aHSCs失活
该研究中,黄力夫教授团队通过整合纳米技术和基础科学,发现巨噬细胞是失活aHSC治疗肝纤维化与松弛素的中心枢纽。更重要的是,研究团队发现,尽管aHSCs表面RXFP1的表达增强,它们对松弛素处理仍然不强,其原因可能是高度表达上调的应激激活蛋白激酶(ASK1)响应促纤维化的激活,从而抑制松弛素与RXFP1的下游效应器(PPAR-γ)。然而,松弛素诱导的抗纤维化巨噬细释放的外泌体miR-30a-5p会抑制ASK1的表达,从而恢复松弛素介导的PPAR-γ激活和抗纤维化作用。
总之,该研究刻画了松弛素诱导的巨噬细胞表型切换的顺序步骤,突出了巨噬细胞在松弛素激发的肝纤维化缓解中发挥的关键作用,揭示了抗纤维化巨噬细胞和aHSCs之间的串扰关系,提供了一种可安全有效改善肝纤维化的组合基因疗法(pRLN+miR-30a-5p)。
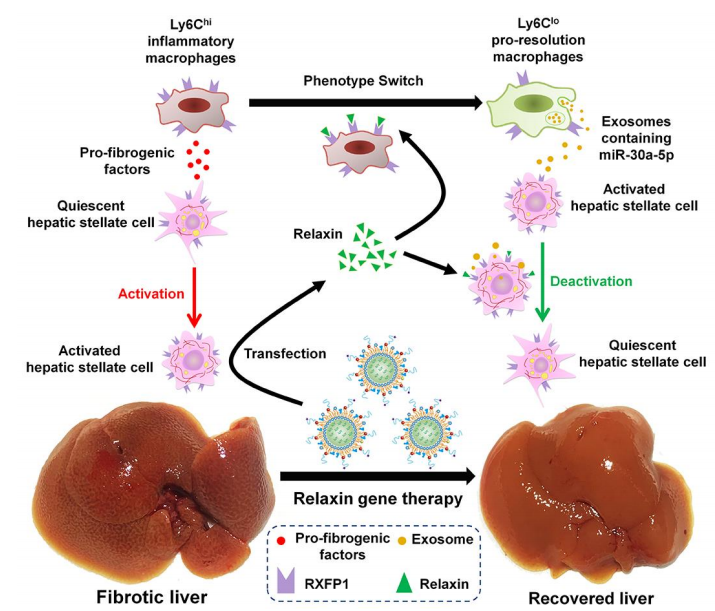
松弛素基因疗法在肝脏抗纤维化作用中的步骤模型
原始出处:
HuM, et al. Hepatic macrophages act as a central hub for relaxin-mediated alleviation of liver fibrosis. Nat Nanotechnol. 2021 Jan 25. doi:10.1038/s41565-020-00836-6.


