全球五大口服治疗新冠病毒感染药物研发进展,未来是抗新冠病毒主要力量
时间:2021-10-02 18:01:17 热度:37.1℃ 作者:网络
新冠病毒感染,疫苗是主要预防措施之一,但是口服药物同样重要,甚至成为未来决定性治疗手段之一!
目前针对新冠病毒的口服药物(多为小分子治疗药物),目前已取得不错的进展。目前至少有5种治疗药物处于研发后期,预计在今年molnupiravir有望在美国上市:
(1)molnupiravir,默沙东研发;
(2)PF-07321332,辉瑞的口服3CL蛋白酶抑制剂,这个分子目前也正式进入III期临床试验了;
(3)s217622,日本盐野义公司口服3CL蛋白酶抑制剂,目前也正在III期临床试验,官方消息接近尾声了
(4)普克鲁胺,开拓药业研发的,是雄激素受体拮抗剂;
(5)AT-527,罗氏公司的,和Remdesivir和molnupiravir同属于RdRp抑制剂,目前进展也是III期。
1、molnupiravir,莫拉匹韦
近日,最先披露三期临床数据的是默沙东与Ridgeback研发的Molnupiravir,该3期临床试验因为疗效太好,而提前结束。该研究以775名患有轻度至中度新冠肺炎的成年人为对象,由于存在肥胖、糖尿病或心脏病等健康问题,他们被认为患病风险更高。
Molnupiravir治疗轻度至中度新冠肺炎患者的三期临床中期数据,Molnupiravir治疗组的住院或死亡率为7.3%(28/385),对照组的住院或死亡率为14.1%(53/377),Molnupiravir降低住院或死亡率50%,p=0.0012。死亡率方面,治疗组没有死亡,对照组有8例死亡。

2、普克鲁胺(Proxalutamide,GT0918)——开拓药业
普克鲁胺是开拓药业研发的一款AR(雄激素受体androgenreceptor)拮抗剂。据开拓药业相关研究,普克鲁胺通过抑制雄激素受体功能,从转录水平下调ACE2和TMPRSS2的表达,进而阻断SARS-CoV-2进入宿主细胞。
细胞膜上的ACE2是新冠病毒Covid-19的受体,通过结合新冠病毒刺突蛋白(S蛋白)的S1结构域,允许病毒进入宿主细胞。而跨膜丝氨酸蛋白酶(TMPRSS2)对病毒S蛋白和ACE2均有剪切作用,使得二者更易结合,从而促进病毒进入宿主细胞。激活的雄激素受体(androgenreceptor,AR)则可诱导跨膜丝氨酸蛋白酶(TMPRSS2)的表达。
普克鲁胺原本是一款治疗前列腺癌的药物,据说因偶然观察到前列腺癌患者似乎在新冠恶化程度上低于普通人,开拓药业在2020年2月通过实验发现,普克鲁胺可以降解ACE2和TMPRSS2蛋白。同时跟其他的AR药物相比,普克鲁胺还可以进一步调低AR基因表达,因此更具备治疗新冠的可能性。
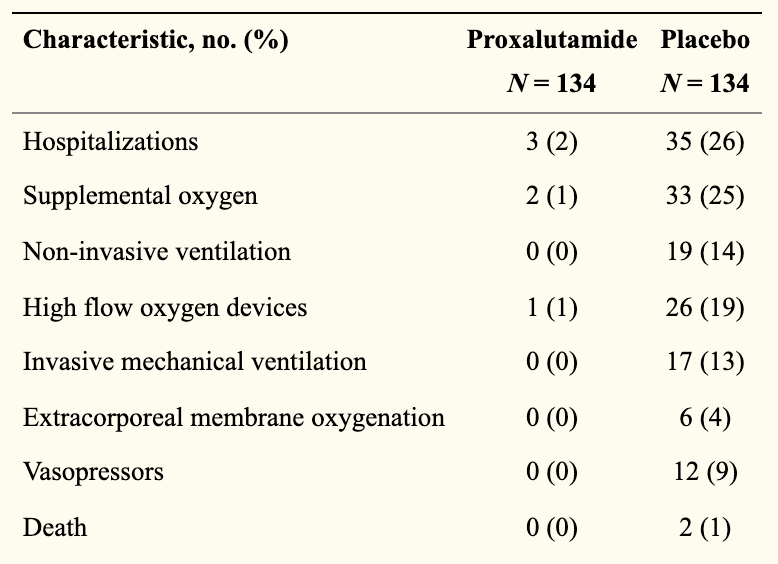
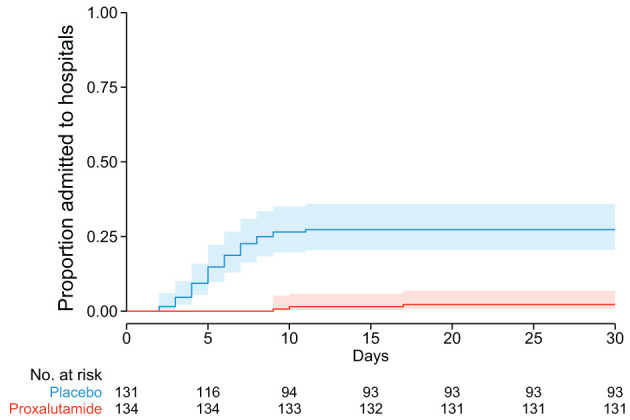
而且抗病毒的效果同样十分理想,这更难以令人置信。

而对于新冠重症患者,普克鲁胺可能存在另一条通路,能够抑制免疫风暴和炎症风暴,但目前仍未被证实。此外,该款药物可能还具备某些未被发现的作用于新冠病毒之疗效机制。
不过,结果也广泛受到质疑。
开炮最猛的,是美国国立医学院院士 Eric Topol博士,他一直关注新冠并写了多篇新冠研究文章。他说,这些结果好得令人很难相信,不要说在新冠方面,在整个医学史上,都几乎没有其他任何医学干预有过这么惊人的疗效。
Topol博士认为,试验对照组中的病死率很高,几乎是50%,这样一对比就会让实验组的P药看起来效果特别惊人。另外有一位巴西重症科Pecanha医生说,这个试验二月初才开始,但是三月份就汇报了中期结果,在不到30天的时间里需要入组600名患者,然后还得监测患者,这个速度快得令人怀疑。
但是作者回复说,对照组死亡率这么高并不奇怪,因为当时gamma变种在巴西流行,死亡率在做试验的州高达43%。至于实验做得这么快,他说,临床试验的患者几天内就可以康复出院了,其他病人则争先恐后地接着参加实验。
这篇预印本曾经投给《新英格兰医学杂志》,但是被拒了。作者去询问为什么,主编在电子邮件回复中说,你们的结果出乎意料的好,审核文章的专家认为光看分析数据是不够的,必须看到原始数据,可是杂志没有能力花那么多时间审阅所有的原始资料。后来,英国的《柳叶刀》也据了这篇文章。
最终2期临床试验发表在不知名的期刊Front Med (Lausanne)上。这是结果太好,令人难以置信,而被期刊拒绝发表。
公司将此结论发表后,引起巴西一位学者的关注,并开启了研究者发起临床试验(即三方研究者而非药物研发者执行的试验),报告出显著效果。公司接下来利用此数据,在全球多地滚动提交申请,进行大规模3期临床试验。目前已获得巴拉圭的紧急使用授权,多个主流国家正在审批中。
而对于新冠重症患者,普克鲁胺可能存在另一条通路,能够抑制免疫风暴和炎症风暴,但目前仍未被证实。此外,该款药物可能还具备某些未被发现的作用于新冠病毒之疗效机制。
主要临床试验进展:
①巴西研究者发起的试验,针对新冠重症患者(已完成)
此前,普克鲁胺在巴西的研究者发起临床中的对安慰剂的新冠重症患者的实验中效果优异,590例患者,1:1分配治疗组和安慰机组,14天给药,所有结果p<0.0001。
美国注册,针对门诊新冠轻中症患者的临床3期试验(正在进行)
研究方式:比较GT0918加标准护理(Standard of care, SOC)与安慰剂加SOC。约668名受试者将随机分配到GT0918加SOC或安慰剂加SOC组。
入组标准:出现症状后5天内有一种或多种轻度或中度症状与COVID-19相关的症状。
主要终点:28天内住院率。
预计主要完成时间:2021年8月24日
3、AT-527——罗氏/Atea
AT-527(RO7496998)也是RNA聚合酶抑制剂,AT-527进入人体后可转化为游离碱AT-511(抗新冠病毒EC90达到0.47μM),随后能够生成抗新冠病毒活性更高的三磷酸代谢产物AT-9010,体外抗新冠病毒活性较Molnupiravir高5-8倍。由于AT-527可以靶向包括RNA依赖性RNA聚合酶(RdRP)在内的两种对病毒RNA复制和转录至关重要的聚合酶,因此对新冠病毒具有独特的双重抑制机制。
该药物由Atea公司研发,罗氏以3.5亿美元前期付款和后续里程碑付款获得了AT-527在美国以外治疗COVID-19的权益。公司认为,该款药物不但可以作为口服疗法治疗住院COVID-19患者,而且可能成为非住院患者的首个口服治疗选择,还具有作为暴露后预防性治疗的潜力。
2021年6月30日,Atea公司发布了AT-527临床II期双盲治疗住院患者的初步数据:62例患者,550mgBID,给药5天,在接受治疗的第2天,与安慰剂相比,AT-527组的病毒载量下降了0.7log(80%);在第14天,AT-527组47%的患者转阴,安慰机组22%的患者转阴。
从AT-527的2期数据目前看来不如Molnupiravir,但公司表示未来有潜力用作暴露后预防性治疗可作为关注点。同时,公司在临床设计上与默克也采取了差异性方案,以症状开始缓解时间作为主要目标,预计年内将有3期数据公布。
另外,也有研究显示,AT-527不能抑制新冠病毒的复制。
主要临床试验进展:
①美国注册,针对门诊新冠轻中症患者的临床3期试验(正在进行)
研究方式:该研究是多中心试验,比较AT-527与安慰剂针对轻中型成年和青少年新冠患者疗效。约1386名受试者将随机分配到实验组和安慰剂组。
入组标准:出现症状后5天内有一种或多种轻度或中度症状与COVID-19相关的症状。
主、次要终点:口服550mgAT-527,每天两次(BID),持续5天。主要终点:缓解或改善COVID-19症状的时间(21.5小时)[时间范围:最多29天]新症状的缓解被定义为从随机化到分数保持为0或1至少21.5小时的时间长度;次要终点:缓解或改善COVID-19症状的时间(43小时)[时间范围:最多29天]新症状的缓解被定义为从随机化到分数保持0或1至少43小时的时间长度。
预计主要完成时间:2021年8月3日
4、PF-07321332——辉瑞
PF-07321332是一款3CL蛋白酶抑制剂,它在多种冠状病毒的生命周期中起到重要作用,其潜在优势是对目前所有的新冠病毒变种都可以产生作用。
PF-07321332单药在分子水平对新冠病毒的抑制活性IC50为19nM,在可表达ACE2蛋白的人气道上皮细胞、HeLa和A549细胞中PF-07321332单药对病毒抑制活性EC50分别为62、99和56nM,表现出良好的抗病毒活性。
辉瑞的PF-07321332具备广谱抗新冠病毒能力,意味着其潜力很大,虽然理论上病毒仍可能发生变异逃过其作用机制,但实际发生的机会很小。辉瑞在业绩电话会上同样认为该药物有望在今年4季度获得EUA,目前临床试验中辉瑞采用的是PF-07321332+利托那韦的联合疗法。
主要临床试验进展:
美国注册,针对门诊新冠轻中症患者的临床3期试验(正在进行)
9月1日,辉瑞公告完成新冠药物PF-07321332的轻症2/3期临床首例患者入组给药。
研究方式:该研究是多中心试验,比较PF-07321332/利托那韦与安慰剂针对轻中型成新冠患者疗效。约3000名受试者将随机分配到实验组和安慰剂组。
入组标准:出现症状后5天内有一种或多种轻度或中度症状与COVID-19相关的症状。总研究时间长达24周。
主、次要终点:主要终点:因任何原因导致COVID-19相关住院或死亡的参与者比例[时间范围:第1天至第28天]。次要终点:PF-07321332/利托那韦相对于安慰剂的不良事件(AE)和严重不良事件(SAE)的发生率[时间范围:第1天至第34天];新冠症状的持续/严重时间[时间范围:第1天到第28天]
预计主要完成时间:2021年10月5日
5、s217622 日本盐野义公司口服3CL蛋白酶抑制剂
盐野义公司在流感等抗病毒药物开发处于全球领先地位,我们熟知的治疗流感的奥司他韦、巴洛沙韦均由它开发,最终授权罗氏进行销售。
新型冠状病毒(SARS-CoV-2)有一种叫做3CL蛋白酶的酶,对病毒的增殖至关重要,而S-217622 通过抑制 3CL 蛋白酶来抑制 SARS-CoV-2 的生长。在使用 SARS-CoV-2 感染动物的非临床研究中,已经证实病毒载量迅速显着降低。一期临床试验于 2021 年 7 月在日本开始,目前正在进行针对轻度 COVID-19 或无症状 SARS-CoV-2 感染患者的 2/3 期临床试验。
在 2021 年 7 月开始的 1 期试验中,S-217622 没有显示出严重的安全性问题,药代动力学超过了目标血药浓度。 在动物模型中,接受治疗后病毒载量迅速下降。 Shionogi 还宣布了到 2022 年 3 月生产 100 万剂 COVID-19 治疗剂供国内使用的计划。
相关文献:
McCoy J, Goren A, Cadegiani FA, Vaño-Galván S, Kovacevic M, Situm M, Shapiro J, Sinclair R, Tosti A, Stanimirovic A, Fonseca D, Dorner E, Onety DC, Zimerman RA, Wambier CG. Proxalutamide Reduces the Rate of Hospitalization for COVID-19 Male Outpatients: A Randomized Double-Blinded Placebo-Controlled Trial.Front Med (Lausanne). 2021 Jul 19;8:668698
Cadegiani FA, McCoy J, Gustavo Wambier C, Vaño-Galván S, Shapiro J, Tosti A, Zimerman RA, Goren A. Proxalutamide Significantly Accelerates Viral Clearance and Reduces Time to Clinical Remission in Patients with Mild to Moderate COVID-19: Results from a Randomized, Double-Blinded, Placebo-Controlled Trial.Cureus. 2021 Feb 22;13(2):e13492
Khoo SH, Fitzgerald R, Fletcher T, Ewings S, Jaki T, Lyon R, Downs N, Walker L, Tansley-Hancock O, Greenhalf W, Woods C, Reynolds H, Marwood E, Mozgunov P, Adams E, Bullock K, Holman W, Bula MD, Gibney JL, Saunders G, Corkhill A, Hale C, Thorne K, Chiong J, Condie S, Pertinez H, Painter W, Wrixon E, Johnson L, Yeats S, Mallard K, Radford M, Fines K, Shaw V, Owen A, Lalloo DG, Jacobs M, Griffiths G. Optimal dose and safety of molnupiravir in patients with early SARS-CoV-2: a Phase I, open-label, dose-escalating, randomized controlled study.J Antimicrob Chemother. 2021 Aug 27:dkab318
Do TND, Donckers K, Vangeel L, Chatterjee AK, Gallay PA, Bobardt MD, Bilello JP, Cihlar T, De Jonghe S, Neyts J, Jochmans D.A robust SARS-CoV-2 replication model in primary human epithelial cells at the air liquid interface to assess antiviral agents.Antiviral Res. 2021 Aug;192:105122


