老药西地兰“焕发第二春”?强心小菜一碟,抗癌还有一手!
时间:2021-12-02 10:01:58 热度:37.1℃ 作者:网络
前列腺癌(PCa)是世界范围内的一种常见恶性肿瘤,到2020年估计影响140万男性。虽然前列腺癌的死亡率自上世纪90年代中期开始下降,但它仍然是男性癌症致死的主要原因,2020年估计导致37.5万男性死亡。其中,大多数晚期PCa患者最终发展为转移性去势抗性PCa (mCRPC),这种PCa对不同治疗的反应有限,并最终在两年内杀死患者。因此,开发更有效的治疗晚期前列腺癌的药物迫在眉睫。

强心苷是一类类固醇类化合物,主要通过抑制Na+/K+-ATP酶,广泛用于治疗多种心脏疾病,如心律失常和低血压。最近,在体外和体内的研究表明,一些强心苷能通过杀死衰老细胞、诱导凋亡或将循环肿瘤细胞簇解离为单个细胞以抑制转移,发挥抗癌活性。一些强心苷也在前列腺癌中进行了测试,不同的强心苷似乎具有不同的机制,具有不同的效果。然而,去乙酰毛花苷(西地兰)在包括前列腺癌在内的各种癌症中的抗癌作用还没有被研究过。本研究中旨在评估西地兰是否在PCa细胞中也具有抗癌活性。

1、西地兰苷在体内外对PCa细胞具有抗肿瘤作用
为评估西地兰对晚期PCa的影响,本研究选择ar阳性的22Rv1和ar阴性的PC-3和DU 145 PCa细胞株,分析细胞活力、集落形成和肿瘤发生。CCK8分析表明,在24和48小时,西地兰均显著降低了每个细胞株的活细胞,并呈剂量依赖性(图1A)。当西地兰剂量较高(22Rv1≥5 nM, PC-3≥123 nM,;du145≥123 nM)时,较长时间的处理(48 h)能杀死更多的癌细胞(图1A)。在22Rv1、PC-3和DU 145中,西地兰48 h的IC50分别为8410、370和180 nM。本研究还评估了西地兰处理后正常人前列腺上皮细胞(RWPE-1)上的细胞活力。结果表明,西地兰对RWPE-1细胞24 h和48 h的IC50值分别为10.17和8.84 μ M,表明其对非肿瘤RWPE-1细胞的细胞毒作用低于前列腺癌细胞。
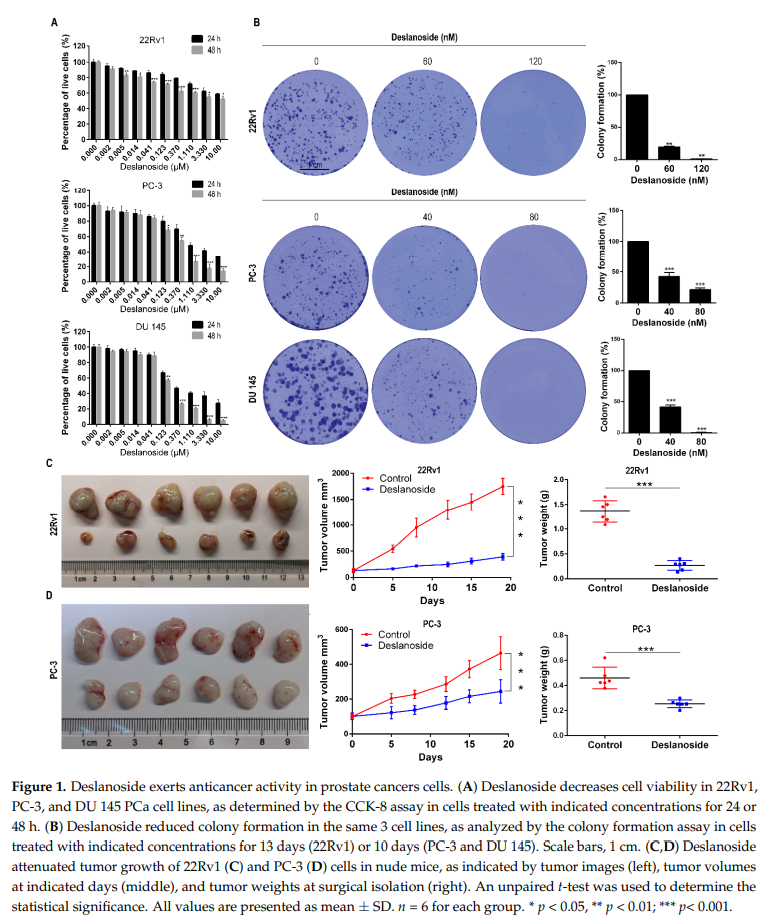
基于这些IC50值,在22Rv1和PC-3和DU - 145细胞系中分别使用0、60和120 nM的西地兰进行集落形成实验和其他所有体外实验。如图1B所示,所有检测浓度下西地兰均显著减少集落数量,且在三种细胞系中,高剂量比低剂量的效果更明显(图1B)。西地兰组的集落规模也小于对照组(图1B,左)。
接着研究西地兰在22Rv1和PC-3异种移植模型中的治疗效果。首先测试不同剂量的西地兰(1、5、10、20、40和60 mg/kg BW)对小鼠的毒性。西地兰的MTD小于20 mg/kg体重,选择5 mg/kg BW剂量进行治疗试验。在小鼠皮下注射肿瘤细胞,当肿瘤体积增长到约150mm3时,每个细胞系随机分为两组。一组给予西地兰5 mg/kg每日ip,连续3周,5天/周,另一组给予对照液。西地兰在22Rv1和PC-3异种移植瘤模型中均显示出显著的肿瘤生长抑制作用,从肿瘤图像(图1C,D,左)、肿瘤体积(图1C,D,中)和实验结束时的肿瘤右侧(图1C,D,右)可以看出。
与ar阴性的PC-3细胞相比,ar阳性的22Rv1细胞的治疗效果更强,22Rv1和PC-3细胞的肿瘤抑制率分别约为80%和55%。小鼠体重在整个实验过程中保持不变(图S1A),各组主要脏器(心、肺、脾、肾)均无明显病理改变(图S1B)。我们在西地兰治疗的小鼠肝脏中观察到一些肝脏脂肪变性,这可能与药物对脂质代谢的影响有关,如下面的生物信息学分析所示(图6A)。
2、西地兰对肿瘤生长的抑制作用涉及G2/M细胞周期阻滞
为了解西地兰抗癌活性的细胞机制,采用免疫组化检测22Rv1和PC-3异种移植瘤中增殖细胞标记Ki67的表达。在22Rv1和PC-3肿瘤中,西地兰显著降低了ki67阳性细胞的比率(图2A),表明地山苷抑制细胞增殖以减缓肿瘤生长。
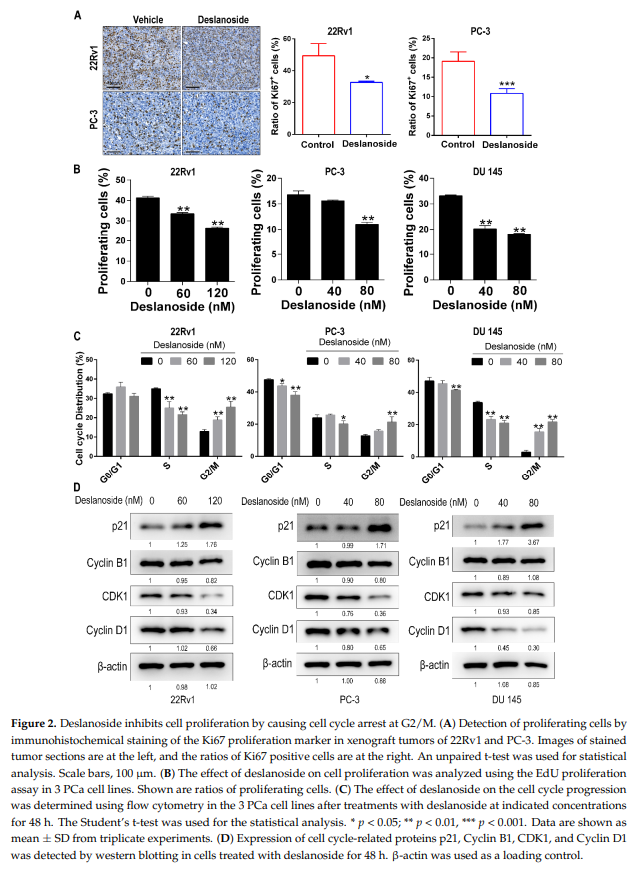
为进一步确定西地兰对细胞增殖的影响,采用流式细胞仪分析22Rv1、PC-3和DU 145 PCa细胞系,测量EdU掺入,这表明DNA合成。西地兰显著降低了各细胞系的DNA合成,且剂量越大效果越明显(图2B和S2A),为西地兰抑制细胞增殖的作用提供了直接证据。用流式细胞术分析西地兰对细胞周期的影响。在测试的三个PCa细胞系中,西地兰在G2/M期引起明显的细胞积累,而在G1和S期细胞减少(图2C)。
我们还分析了几个细胞周期调控蛋白,包括p21, Cyclin D1,以及G2/M检查点相关蛋白Cyclin B1和CDK1在PCa细胞中的表达。三种细胞系中至少有两种不同程度地上调了p21的表达,同时下调了Cyclin B1、CDK1和Cyclin D1(图2D),进一步支持了西地兰对细胞周期进程的抑制作用。
3、西地兰可引起PCa细胞凋亡
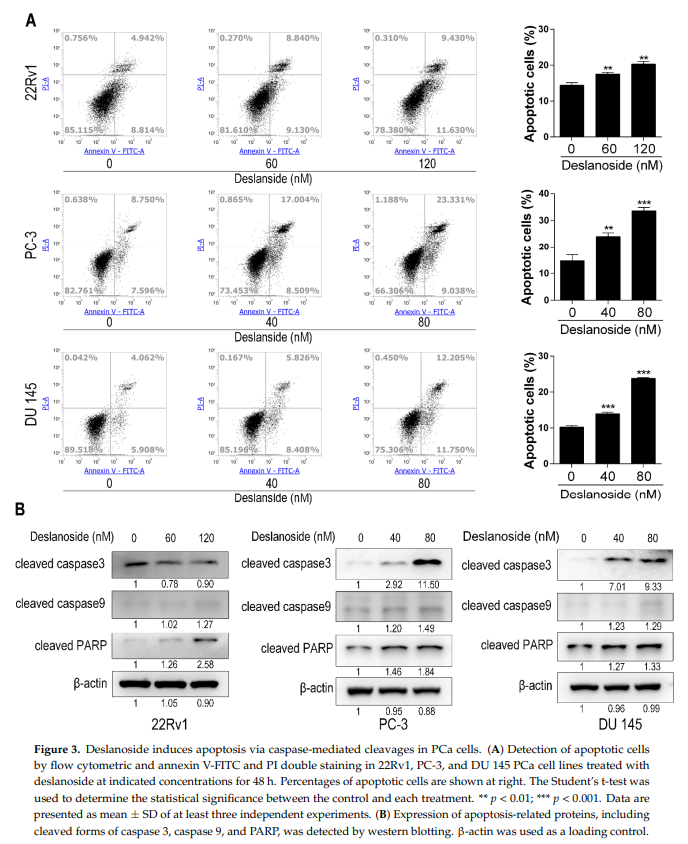
为确定西地兰是否引起前列腺癌细胞凋亡,用西地兰处理22Rv1、PC-3和DU 145前列腺癌细胞,并用流式细胞术检测凋亡细胞。地皂苷处理48 h后,三种细胞系中每一种的细胞凋亡百分比均显著增加,且呈剂量依赖性(图3A)。
我们还通过Western blotting分析了凋亡相关蛋白的表达,包括cleaved caspase-3, caspase-9和PARP。西地兰增加了三种蛋白在至少两种细胞系中的表达(图3B)。意外的是,22Rv1细胞中cleaved - caspase-3减少(图3B)。
4、西地兰抑制前列腺癌细胞的迁移和侵袭能力
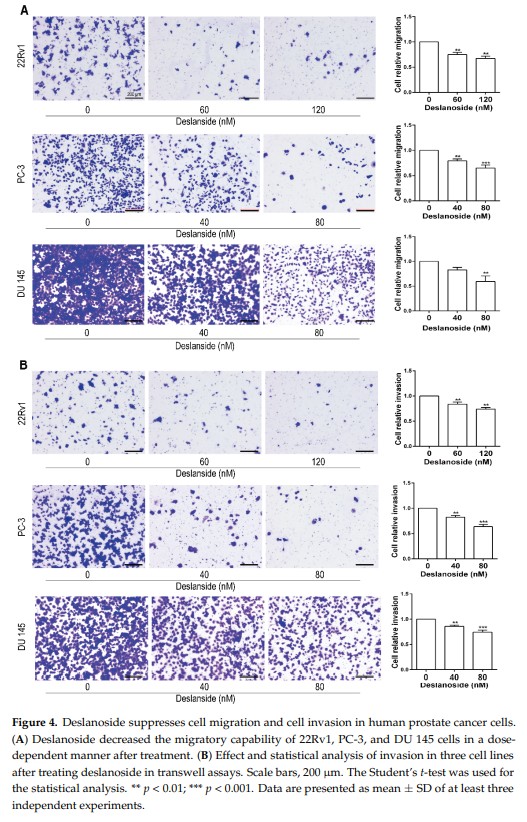
转移导致超过90%的癌症相关死亡,且常发生在晚期PCa患者中。通过transwell试验评估西地兰对三种类型前列腺癌细胞迁移能力的影响。西地兰处理导致了迁移细胞数目的显著减少,表明西地兰对细胞迁移的抑制作用(图4A)。为评估西地兰对前列腺癌细胞侵袭的影响,transwell数据显示与对照组相比,西地兰处理组肿瘤细胞的侵袭能力要低得多(图4B)。这些结果表明西地兰在体外抑制了前列腺癌细胞的迁移和侵袭。
5、西地兰改变多种生物过程和信号通路
为探索西地兰在PCa细胞中抗癌活性的分子机制,对22Rv1和PC-3细胞进行了rna测序。结合校正p值<0.05和|log2FoldChange|<1,我们鉴定出了大量的差异表达基因(DEGs)。火山图显示,PC-3和22Rv1细胞中分别有701和1085个DEGs(图5A)。这些DEGs中有141个在两种细胞系中有差异表达,其中84个表达上调,46个表达下调(图5B)。然而,141个基因中有11个基因在经西地兰处理后,在两株细胞系之间的表达变化趋势相反(图5B),我们将这11个基因排除以进行进一步分析。
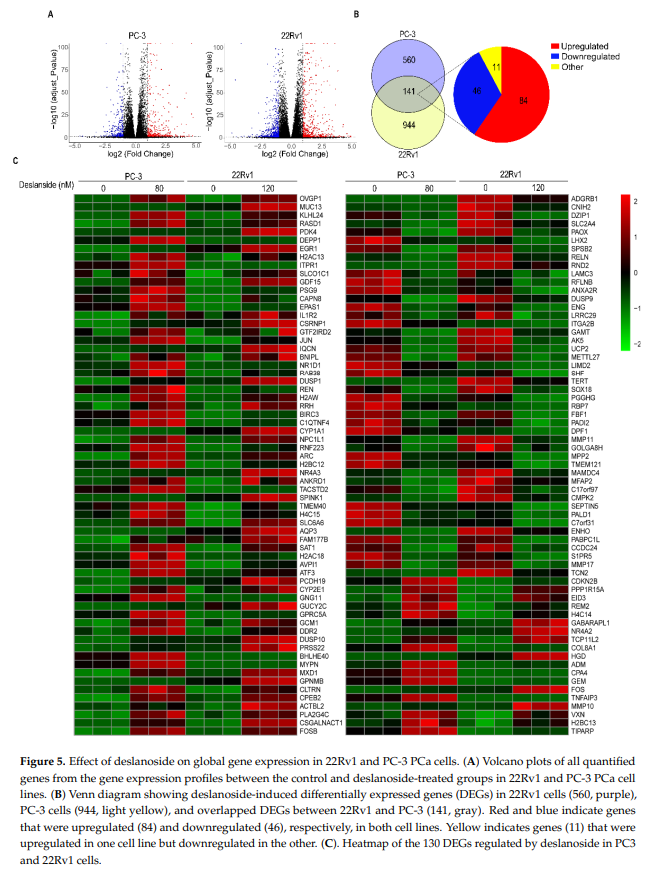
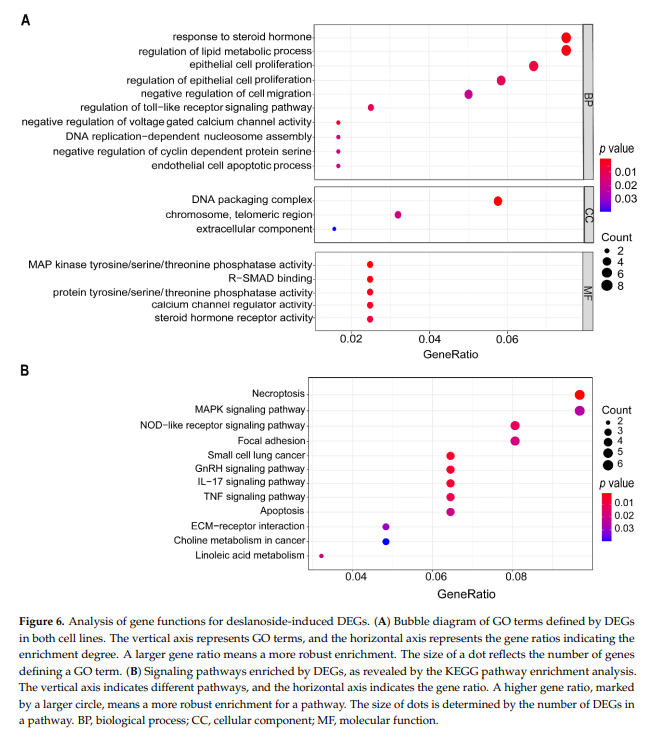
我们对130个基因进行了GO term富集分析和KEGG pathway分析,在22Rv1和PC-3细胞株中均表现出相同的表达变化趋势。GO富集分析显示,富集较多基因的生物过程包括“对类固醇激素的反应”、“脂质代谢过程”、“上皮细胞增殖”、“细胞迁移”、“电压门控钙通道活性”、“DNA复制”、“周期蛋白依赖性丝氨酸/苏氨酸激酶活性”、“细胞凋亡”、等(图6)。
在KEGG通路分析中,西地兰处理后多种信号通路均明显富集,包括坏死、MAPK、NOD样受体、局灶粘附、小细胞肺癌、GnRH、IL-17、TNF、凋亡、ecm受体相互作用、癌症中的胆碱代谢、亚油酸代谢等信号通路(图6B)。这些信号通路中的大多数与癌症相关,为西地兰的抗癌活性提供了机理上的见解。
6、15个西地兰调控基因的表达水平与前列腺癌患者的生存相关
为进一步确定130个西地兰调节基因在人类前列腺癌中的重要性(图5),使用TCGA PCa数据库和单变量Cox回归分析评估了一个基因表达水平与无病生存期(DFS)和总生存期(OS)的相关性。总的来说,17个基因的高表达水平与较差的RFS显著相关,包括ITGA2B、C1QTNF4、CDKN2B、CNIH2、FBF1、PABPC1L、MMP11、DUSP9、TMEM121、COL8A1、SOX18、SLC6A6、CMPK2、GPNMB、CYP2E1、MAMDC4和REM2(表1)。
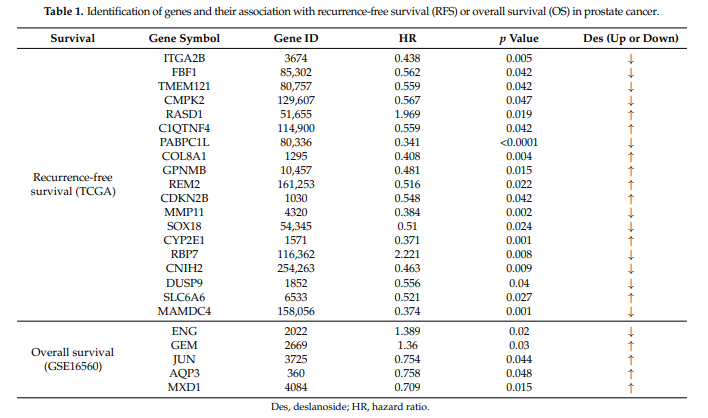
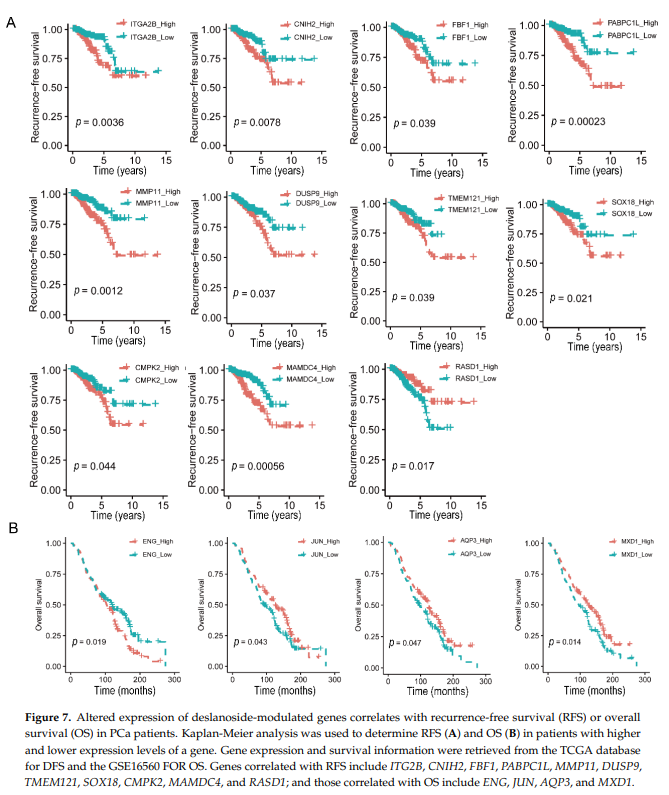
同时,有两个表达水平较高的基因与更好的DFS相关,包括RASD1和RBP7(表1)。在这17个基因中,有10个基因被西地兰下调,包括ITG2B、CNIH2、FBF1、PABPC1L、MMP11、DUSP9、TMEM121、SOX18、CMPK2和MAMDC4(图5C和7A),提示这些基因具有致癌作用。与此同时,两个上调与更好的生存率相关的基因之一RASD1的表达被西地兰上调,表明RASD1具有抑癌功能(图5C和7A)。Kaplan-Meier分析证实了单变量Cox回归分析的结果(图7,表1)。
我们还在有OS信息的GSE16560数据集中进行了单变量Cox回归分析。ENG和GEM表达水平越高,OS越差,且ENG被西地兰下调(表1,图7B),表明ENG在PCa细胞中具有致癌功能。高水平的JUN, MXD1, AQP3与较好的OS相关(表1,图7B),并且这三种蛋白都被西地兰上调(图5C),表明它们在PCa中具有抑瘤作用。Kaplan-Meier分析再次证实了单变量Cox回归分析的结果(图7,表1)。
综上,本研究使用三种PCa细胞系,发现西地兰在体外减少了集落形成,并减弱了裸鼠的肿瘤生长。在细胞层面上,西地兰将细胞周期阻滞在G2/M,引起细胞凋亡并伴有一致的分子变化。基因组分析表明西地兰改变了130个基因的表达,其中包括许多癌症相关的细胞过程和信号通路。15个西地兰调节基因表达水平的改变与PCa患者的无病生存期或总生存期显著相关。
综上所述,本研究证明了另一种强心苷西地兰通过诱导细胞周期阻滞和细胞凋亡抑制人前列腺癌细胞的生长。从机制上讲,西地兰调节多种生物过程和信号通路下的基因表达。有15个与DFS或OS相关的基因,包括AQP3、CMPK2、CNIH2、DUSP9、ENG、FBF1、ITGA2B、JUN、MAMDC4、MMP11、MXD1、PABPC1L、RASD1、SOX18和TMEM121的表达变化趋势与地皂苷的抗肿瘤活性一致。虽然这15个基因中的大部分在癌症的进展中发挥了作用,但其中4个以前没有涉及到癌症,这为理解西地兰如何抑制前列腺癌细胞的生长提供了新的候选基因。这些发现也表明,与许多其他强心苷一样,西地兰通过改变广泛的信号通路在PCa细胞中发挥抗癌活性,为强心苷转化为抗癌药物提供了另一种候选。
原文来源:
Mingcheng Liu, et al.The Cardiac Glycoside Deslanoside Exerts Anticancer Activity in Prostate Cancer Cells by Modulating Multiple Signaling Pathways. Cancers 2021, 13, 5809.
https://doi.org/10.3390/cancers13225809.


