一文让你变成胃肠黏膜保护专家(深度好文,建议收藏)
时间:2022-12-26 17:59:27 热度:37.1℃ 作者:网络
一文让你变成胃肠黏膜保护专家(深度好文,建议收藏)
胃肠道黏膜覆盖全部胃肠道,具有重要的生理学作用。既往研究主要聚焦在胃黏膜的损伤与防护,近来随着检查方式的进步,肠道黏膜尤其是小肠黏膜的损伤机制和屏障保护也日益受到关注。胃黏膜保护药是胃炎、胃和十二指肠溃疡等疾病的辅助治疗用药。对于胃炎合并胃黏膜糜烂、出血和症状明显的患者,应用胃黏膜保护药可促进胃黏膜糜烂愈合。对于老年人消化性溃疡、难治性溃疡、巨大溃疡和复发性溃疡,在抑制胃酸、根除幽门螺杆菌治疗的同时,联合应用胃黏膜保护药,可提高消化性溃疡的愈合质量,有助于减少溃疡的复发。
一、胃肠道黏膜屏障与防护
【1】胃肠道是人体最大的黏膜屏障,是立体网络防护结构,包括机械屏障、化学屏障、免疫屏障和生物屏障,也包括内分泌和神经系统。
胃肠道代表人体最大的黏膜表面,是人体最大的屏障器官。胃肠道黏膜屏障是一个立体的防护结构,由机械屏障、化学屏障、免疫屏障和生物屏障共同构成。机械屏障指完整的彼此紧密连接的肠黏膜上皮结构,由肠黏膜上皮细胞及其分泌的黏液、细胞间紧密连接、上皮基膜和上皮表面的菌膜共同构成,是物理性屏障。化学屏障由胃肠道分泌的胃酸、胆汁、各种消化酶、溶菌酶、黏蛋白,以及肠腔内正常寄生菌产生的抑菌物质构成,具有灭活病原微生物的作用和润滑作用,以保护胃肠道黏膜免受物理化学损伤。免疫屏障包括天然免疫屏障和适应性免疫屏障,由肠黏膜淋巴组织、细胞和肠黏膜表面的分泌型抗体构成。生物屏障由正常的肠道菌群构成,其与宿主的微空间结构形成既相互依赖又相互作用的微生态系统,是对抗病原体的重要的功能性保护屏障。目前研究表明,肠道微生态不仅参与了生物屏障,同时也参与了机械、化学和免疫屏障。同时,胃肠道作为人体最大的内分泌器官,各种激素分泌与胃肠道黏膜屏障功能密切相关。胃肠道也具有丰富的神经系统,对胃肠道及其与身体其他部位的通讯非常重要。有研究表明肠神经系统参与胃肠道的食物抗原递呈、细菌位置变化等过程[5,6],同时焦虑和(或)抑郁等情绪变化也影响到黏膜屏障功能。临床医师应意识到胃肠道疾病中黏膜屏障功能障碍的潜在研究价值,其或可作为未来治疗的靶点。
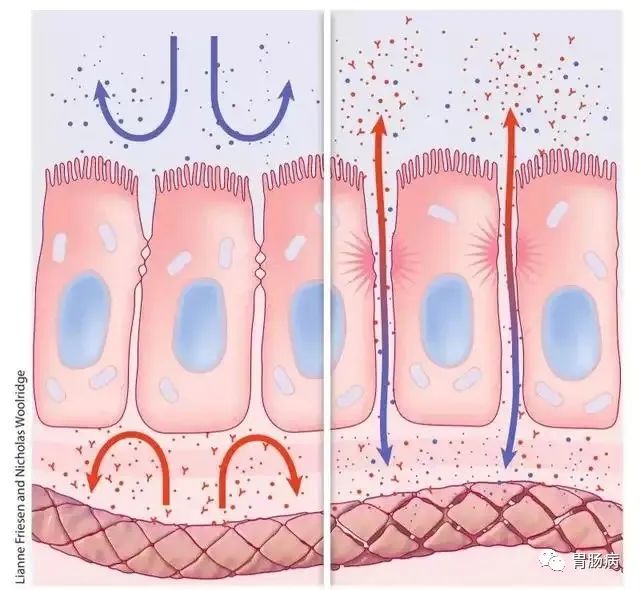 【2】胃黏膜屏障和保护主要与"黏液-碳酸氢盐-磷脂"屏障、上皮细胞间连接和胃液成分有关。
【2】胃黏膜屏障和保护主要与"黏液-碳酸氢盐-磷脂"屏障、上皮细胞间连接和胃液成分有关。
"黏液-碳酸氢盐-磷脂"屏障是构成胃黏膜防御的第一道防线,在保护胃黏膜上皮组织免受胃酸反渗透,以及防止胃蛋白酶渗透导致的上皮细胞水解中发挥重要作用。黏液与三叶因子肽一起分泌,三叶因子肽在细胞内黏蛋白的合成和组装中起作用。阿司匹林和胆盐等能破坏黏液凝胶层和磷脂层,导致胃酸反渗透和黏膜损伤。上皮细胞与细胞之间的连接是胃黏膜防御的第二道屏障,上皮细胞的完整性和磷脂的疏水性是抵御酸和水溶性有害物质的重要因素,紧密连接形成的封闭结构能够阻止酸和蛋白酶的反渗透。上皮细胞的修复与更新有赖于正常的胃黏膜血供,其中一氧化氮与前列腺素E2的作用尤其重要。前列腺素还具有抑制胃酸分泌,以及刺激黏液和碳酸氢盐分泌等作用。
【3】黏液和肠上皮细胞的特殊结构是肠黏膜屏障的主要特点。
肠道是机体与外界进行物质交换的重要场所,肠黏膜屏障能有效防止病原微生物入侵机体。黏液屏障是第一道防线,主要发挥阻隔病原微生物与肠黏膜直接接触的作用。黏液层主要为高度糖基化的黏蛋白,形成覆盖肠上皮的凝胶状筛状结构,其中黏蛋白-2是杯状细胞分泌的最为丰富的黏蛋白。小肠的黏蛋白为单层疏松的非附着黏液,不能单独阻止细菌穿透,潘氏细胞产生的抗菌肽在其黏液屏障中发挥主要作用;结肠的黏液屏障由疏松的外层黏液和致密的内层黏液构成,疏松的外层黏液允许共生细菌长期定植,致密的内层黏液能够阻止细菌渗透。
肠上皮细胞形成的连续极化单层结构将肠腔与黏膜固有层隔开,在缺乏特异性转运蛋白的情况下,细胞膜对亲水性物质不具有通透性,使得这类分子通过肠上皮细胞高度受限。因此,位于肠上皮细胞之间的连接复合物(紧密连接、黏附连接、桥粒)在调节分子转运中发挥主要作用。此外,免疫屏障和微生物屏障也参与肠黏膜屏障的维护。
【4】胃肠激素通过多种机制参与胃肠道黏膜屏障维护。
胃肠激素是由胃肠内分泌细胞产生的一大类调节多肽,具有多种生理功能,可通过调控免疫屏障、机械屏障和生物屏障等功能发挥屏障保护作用。生长抑素、胃饥饿素能够抑制细菌、毒素等诱导的多种炎症细胞因子的分泌,减轻胃肠道炎症。血管活性肠肽(VIP)可通过调节免疫细胞(如巨噬细胞、T细胞、3型天然淋巴细胞)释放多种炎症因子,参与胃肠道免疫屏障维护。
【5】缺血-再灌注损伤是胃肠道黏膜屏障损伤的重要机制之一。
胃肠道屏障对缺血-再灌注损伤尤为敏感,是应激性溃疡发生的重要病理生理学基础。严重创伤、手术和危重疾病(包括消化系统疾病)等都容易诱发胃肠道缺血,导致胃肠上皮细胞凋亡。缺血-再灌注损伤过程中产生的大量活性氧自由基和诱发的炎症介质级联效应,导致亚细胞损伤、细胞间紧密连接破坏、黏膜渗透性增高。
缺血-再灌注损伤诱发的氧化应激还会损伤胃肠道黏液屏障,主要表现为黏液减少和黏液特性改变。缺氧导致的酸性环境破坏与碳酸氢盐屏障相关,活性氧等自由基会破坏黏液中的糖基大分子,使得黏液失去黏性、疏水性和屏障功能。结肠缺血-再灌注损伤尤其是发生在左半结肠的缺血-再灌注损伤预后通常优于小肠缺血-再灌注损伤,与再灌注过程中杯状细胞的"复合胞吐运动"和黏液层的厚度相关。缺血-再灌注损伤引起的胃肠道黏膜屏障功能失调也被认为与胰酶活化、中性粒细胞黏附和钙超载等相关。
【6】黏膜免疫稳态在胃肠黏膜防护中发挥重要作用。
胃肠道黏膜免疫系统是一个独立于系统性免疫的独特免疫器官。为了维持选择性营养吸收和抵御外部环境功能的平衡,胃肠道黏膜内有大量免疫细胞严格调节免疫反应,阻止持续的炎症状态并维持屏障功能。胃肠黏膜免疫细胞网络由上皮层、固有层和肠道相关淋巴组织组成,后者还包括肠系膜淋巴结、派尔集合淋巴结和分离淋巴滤泡。肠道免疫细胞还通过参与维持健康的微生物群落加强上皮屏障功能。胃肠道免疫一旦失衡,即无法区分无害的食物抗原和共生细菌与潜在的病原体,可能导致胃肠道功能障碍和疾病,包括炎症性肠病、肠易激综合征,以及过敏性和B细胞淋巴增殖性疾病等。

【7】胃肠道干细胞参与消化道黏膜上皮更新与修复。
消化道黏膜是机体代谢最旺盛的组织之一。生理状态下,胃肠黏膜上皮细胞只需2~6 d即可完全更新1次。干细胞具有2个重要的特点,一是具有自身增殖潜能,二是具有分化成多种细胞的潜能。
【8】肠道菌群在胃肠道黏膜屏障功能和维护中发挥重要作用。
胃肠道黏膜屏障中的黏液层分为两部分:内层为紧密连接层,分泌具有抗菌作用的保护性多肽,且相对无菌;外层更厚而疏松,有大量的肠道菌群及其产物。肠腔内则有更加丰富的菌种和菌量。肠道微生物的密度从近端肠道到远端肠道有所增高。这些肠道菌群除参与黏附外,与宿主的黏蛋白、黏多糖之间有复杂的双向作用,并且对调节肠道黏液层的屏障功能也有重要作用,共同参与黏膜屏障的维护。肠道菌群通过抵御外来微生物的定植、分泌黏液因子和相关代谢产物、激活免疫细胞产生抗体和细胞因子、促进细胞间紧密连接和黏膜修复,参与胃肠道黏膜的生物、化学、免疫和机械屏障的维护。因此,由各种原因导致的肠道菌群失调也是肠黏膜屏障损伤的重要因素之一。
【9】亚洲人群胃酸最大分泌量低于西方人群,在消化性溃疡等酸相关性黏膜损伤的发病机制中,黏膜防御和修复功能受损为主要病因。
胃黏膜损害与防御因素失衡学说是目前较为公认的酸相关黏膜损伤的机制。胃黏膜的损害因素包括胃酸、胃蛋白酶对胃黏膜的侵袭作用,幽门螺杆菌感染,以及包括非甾体抗炎药、糖皮质激素、氯吡格雷等药物应用等;胃黏膜的防御因素包括"黏液-碳酸氢盐-磷脂"屏障、前列腺素的保护作用和上皮细胞间的紧密连接。当黏膜的损害因素的作用大于防御因素时,即可出现酸相关黏膜损伤如消化性溃疡。近年来研究发现,亚洲人群壁细胞的数量少于西方人群,胃酸最大分泌量低于西方人群,因此,对亚洲人群来说,黏膜防御和修复功能受损是酸相关黏膜损伤的主要原因之一。
二、胃肠道黏膜损伤与相关疾病
【1】胃肠道黏膜损伤可由理化、感染、应激、心理等多种因素导致。
【2】药物,尤其是甾体抗炎药、抗血小板药物、糖皮质激素和化学治疗药物,可通过各种局部或全身、直接或间接作用引起全消化道黏膜损伤,包括小肠和结肠黏膜。
【3】长期禁食或依靠肠外营养者,可因肠黏膜缺少食物和消化道激素刺激,造成肠绒毛萎缩和黏膜更新修复能力降低,损害肠黏膜屏障。
【4】对于多脏器功能衰竭患者,应重视胃肠道黏膜屏障的保护,避免肠源性感染加重全身炎症反应综合征。
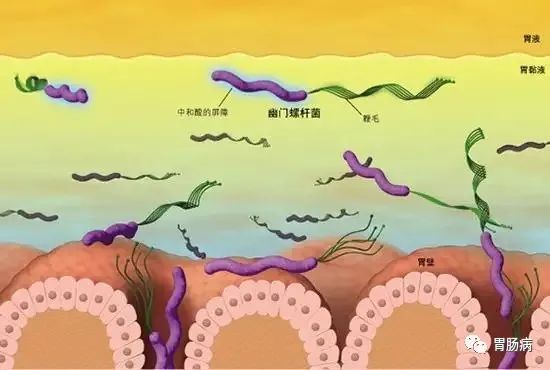
【5】急慢性胃炎是胃黏膜对各种损伤的反应过程,幽门螺杆菌可通过多种机制损伤胃黏膜。
【6】肠黏膜损伤及其屏障功能障碍是IBD的重要病理生理机制和临床表现,黏膜损伤可导致黏膜屏障受损,黏膜屏障受损又可诱导黏膜炎症反应。
 【7】胃肠道黏膜损伤可继发于系统性疾病,如肿瘤、自身免疫病、过敏性疾病等。
【7】胃肠道黏膜损伤可继发于系统性疾病,如肿瘤、自身免疫病、过敏性疾病等。
三、黏膜保护剂的分类和合理应用
【1】黏膜保护剂根据药代动力学作用方式分为内源性和外源性黏膜保护剂,根据药物的结构和作用机制主要分为硫氢键类、铝镁剂、铋剂类、柱状细胞稳定剂和胃肠激素类等。

关于肠黏膜保护剂研究与应用较少,而关于胃黏膜保护剂作用机制研究与应用较为成熟。一般具有以下作用的可称胃黏膜保护剂:①促进胃黏液的分泌和增加碳酸氢盐含量;②增加胃黏膜血流量;③稳定上皮细胞膜和溶酶体,减少细胞自溶;④促进前列腺素、生长因子等释放和上皮细胞更新,增强黏膜屏障;⑤具有中和胃酸或抑制胃蛋白酶活性的作用,有些具有抑制幽门螺杆菌生长的作用。近年来根据黏膜保护剂药代动力学作用方式将其分为外源性和内源性黏膜保护剂。硫氢键类、铝镁剂、铋剂类属于外源性黏膜保护剂,主要通过促进黏液分泌和增加碳酸氢盐含量起到黏膜保护作用;柱状细胞稳定剂和胃肠激素类属于内源性黏膜保护剂,主要通过稳定细胞膜、增加黏膜保护因子、增加黏膜血流、抗氧化等机制发挥作用,除保护胃黏膜外,对小肠黏膜可能也有一定保护作用。
【2】外源性黏膜保护剂通过促进黏液分泌和增加碳酸氢盐含量起到胃黏膜保护作用。
各类铝镁剂、铋剂类属于外源性黏膜保护剂,主要通过局部作用,起到中和胃酸、降低胃蛋白酶活性和增强黏膜屏障的作用。硫糖铝为硫氢键类代表药物,在酸性条件下解离为带负电荷的八硫酸蔗糖,与溃疡面上带正电荷的蛋白质结合,形成保护性屏障,吸附胆汁酸,阻止胃酸、胃蛋白酶的侵蚀。铝碳酸镁的活性成分为水化碳酸氢氧化镁铝,具有特殊层状网络结构,通过可逆性结合胆酸灭活胃蛋白酶和卵磷脂等有害物质来发挥作用。铋剂包括枸橼酸铋钾、胶体果胶铋等。在酸性环境下,胶体铋在溃疡基底肉芽组织形成一层坚固的氧化铋胶体保护膜,从而隔绝胃酸、胃蛋白酶、胆汁酸等对胃黏膜的损伤。
【3】内源性黏膜保护剂主要通过稳定细胞膜、增加黏膜下保护因子、增加黏膜血流、抗氧化等机制发挥作用。
内源性黏膜保护剂主要包括替普瑞酮、瑞巴派特、伊索拉定、依卡倍特钠、聚普瑞锌、胃肠激素类和谷氨酰胺类药物。内源性黏膜保护剂作用于黏膜屏障的不同靶点,在多方位提供保护作用。替普瑞酮通过增加黏膜组织一氧化氮合酶和一氧化氮的含量,促进局部内源性前列腺素的合成,上调热休克蛋白的表达,促进防御和黏膜修复。瑞巴派特可通过促进前列腺素合成、抑制髓过氧化物酶活性并提高超氧化物歧化酶的活性,发挥抑制炎症和抗自由基作用。伊索拉定可强化黏膜上皮细胞的紧密连接,防止有害物质透过黏膜,提高胃黏膜细胞内环磷酸腺苷、前列腺素和黏膜糖蛋白含量,也可提高一氧化氮、氨基己糖含量,抑制肿瘤坏死因子-α等炎症因子的产生,抑制中性粒细胞产生的自由基,起抗氧化作用。依卡倍特钠与胃黏膜损伤部位游离出来的白蛋白、纤维蛋白等血浆蛋白结合,促进胃黏膜愈合,并可提高胃黏膜前列腺素和氨基己糖的水平。聚普瑞锌可维持黏膜稳定、刺激黏膜合成,抗氧化和诱导热休克蛋白70的表达,起到保护胃肠黏膜作用。胃肠激素类以前列腺素为代表,包括吉法酯、索法酮等药物,通过升高胃黏膜的前列腺素水平、抑制炎症因子释放、刺激分泌黏液和碳酸氢盐、改善黏膜血流量、促进细胞更新和稳定细胞膜等机制发挥黏膜保护作用。谷氨酰胺通过促进黏液分泌和上皮细胞的增殖和修复,提供能量,对胃肠道黏膜,尤其小肠黏膜有明显的保护作用,这类药物包括L-谷氨酰胺呱仑酸钠(麦滋林)、复方谷氨酰胺(谷参)等。此外中医中药在胃肠道黏膜保护中也有重要作用,但作用机制有待进一步明确。
【3】胶囊内镜检查显示部分内源性黏膜保护剂对NSAID类药物导致的小肠黏膜损伤具有保护作用。动物实验对相关机制进行了探讨。
随着胶囊内镜、小肠镜检查的开展,NSAID所致的小肠黏膜损伤逐渐引起关注。小肠黏膜损伤的机制与胃黏膜有所不同,因此,内源性黏膜保护剂在小肠黏膜损伤预防和治疗中的作用成为临床研究的热点。一项前瞻性、随机对照研究,纳入40例因服用双氯芬酸钠导致小肠黏膜损伤的患者,发现替普瑞酮能有效预防因服用双氯芬酸钠所致的小肠黏膜损伤。多中心、随机、双盲对照研究发现,瑞巴派特不仅对低剂量阿司匹林和其他NSAID类药物所致的小肠黏膜损伤有治愈作用,还可以提高血清白蛋白水平,改善营养状况。随机对照研究也发现,与奥美拉唑相比,短期服用伊索拉定能更加有效地抑制NSAID引起的小肠黏膜损伤;聚普瑞锌能显著减少由低剂量阿司匹林导致的小肠黏膜糜烂和(或)溃疡的发生;高剂量的依卡倍特钠也能显著减少由NSAID引起的小肠病变数量,有效预防小肠黏膜损伤。
内源性黏膜保护剂对药物导致小肠黏膜损伤的机制研究目前多为动物实验。替普瑞酮通过增加大鼠小肠黏膜中的黏蛋白含量、黏膜血管内皮生长因子含量,以及减轻自由基损伤等机制,保护肠道黏膜免受洛索洛芬钠引起的溃疡风险和小肠上皮屏障损伤。在吲哚美辛所致小肠黏膜损伤的动物研究中发现,瑞巴派特通过抑制炎症因子,提高血清前列腺素E2、表皮生长因子水平,增加小肠中三叶因子3的表达来缓解小肠黏膜损伤;伊索拉定的保护作用可能与黏液分泌增加或对磷酸二酯酶的抑制作用有关;聚普瑞锌则可能通过抑制活性氧的产生,增加热休克蛋白70表达、抑制小肠细胞凋亡起到保护作用。
【4】应根据病因、黏膜损伤的部位和严重程度选择相应药物和疗程。内源性黏膜保护剂应足疗程应用,在特定情况下应注重全胃肠道黏膜保护。
黏膜保护剂应用的疗程应根据黏膜损伤病因和不同黏膜保护的作用机制决定。幽门螺杆菌根除治疗和消化性溃疡治疗应遵循相关指南建议的治疗疗程。对于应激相关性黏膜损伤,建议危重患者和有应激相关性胃肠道危险因素者预防性使用PPI或H2受体阻滞剂,可减少应激性胃黏膜损伤,在特定情况下应注重全胃肠道黏膜保护。在各种病因导致的糜烂性胃炎治疗中,黏膜保护剂的疗效与PPI相当;在缓解腹胀、嗳气等症状方面,黏膜保护剂的疗效优于PPI。替普瑞酮等内源性黏膜保护剂疗程为4周的疗效明显优于疗程为2周时,慢性萎缩性胃炎患者应用替普瑞酮治疗1年可显著改善黏膜组织学病变。在NSAID导致黏膜损伤的治疗中,胃溃疡等胃黏膜损伤首选PPI,但临床研究表明PPI会增加NSAID所致小肠损伤的风险。加拿大胃肠病学会指出,使用NSAID且胃肠道并发症风险中等增加者需注重黏膜保护剂的使用。PPI与米索前列醇或替普瑞酮联合使用可以预防和治疗NSAID相关的胃和小肠损伤。疗程应根据NSAID的使用情况决定,必要时应长期应用内源性黏膜保护剂预防胃肠道黏膜损伤。建议需应用NSAID的老年高危患者检测和根除幽门螺杆菌,避免饮酒,并使用PPI以减少溃疡出血的发生。对于抗栓治疗等导致的胃肠道黏膜损伤患者,可选择PPI、H2受体阻滞剂和黏膜保护剂进行个体化治疗;抑酸药和米索前列醇也能有效防治抗栓治疗所致的胃肠损伤。放射治疗、化学治疗等特殊治疗相关肠道黏膜损伤防治策略支持硫糖铝等外源性黏膜保护剂的灌肠治疗。
【5】谷氨酰胺通过降低肠黏膜通透性、抑制肠道黏膜萎缩的发生,在肠道黏膜防护中起到重要作用。
谷氨酰胺是一种"条件性必需"氨基酸,是肠道上皮细胞快速分裂的主要能量来源。谷氨酰胺耗尽会使肠上皮细胞萎缩和通透性增加,补充谷氨酰胺可恢复肠黏膜通透性,减少细菌和毒素移位。多项临床研究表明,甘氨酰谷氨酰胺强化肠外营养治疗可预防术后患者的肠黏膜通透性被破坏,减轻5-氟尿嘧啶引起的肠黏膜通透性改变和感染导致的肠易激综合征伴腹泻患者肠黏膜通透性增加。临时口服谷氨酰胺可降低高温环境中运动导致的肠黏膜通透性增加,以保持肠黏膜完整性。欧洲临床营养和代谢学会推荐对于重症急性胰腺炎、烧伤等重症患者,应在肠内营养开始后立即给予额外的肠内谷氨酰胺保护肠道黏膜,避免肠源性感染的发生。值得注意的是,体内可以合成谷氨酰胺,只有在应激条件(如大手术、创伤或败血症)下,当谷氨酰胺消耗量超过最大产生量,肠道功能才对谷氨酰胺产生依赖,所以谷氨酰胺对慢性黏膜损伤的作用有待临床研究的进一步证明。
【6】不同黏膜保护剂可以联合应用,必要时可以与PPI联合应用,但应注意不良反应的发生。
治疗胃肠黏膜损伤除消除损害因素外,还应增强黏膜保护。加拿大胃肠病学会指出,具有很高风险的患者可同时使用2种保护药物。临床研究表明,替普瑞酮与其他不同机制的黏膜保护剂(铋剂、硫糖铝、贝前列素)联用可更明显地改善胃黏膜炎症,且不良反应较少。黏膜保护剂也可与PPI联用。幽门螺杆菌一线根除方案包括含铋剂的四联疗法,且铋剂能够改善PPI三联疗法根除幽门螺杆菌的效果。黏膜保护剂与PPI联合使用时,应注意不良反应的发生。铝剂与其他药物(如布洛芬)联合使用,会降低其联合使用药物的生物利用度和吸收。
【7】含铋、锌等元素的黏膜保护剂对幽门螺杆菌有一定的抑制作用。
部分黏膜保护剂对幽门螺杆菌有一定的抑制作用。关于铋剂的多项临床随机对照试验提示,水杨酸铋根除幽门螺杆菌的效果优于红霉素,胶体次枸橼酸铋可成功根除50%以上的十二指肠溃疡患者的幽门螺杆菌感染,铋剂可杀灭幽门螺杆菌标准株和临床分离的幽门螺杆菌耐药株且具有剂量依赖性,也可增强抗生素如替硝唑对幽门螺杆菌的杀菌作用。对于存在耐药性的幽门螺杆菌感染者,铋剂可将幽门螺杆菌根除率提高30%~40%。一项随机对照研究发现,含锌黏膜保护剂聚普瑞锌具有较高的幽门螺杆菌根除率,其不良反应发生率低于铋剂,患者耐受性优于铋剂。根除幽门螺杆菌的三联方案中加入聚普瑞锌可明显提高根除率,且毒性无明显增加。因此,目前我国根除幽门螺杆菌共识指南中推荐四联治疗方案为一线治疗方法。
 【8】益生菌、膳食纤维等通过改善肠道微生态环境,产生丁酸等短链脂肪酸,起到保护肠道黏膜的作用。
【8】益生菌、膳食纤维等通过改善肠道微生态环境,产生丁酸等短链脂肪酸,起到保护肠道黏膜的作用。
肠道菌群及其代谢产物与宿主形成复杂的相互作用网络,参与维护人体的生理学功能,对人体维持健康和内环境稳态产生重要作用,这些动态相互作用的失调是许多疾病重要的驱动因素。特定的营养素和益生菌可用于维持或提高黏膜屏障的保护功能。枯草杆菌、屎肠球菌二联制剂通过促进肠上皮紧密连接蛋白表达,调节巨噬细胞和肥大细胞活化,以及降低炎症因子水平,对肠道黏膜起到保护作用。膳食纤维被认为在保护肠黏膜屏障、调节肠道菌群方面均有积极作用。益生菌可从不可消化吸收的膳食纤维中发酵产生短链脂肪酸,如醋酸、丙酸、丁酸。这些代谢物不仅参与调节黏膜的免疫稳态和机体整体的免疫稳态,还会通过刺激黏蛋白-2的表达来增加黏液的产生和分泌,从而增强其保护肠道黏膜的作用。例如,乳酸菌制剂可以促进肠上皮的黏蛋白-3和黏蛋白-2的产生;长双歧杆菌可以重启黏液的产生;罗伊氏乳杆菌可以增加黏液层的厚度。
黏膜是机体抵御病原体侵犯、维持内环境稳定的一线屏障,同时也是炎症、肿瘤等疾病的好发部位。胃肠道黏膜作为人体最大的黏膜屏障器官,不仅通过消化吸收功能提供人体各个器官所需的营养,还通过如肠-肝轴、肠-肺轴、肠-脑轴和神经-内分泌功能等与其他脏器发生联系,影响相关器官的功能,以及疾病的发生、发展与预后。进一步探讨加强黏膜保护的措施,强化对胃肠道黏膜屏障如免疫屏障、生物屏障等的研究,对防治疾病具有重要临床意义。
四、不容忽视的是中医对胃肠病的治疗用同样也是很显著的。
★中医治疗胃病方面
健脾2方”(黄芪、党参、甘草、蒲公英等)对大鼠应激法、消炎痛法、幽门结扎法所致的急性胃黏膜损伤和乙酸法所致的慢性溃疡模型均具有 良好的保护作用。“溃疡安胶囊”(黄芪、桂枝、白芍、炙甘草等)能减轻实验大鼠的胃液和胃酸分泌以及胃黏膜糜烂、出血点、溃疡等肉眼损伤。六君子汤能减轻乙醇、消炎痛及水浸拘束应激所致的大鼠胃黏膜损伤。补中益气汤可预防无水乙醇、以及消炎痛对大鼠胃黏膜的急性损伤。其他具胃黏膜保护作用的传统方剂有四君子汤、香砂六君子汤、参苓白术散、一贯煎、沙参麦冬汤、四逆散、黄连解毒汤、半夏泻心汤等。研究发现单味中药党参、白及、制大黄可减少幽门结扎、乙醇、乙酸诱导的大鼠实验性胃溃疡模型的溃疡指数。五灵脂及其提取物B1、丹参及其提取物F、生姜、川芎嗪,以及积雪草、 银杏叶和仙人掌的提取物等均有不同程度的胃黏膜保护作用。
 ★药对胃黏膜的作用机制一下几个方面:
★药对胃黏膜的作用机制一下几个方面:
1、粘液H碳酸氢盐屏障
2、改善胃黏膜上皮功能
3、改善胃黏膜血流量
4、增加胃黏膜前列腺素含量
5、抗自由基损伤、
★溃疡性结肠炎的中医治疗方面:
中医认为湿热蕴蒸肠腑而发本病, 针对病因, 采用仙方活命饮加减治疗UC, 临床疗效确切, 总体有效率达84.44% 。将68 例 UC 患者随机分为参照组及研究组各 34 例, 研究组予葛根芩连汤合白头翁汤治疗, 治疗后显示, 研究组患者的中医症状及生活质量等改善情况均明显优于参照组, 总有效率为94.12% 。在临床实践中发现柴芍六君汤对于肝郁脾虚型 UC 效果较佳, 该处方可更快、 更好地缓解临床症状, 减轻炎症反应, 提高患者生活质量, 且安全性也优于常规西药治疗。临床实践证实了芍药汤加减配合美沙拉嗪治疗可显著提高临床疗效, 降低血清 IL-1、 IL-8、TNF-α、CRP水平, 且未增加不良反应发生率。在临床实践中发现调和气血,涩肠止泻的乌梅汤可改善 UC 患者结肠黏膜菌群水平, 抑制机体炎症反应。中医认为辛苦并用, 寒热平调, 脾、 胃、 肝、 胆同治, 则 UC 诸证自消, 故应用半夏泻心汤合左金丸治疗 UC, 结果显示其疗效确切, 能有效降低患者内镜分级, 改善患者症状, 调节血清 NF-κB、 CASP1、 NLRP3 mRNA 表达, 减轻炎症反应, 提高生活质量。
部分胃肠黏膜保护药物:
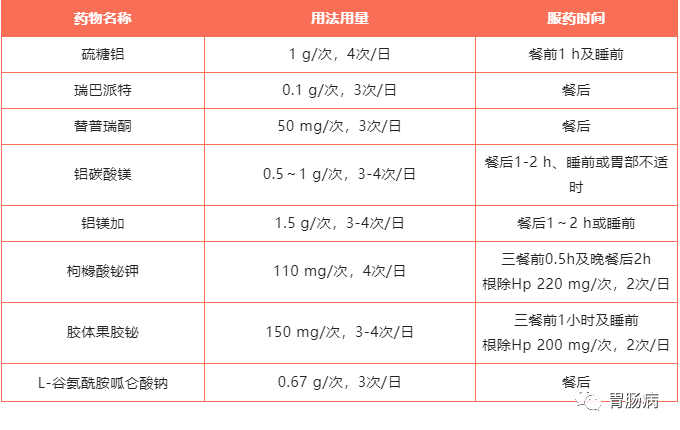 小提醒:
小提醒:
需要注意的是,目前针对胃溃疡、胃炎等胃部疾病的主要治疗方式是抑制胃酸分泌,从而减轻胃酸对胃黏膜的刺激,为其修复创造条件。而抑制胃酸分泌会影响硫糖铝、枸橼酸铋钾等药物起效,因此这两类药物应当间隔服用。
温馨提示:
①铝和铋离子会影响其他药物(如四环素)的吸收,与这类药物联用需间隔至少2小时;
②铝和铋离子少量可被吸收进入体内,肾功能受损时有可能造成蓄积中毒,因此肾功能不全的患者在用药前应咨询医生或药师;
③含有铝和铋的药物不可长期服用,通常不超过8周;
④含铝的药物可造成便秘,其次含铋的药物会使大便变成黑褐色,为正常现象,停药2-3天后即可消失。
最后,小编提醒大家,每个药物都有自己的适应症和禁忌症,应在医生指导下服用,定期进行必要的健康监测,同时严格按照说明书服药,减少不良反应的发生率。


