NEJM:分子胶降解剂Mezigdomide(美齐格米特)联合地塞米松治疗复发难治性多发性骨髓瘤
时间:2023-09-02 11:54:14 热度:37.1℃ 作者:网络
分子胶是一类没有Linker连接的蛋白降解剂,与PROTAC相比,分子胶的分子量更小成药性也更高,在透膜性和生物利用度上更具优势。mezigdomide是一种由新基开发的新型E3泛素连接酶cereblon(CRBN)调节剂,具有免疫调节、抗增殖、促凋亡的作用。
CRBN是沙利度胺等免疫调节剂的作用靶点。研究表明,沙利度胺可以诱导CRL4CRBN(cullin4-damaged DNA-binding-RING box-domain protein)E3泛素连接酶复合物的形成,该复合物可促进IKZF1和IKZF3泛素化并降解,从而抑制恶性浆细胞的增殖。转录因子IKZF1和IKZF3是多发性骨髓瘤恶性浆细胞存活的关键调节因子,其转录后可分别表达锌指蛋白Ikaros和Aiolos。
mezigdomide具有独特且快速的降解特性,源于其可提高Ikaros和Aiolos与CRBN之间形成蛋白-蛋白相互作用的效率,以CRL4CRBN依赖性方式诱导细胞毒性作用,最终诱导细胞凋亡。
尽管最近取得了进展,但多发性骨髓瘤仍然无法治愈。美齐格米特是一种新型的小脑E3泛素连接酶调节剂,在多发性骨髓瘤的临床前模型(包括对来那度胺和泊马度胺耐药的模型)中具有有效的抗增殖和肿瘤活性。
2022年9月26日,CDE网站显示,百时美施贵宝子公司新基的分子胶降解剂mezigdomide在国内获批临床,适应症为复发性或难治性多发性骨髓瘤(RRMM)。

方法:在这项1-2期研究中,对复发和难治性骨髓瘤患者给予口服美齐格米特联合地塞米松治疗。第一阶段(剂量递增队列)的主要目标是评估安全性和药代动力学,并确定第二阶段的剂量和时间表。在第二阶段(剂量扩展队列)中,目标包括以第一阶段确定的剂量和时间表评估美齐格米特加地塞米松的总体反应(部分反应或更好),安全性和有效性。
研究结果:在第一阶段,共有77名患者参加了这项研究。最常见的剂量限制性毒性作用是中性粒细胞减少症和发热性中性粒细胞减少症。根据第一阶段的研究结果,研究人员确定推荐的美齐格米特第二阶段剂量为1.0 mg,每天一次与地塞米松联合给药21天,然后在每28天的周期中休息7天。在第二阶段,共有101名患者在同一时间表中接受了第一阶段确定的剂量。剂量扩展队列中的所有患者均患有三级难治性多发性骨髓瘤,30例(30%)曾接受过抗B细胞成熟抗原(抗BCMA)治疗,40例(40%)患有浆细胞瘤。几乎所有被证明是可逆的最常见的不良事件包括中性粒细胞减少症(77%的患者)和感染(65%;3级,29%;4级,6%)。没有遇到意外的毒性作用。41%的患者出现总体缓解(95%置信区间[CI],31-51),中位缓解时间为7.6个月(95%CI,5.4-9.5;数据不成熟),中位无进展生存期为4.4个月(95%CI,3.0-5.5),中位随访时间为7.5个月(范围0.5-21.9)。
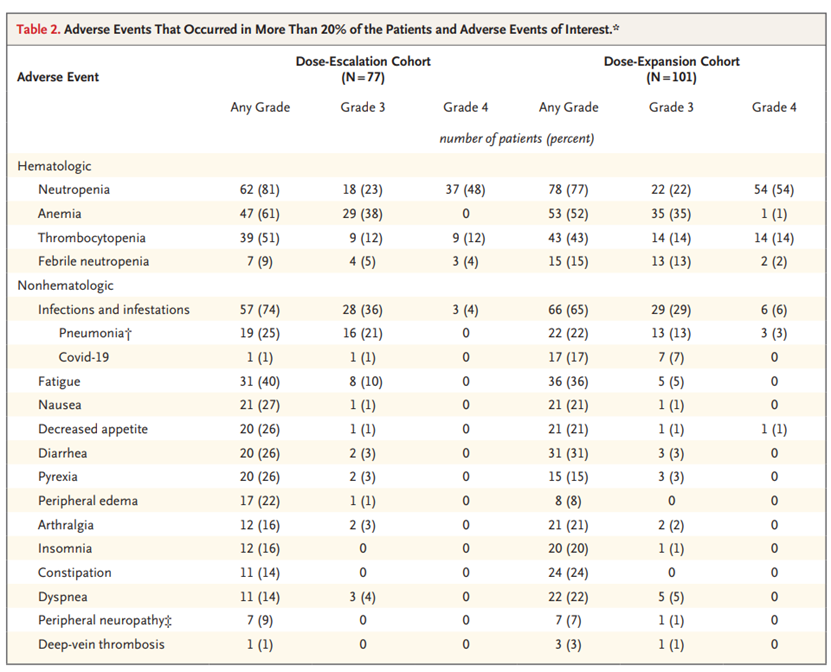
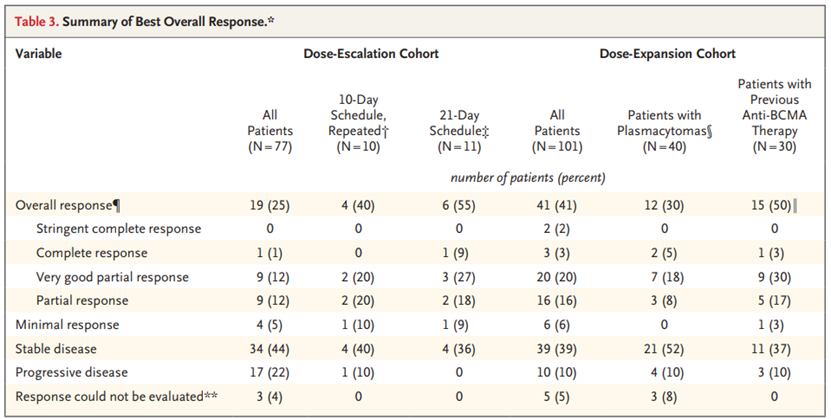
结论:美齐格米特加地塞米松的全口服联合治疗在严重预处理的多发性骨髓瘤患者中显示出有希望的疗效,治疗相关的不良事件主要包括骨髓毒性作用。
原始出处:
Richardson PG, et al. 2023. Mezigdomide plus Dexamethasone in Relapsed and Refractory Multiple Myeloma. New England Journal of Medicine. DOI: 10.1056/nejmoa2303194.


