「风险预测模型」没有研究思路?EHJ (39.3):新发房颤风险预测模型这么搭建!这四项试验很关键
时间:2023-09-02 13:58:48 热度:37.1℃ 作者:网络
风险预测模型,能够基于个体的一系列特征,来预测个体出现某一疾病或结局的概率。在诊断、预测不良结局(如死亡、并发症等)以及疾病严重程度分级等方面,风险预测模型可以帮助临床医生快速地进行临床决策和制定治疗方案。
近几年,「预测模型」成为临床研究者关注的热点之一。无论是申请课题项目,还是开展学科选题,预测模型类都是炙手可热的方向。
此前,梅斯学术曾为大家分享过心血管疾病风险预测模型,今天小编将为大家解析一篇关于多基因风险预测模型在评估新发房颤风险中的作用,很适合学习和参考。该文章题为“A polygenic risk score predicts atrial fibrillation in cardiovascular disease”,发表在Eur Heart J.杂志。

一、研究背景
心房颤动(AF)是最常见的心律失常,全世界成年人的终生患病风险约为20-40%;此外,其死亡率较高的主要原因在于,该病增加了心源性卒中的风险。早期发现房颤能够更早地开始抗凝治疗以降低栓塞性中风的风险,因此科学家致力于针对性地制定筛查计划来识别发生房颤的高风险人群。
越来越多的证据表明,房颤风险很大程度上受遗传因素影响,但现有的“房颤风险分层工具”却更多地依赖于传统风险因素或生物标志物,比如未纳入遗传数据的N 端B型利尿钠肽原 (NT- proBNP)、多基因风险评分(PRS)等等。事实上,先前的研究基于多个异质的社区队列,研究了针对AF的非基因组PRS,结果发现,与单独的传统危险因素相比,PRS始终能够改善AF预测。然而,除了NT-proBNP之外,遗传学是否能改善既定心血管疾病的患者的AF预测,仍然未知。
本研究中,研究者试图确定新的全基因组670万个单核苷酸多态性(SNP) AF PRS是否可以增加临床危险因素,以及NT-proBNP在预测来自四项心血管疾病谱系的患者队列中的AF事件方面的价值。
二、研究方法
1. 研究设计和人群
研究人员进行了一项基因队列研究,汇集了来自四项心血管临床试验的个体患者水平数据:
① SOLID-TIMI 52(使用 Darapladib 稳定斑块);
② SAVOR-TIMI 53(糖尿病患者记录的沙格列汀血管结果评估);
③ PEGASUS-TIMI 54(在阿司匹林背景下,与安慰剂相比,使用替格瑞洛预防心脏病发作患者的心血管事件);
④ FOURIER (TIMI 59)(在高风险受试者中抑制 PCSK9 的进一步心血管结果研究)。
这一综合研究人群涵盖了广泛的心血管疾病,包括既往心肌梗塞、糖尿病、中风和外周动脉疾病。
2. 基因分型和估算
使用Illumina多种族基因分型阵列(SAVOR-TIMI 53和PEGASUS-TIMI 54)、Affymetrix Biobank阵列(SOLID-TIMI 52)和Infinium Global Array (FOURIER)进行基因分型。所有四项试验均使用相同的方法进行插补、质量控制和血统鉴定。并使用PLINK v2.0进行预估算质量控制。
3. 多基因风险评分
此分析中使用的效应权重是从之前发布的AF全基因组PRS中获得的,该PRS使用LDPred算法和调整参数ρ = 0.003计算。从发现GWAS开始,使用英国生物银行一期数据集验证原始分数,然后使用独立的二期测试数据集进行测试和计算。使用每个等位基因的基因型剂量乘以其重量,然后对所有变体求和,计算每个受试者的PRS。
4. CHARGE-AF 临床风险评分
使用经过验证的CHARGE-AF模型计算了每个受试者的AF临床风险,该模型包含年龄、身高、体重、收缩压、舒张压、抗高血压药物的使用、糖尿病、心力衰竭、心肌梗死和吸烟。根据CHARGE-AF评分的三分位数,将患者指定为低、中或高AF临床风险。
5. NT-proBNP 测定
在试验进入时,使用ELISA测量了所有同意的参与者的NT-proBNP水平。
6. 研究终点和随访
研究终点是房颤事件,包括房颤和心房扑动事件。对于每项试验,研究人员将房颤和心房扑动事件报告为不良事件。两位独立评审员(NAM和ACG)在本研究的安全事件数据库中确定了AF和心房扑动的实例。各项试验的中位随访时间为2.1-2.8 年。
三、实验结果
这四项试验共纳入了36,662名受试者,平均年龄为64岁,其中25%为女性。在中位随访的2.3年中,共发现了1018例新房颤病例 (2.8%)。
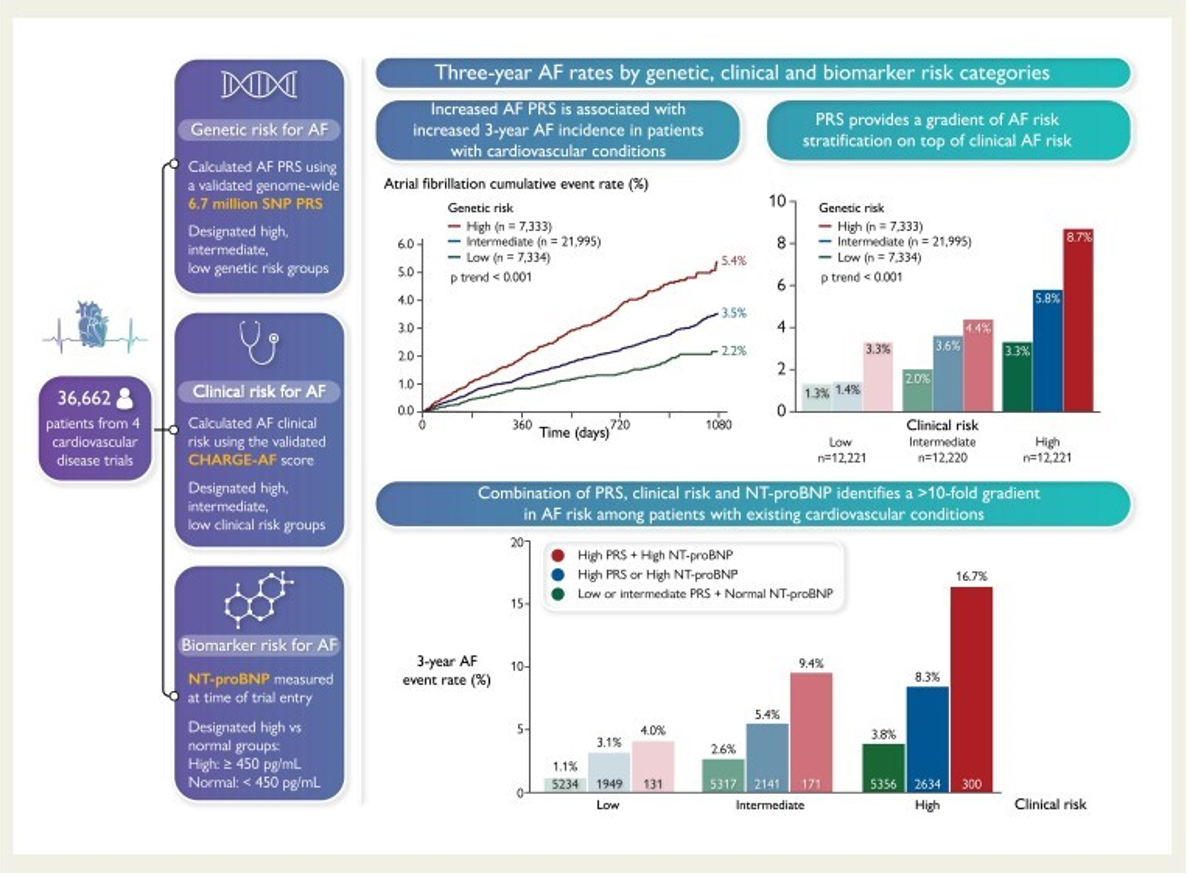
在整个研究人群中,AF PRS预测AF的风险梯度显著,PRS每增加1-SD,风险就会增加40%。此外,低、中、高遗传风险类别患者的三年Kaplan-Meier事件发生率在3岁时分别为2.17%、3.53%和5.36%。
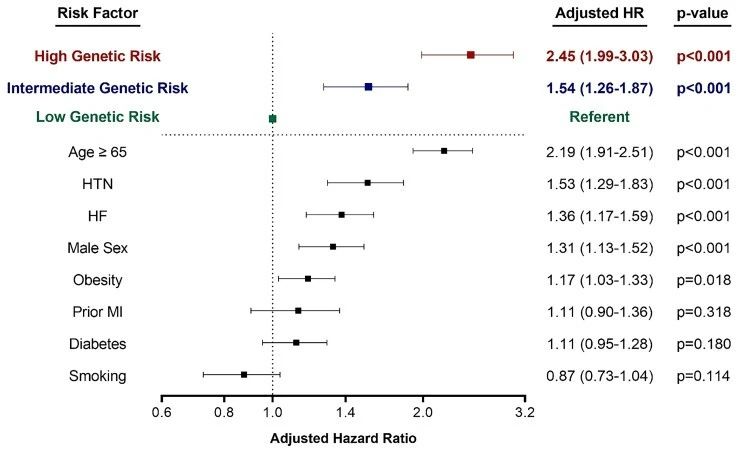
随访数年后,整个研究队列的3年事件率为3.63%。调整临床风险因素后,较高的PRS仍然与AF风险密切相关。与低遗传风险类别的受试者相比,高遗传风险受试者的调整后HR为2.45,中等遗传风险受试者的调整后HR为1.54。对4873名非欧洲血统受试者的分析表明,房颤风险预测与PRS一致。

按遗传风险类别划分的AF风险预测程度与年龄相当,并且强于其他临床风险因素,包括高血压、心力衰竭和既往心肌梗塞。
当研究人群根据CHARGE-AF评分分为临床风险三分位数时,PRS为每个临床风险组提供了额外的梯度。AF的临床风险还在每个遗传风险类别中提供了显著的风险分层梯度,较低的临床风险组与每个遗传风险级别的AF发生率显著降低相关。

共有23,233 名患者测量了NT-proBNP水平。在该队列中,14.3%的NT-proBNP水平≥450pg/mL,这使得发生AF的风险增加了三倍。NT-proBNP与AF PRS无关,并且它们的风险预测是相加的,联合使用时可识别极高风险个体的子集。
四、总结
在心血管疾病患者中,AF PRS是AF的强大、独立预测因子,当添加到经过验证的临床风险评分和已建立的生物标志物NT-proBNP中时,可显著改善风险预测。临床风险因素、NT-proBNP和遗传风险相结合,确定了可能受益于针对性AF筛查的高风险患者亚组。因此,该预测模型是房颤筛查的有效工具。
当然,该研究也有一定局限性,虽然研究人员专门研究了随机临床试验中患有心血管疾病的受试者,并且允许检查具有高危险因素负担和NT-proBNP 升高的亚组,但研究结果可能不适用于更广泛的普通人群。此外,与许多遗传学研究一致,该研究分析受到欧洲血统受试者纳入的限制。非欧洲分析的样本量有限,因此需要进一步的数据来了解遗传风险预测在不同患者群体中的表现。
来源:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10310983/


