中国药科大学戴建君团队等《AFM》:一种质子化纳米材料用于治疗幽门螺杆菌
时间:2023-05-19 09:48:18 热度:37.1℃ 作者:网络
幽门螺杆菌是一种螺旋状、微需氧、非侵入性的革兰阴性菌,定植于胃黏膜下层,能够在猕猴、大鼠、猪、犬等动物胃中生存,广泛侵袭各类动物,可以在人和动物之间传递,造成人类与动物交叉感染。作为世界上最顽固的细菌之一,幽门螺杆菌影响着大约一半的人口,尤其是在发展中国家,发病率可高达90%。目前幽门螺旋杆菌感染总的趋势是:感染率随年龄增加而上升,在发展中国家感染率约为80%,在发达国家约为40%,男性略高于女性,宠物高于人类。这种微生物已被确定为慢性活动性胃炎、消化性溃疡病的病原体,严重可引起胃腺癌和黏膜相关淋巴组织淋巴瘤。此外,美国卫生与公众服务部的致癌物报告工作组在2022年明确得出结论,幽门螺杆菌是人类的致癌物。虽然大多数幽门螺杆菌感染者是无症状的,但感染者仍是上述疾病的高危人群。
临床上治疗幽门螺杆菌的方式是三联或四联疗法,即质子泵抑制剂加两种抗生素或在三联疗法的基础上加入铋剂,但随着幽门螺杆菌耐药性的增强,疗效均逐渐降低。同时,长期使用抗生素将引发肠道菌群紊乱等副作用。因此,急切地需要寻找新的治疗药物以彻底清除幽门螺杆菌。然而,幽门螺杆菌定植于胃黏膜下层,许多治疗药物难以通过胃黏膜屏障,甚至在到达黏膜下层之前已被胃酸消化。穿透黏膜屏障后的药物也很难靶向幽门螺杆菌,有很大一部分在未感染部位就发挥疗效。能够靶向幽门螺杆菌的药物又面临另一阻碍:幽门螺杆菌易形成生物膜。生物膜是一种包裹于细菌细胞外的多聚物基质,能够不可逆地黏附于非生物或生物表面,形成微生物细胞菌落,使细菌产生耐药性的概率大大提高。以上重重阻碍使得许多治疗药物无法达到预期治疗效果。
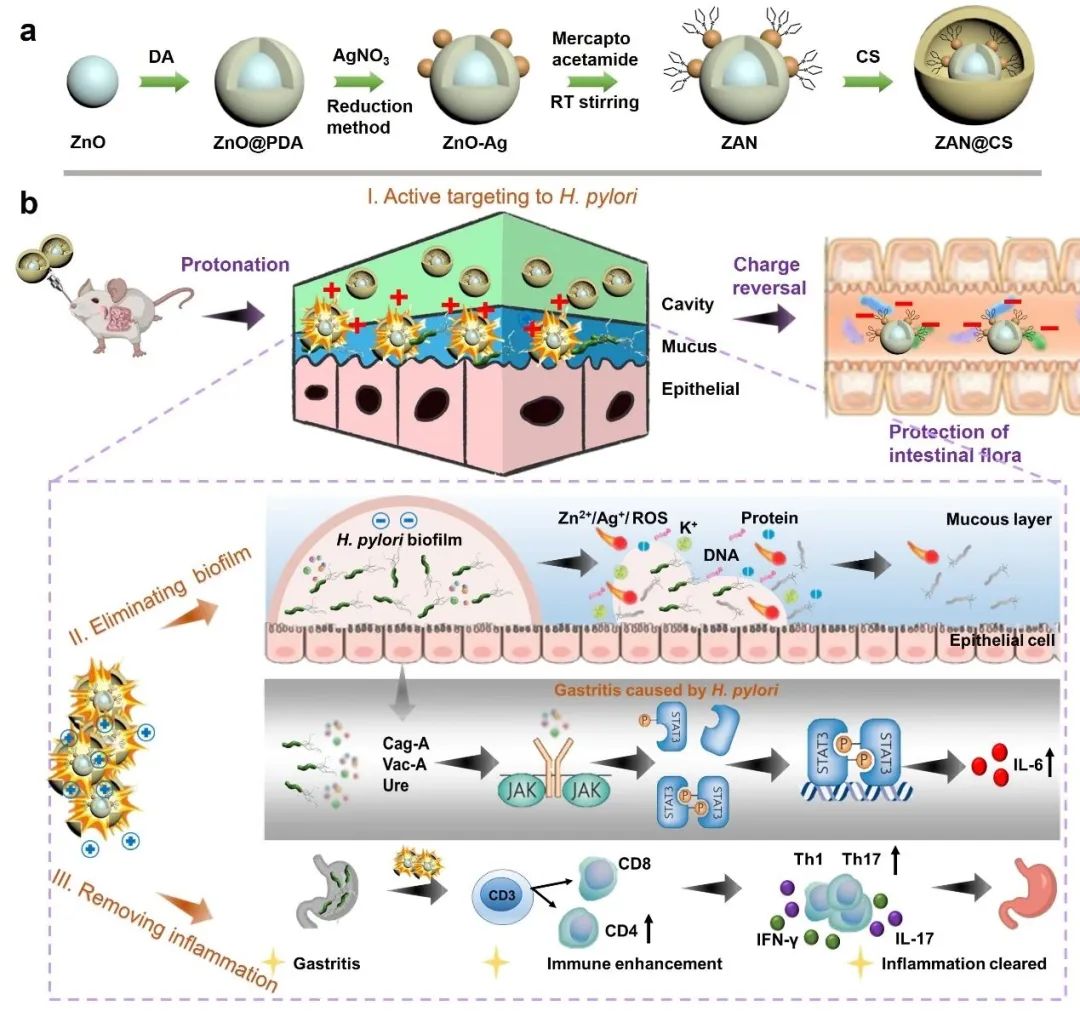
近期,中国药科大学戴建君团队等设计并合成了一种质子化复合纳米材料ZnO-Ag-mercaptoacetamide@chitosan(ZAN@CS)。研究证明,该纳米材料具有以下特点:不易被胃酸破坏,能在胃黏膜粘附并穿透到黏膜层,延长胃内停留时间;可通过静电吸附靶向到幽门螺杆菌感染部位;能够清除黏膜下定植的幽门螺杆菌及其生物膜并减轻胃内炎症,同时避免引起肠道菌群紊乱(图1)。该结果以“Protonated charge reversal nanodrugs for active targeting clearance of Helicobacter pylori accompanied by gut microbiota protection”为题在材料领域顶尖期刊Advanced Functional Materials上发表。药学院硕士生刘聪、生命科学与技术学院硕士生陈斯淼为本论文的共同第一作者。药学院鞠艳敏副研究员、北京大学侯仰龙教授、生命科学与技术学院邢莹莹副教授和药学院戴建君教授为本文的共同通讯作者。中国药科大学为第一通讯单位。
图1 ZAN@CS的制备工艺和抗菌机理示意图。(a) ZAN@CS的制备工艺。(b) ZAN@CS靶向并清除黏膜下定植的幽门螺杆菌及生物膜且减轻胃炎症。
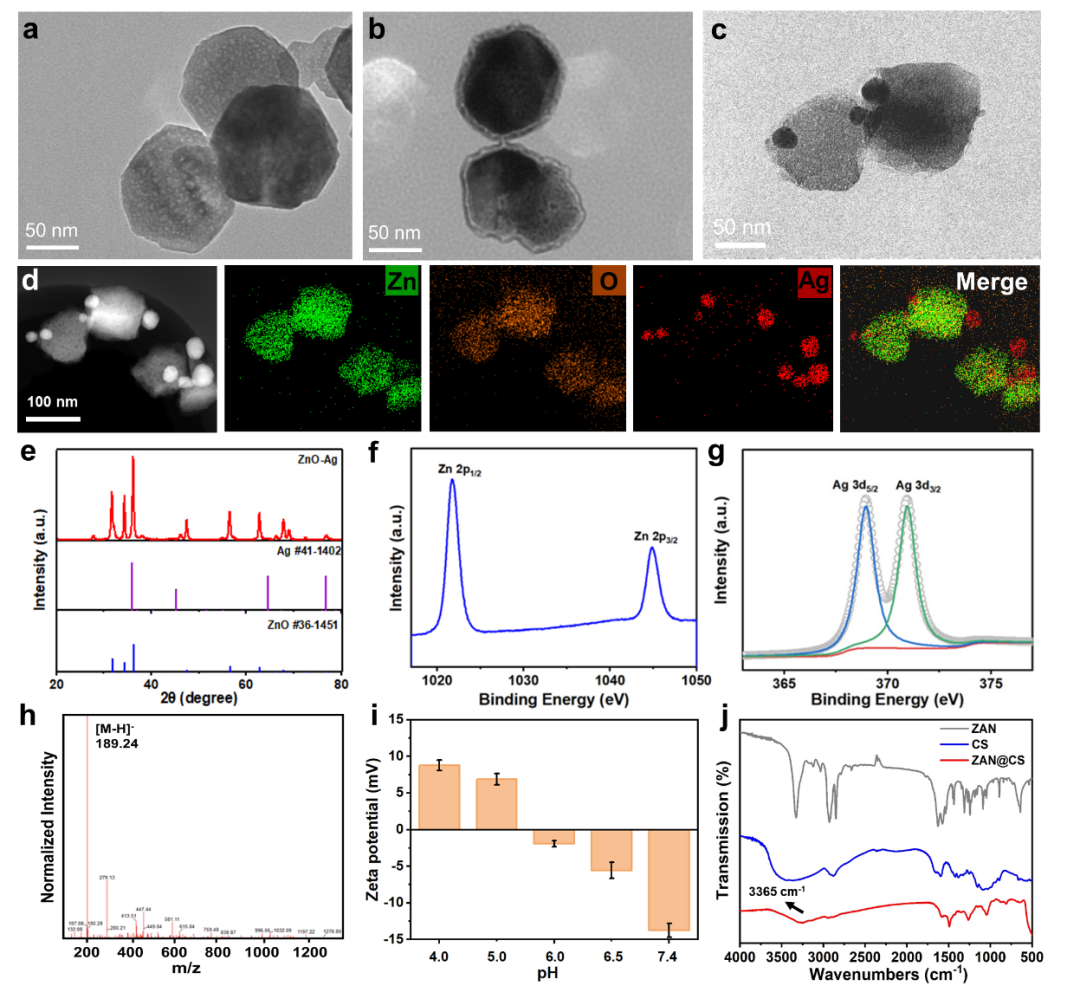
利用水热法和氧化还原法方法合成ZnO-Ag(图2a-c),HAADF-STEM和相应的EDS元素映射图清晰地描绘出ZnO-Ag中Zn、O和Ag的元素分布(图2d)。XRD和XPS结果同样证明ZnO-Ag合成成功(图2e-g)。在其表面修饰巯基乙酰胺与壳聚糖(CS),制备ZAN@CS。质谱显示合成的巯基乙酰胺分子量为189.24,与目标物分子量相同(图2h)。将其修饰到ZnO-Ag表面后(ZAN),实现了不同pH下的表面电位转换(图2i)。FTIR证明了ZAN表面成功包封了CS,ZAN@CS合成成功(图2j)。
在材料合成成功后,通过Transwell模型研究ZAN@CS的粘液渗透性(图2a)。结果显示,ZAN@CS的粘液渗透系数(Papp)值显著高于ZAN(图2b)。通过对黏膜下的幽门螺杆菌存活能力的测定,进一步间接验证了ZAN@CS的粘液渗透性,随着时间的延长,ZAN@CS穿透黏膜屏障到达细菌部位并清除细菌(图2c)。同时,ZAN@CS的荧光结果显示其渗透率可达93.08%(图2d)。
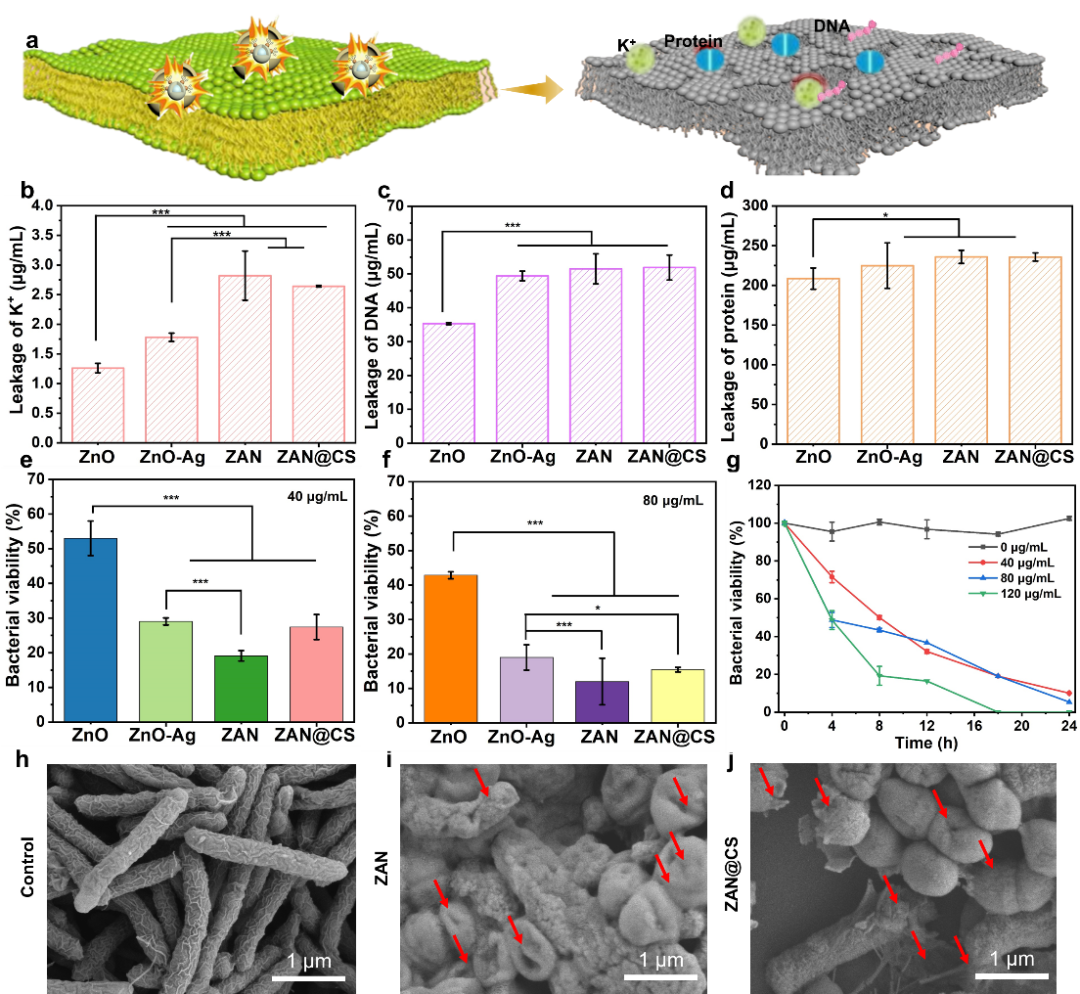
为了验证ZAN@CS对幽门螺杆菌的体外抗菌活性,将其与幽门螺杆菌共孵育,并观察细菌细胞膜的破坏情况(图4a)。结果显示,ZAN@CS可以破坏细菌细胞膜,使更多的细菌内容物流出(图4b-d)。用平板计数法进一步评价ZAN@CS的抑菌活性,结果显示ZAN@CS的抗菌性能显著高于ZnO-Ag和ZnO,具有浓度依赖性和时间依赖性(图4e-g)。同时,与ZAN@CS共孵育6 h后,扫描电子显微镜下发现大量幽门螺杆菌变形和渗出,与ZAN相似(图4h-j)。
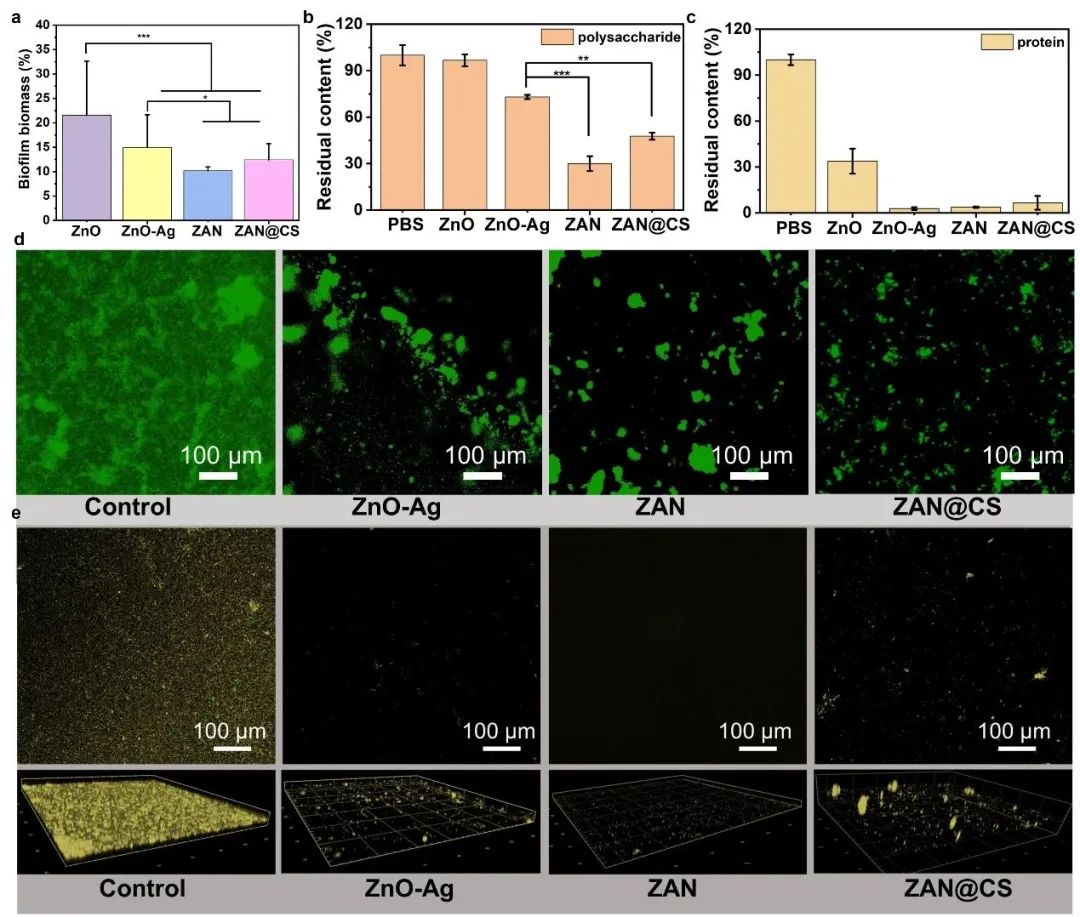
幽门螺杆菌易形成生物膜,进而引起持续感染和耐药,因此清除胃内幽门螺杆菌生物膜是当务之急。结晶紫试验结果证明,ZAN@CS的生物膜根除率优于ZnO和ZnO-Ag,接近ZAN。ZAN@CS处理后生物膜细胞外基质中的多糖、蛋白、eDNA数量明显少于ZnO和ZnO-Ag组,与ZAN组相似(图5b-d)。通过CLSM进一步观察,与对照组和ZnO-Ag组相比,ZAN@CS处理后的荧光强度明显降低,说明生物膜被清除(图5e)。
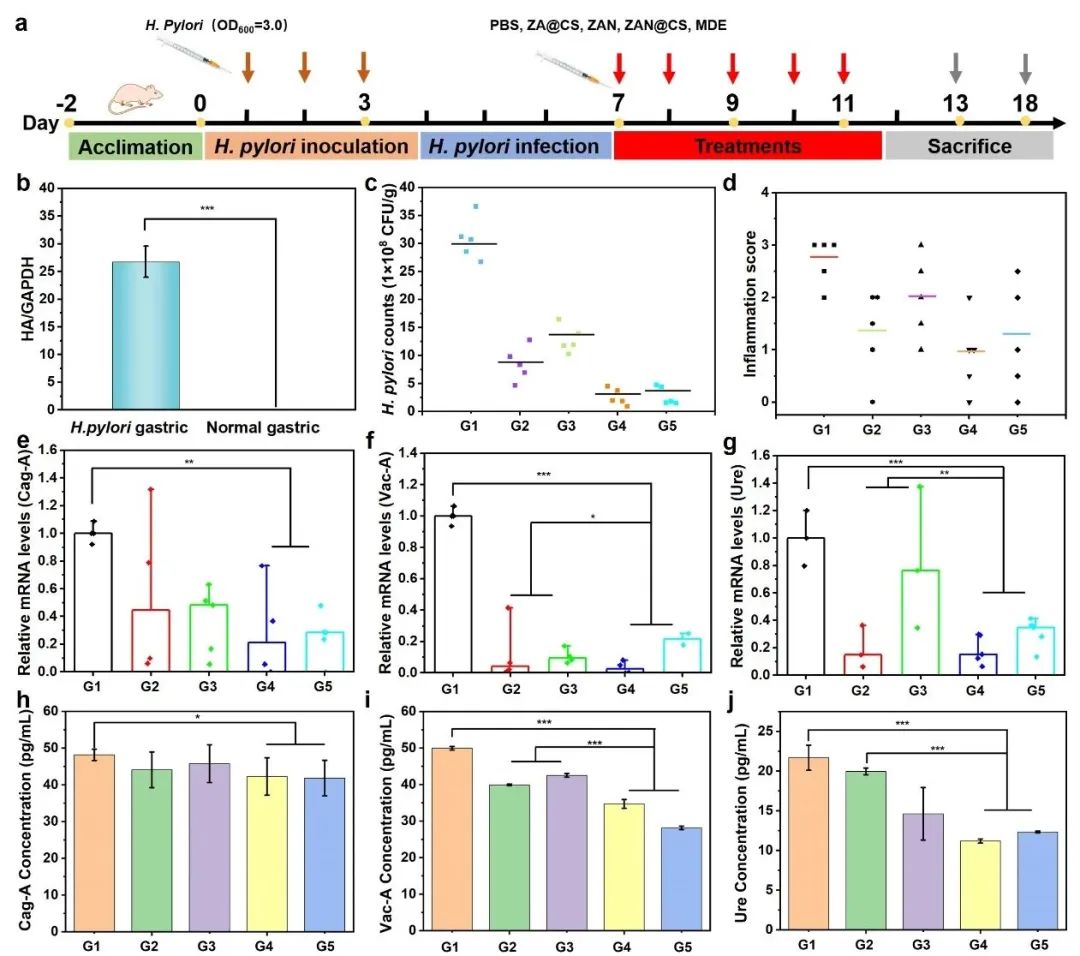
体外试验证实ZAN@CS的抗菌性能后,建立幽门螺杆菌感染小鼠模型,随机分为5组(PBS、ZA@CS、ZAN和ZAN@CS、MDE),连续治疗5 d(图6a)。q-PCR结果显示模型构建成功(图6b)。幽门螺杆菌平板计数结果显示,ZAN@CS组菌落最少,抑菌效果较好,炎症评分仅为1.0(图6c-d)。ZAN@CS治疗后,胃组织中Cag-A、Vac-A和Ure的蛋白与基因表达明显下调,而ZA@CS和ZAN也相应降低,然而由于缺乏靶向性和黏膜渗透能力,毒力因子的基因表达下调水平较低(图6e-j)。
幽门螺杆菌感染往往会引发胃内炎症,因此在纳米材料抗菌的基础上进一步研究了ZAN@CS抗炎效果(图7a)。研究发现,JAK2和pSTAT3蛋白表达水平明显降低,炎症通路被阻断(图7b)。胃部Th细胞含量显著降低(图7c-d)。IL-6、IFN-γ、IL-17的表达水平也显著降低,即炎症减轻(图7e-j)。以上结果可能与纳米材料具有免疫调节能力有关,因此研究了ZAN@CS治疗期间胃内CD4+和CD8+ T细胞数量。结果显示,CD4+ T细胞在ZAN@CS治疗期间数量明显增加,促进了细菌的清除,进而缓解了胃内炎症,CD8+ T细胞变化不明显(图7k)。
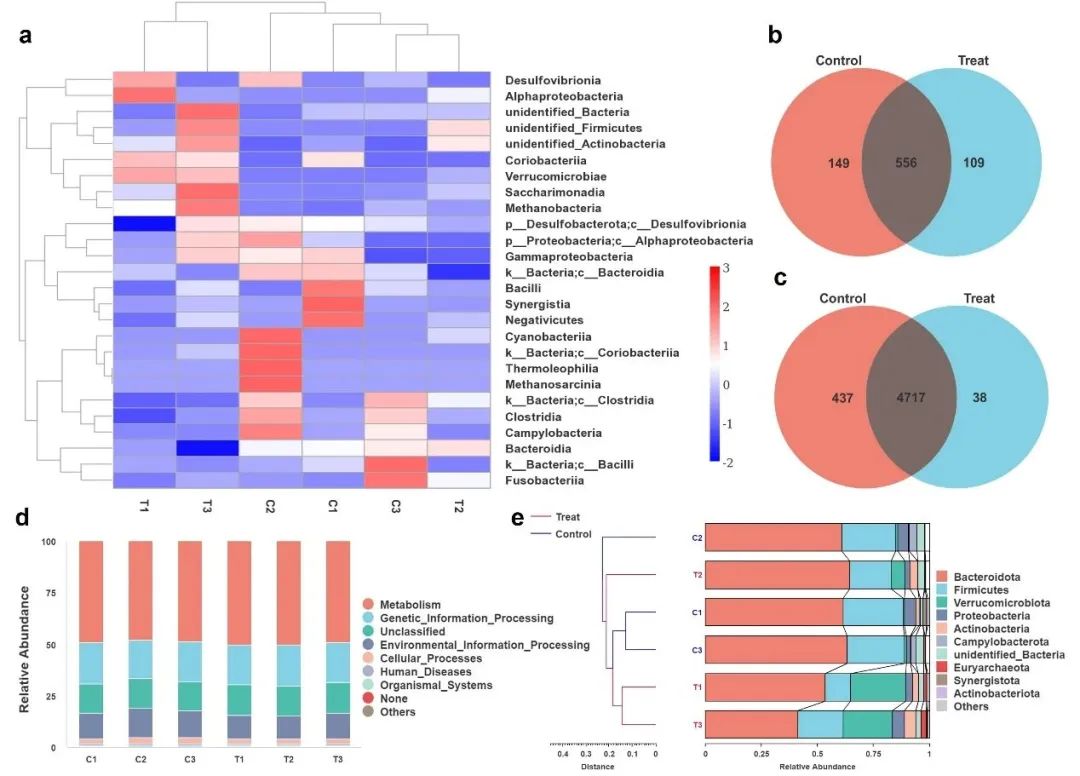
近年来,肠道菌群对于宿主健康的重要性得到了广大研究人员的认同,而抗生素导致肠道菌群紊乱从而引发的副作用也引起了公众的关注。为了研究ZAN@CS对肠道菌群的影响,我们在治疗后收集小鼠粪便,并对其进行16S rRNA测序。结果显示,本研究中合成的ZAN@CS纳米材料通过巯基乙酰胺的质子化作用实现了选择性地清除幽门螺杆菌,对肠道细菌菌种组成、功能相对丰度、菌种相对丰度均无影响(图8a-e)。
综上所述,ZAN@CS可穿透胃黏膜屏障,在酸性环境下质子化带正电荷,实现主动靶向并清除幽门螺杆菌及其生物膜,导致细菌彻底死亡。此外,该纳米材料还具有较好的减轻胃内炎症的能力,这与其调节免疫反应有关。与传统三联疗法不同的是,在肠道中性环境下ZAN@CS带负电荷,与肠道菌群相斥从而不会影响肠道微生物群的丰度、功能和物种多样性。因此,这种纳米药物具有很好的应用前景,为靶向根除幽门螺杆菌提供了一种有效的方法。
https://onlinelibrary.wiley.com/doi/epdf/10.1002/adfm.202300682