Science Advances:中国科学院周溪团队揭示人巨细胞病毒对外源性细胞凋亡与抗病毒天然免疫双重抑制的分子机制
时间:2023-10-09 20:29:35 热度:37.1℃ 作者:网络
抑制凋亡和免疫逃避对于病毒的有效感染具有特殊重要性,然而,病毒常常面临的困境是,抑制凋亡可能会上调抗病毒免疫信号。
2023年10月4日,中国科学院武汉病毒研究所/病毒学国家重点实验室周溪团队(任玉洁为该论文第一作者)在Science Advances 在线发表题为“Human cytomegalovirus UL36 inhibits IRF3-dependent immune signaling to counterbalance its immunoenhancement as apoptotic inhibitor”的研究论文,该研究揭示了人类巨细胞病毒(HCMV)编码的UL36不仅抑制了caspase-8/外源性凋亡,还通过直接靶向干扰素调控因子3(IRF3)来抑制IRF3依赖的免疫信号,从而阻止IRF3与干扰素基因刺激因子或TANK结合激酶1的相互作用,并抑制IRF3的磷酸化/激活。
虽然UL36介导的caspase-8/外源性凋亡抑制增强了免疫信号,但UL36的免疫抑制活性抵消了这种对病毒不利的“副作用”。此外,作者使用突变分析表明,只有野生型UL36才能支持细胞中有效的HCMV复制,而失去任一抑制活性的UL36突变体不足以支持有效的HCMV复制,显示了UL36的双重抑制对于HCMV生命周期的功能重要性。综上所述,该研究结果揭示了HCMV通过复杂的机制来紧密控制先天免疫信号和外源性凋亡,以实现有效的感染。

人类巨细胞病毒(HCMV)是家庭Herpesviridae中Beta-herpesvirinae亚科的一种重要的人类病原体。全球范围内的大部分人口都曾感染过这种病毒,发生率取决于不同的社会经济和地理因素,通常在60%到100%之间。HCMV感染以其可以在初次感染后终身持续的潜伏期而闻名。尽管在成年人中通常无症状,但在某些免疫受损的情况下,包括获得性免疫缺陷综合症、器官或干细胞移植,可以重新激活潜伏期,导致这些人的重要发病率或死亡率上升。此外,HCMV的先天感染是导致胎儿或新生儿畸形的常见原因,全球大约0.5%的妊娠受到这种疱疹病毒的影响。此外,HCMV感染与一些自身免疫疾病和退行性疾病有关,可能是由于该病毒引起的慢性炎症反应。
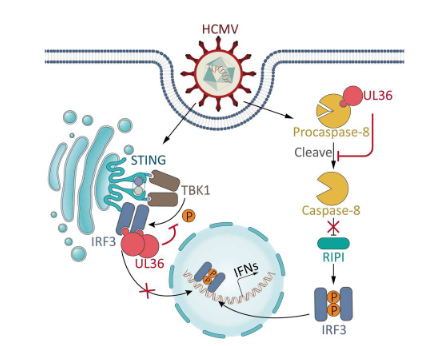
HCMV感染的潜伏和重新激活被认为是一个持续发生的事件,它是由宿主抗病毒防御机制,如先天免疫信号和凋亡精密地控制的。循环鸟苷酸(cGMP)–腺苷酸(cAMP)合酶(cGAS)识别病毒双链DNA并产生循环鸟苷酸-磷酸腺苷(cGAMP),该物质激活干扰素基因激活剂(STING; 也称为MITA/ERIS/MPYS)。然后,STING发生同源二聚化,并与TANK结合激酶1(TBK1)以磷酸化和激活干扰素调控因子3(IRF3),从而诱导I型干扰素(IFN-I)的产生。IFN-I系统在HCMV诱导的宿主抗病毒免疫应答中发挥核心作用,然而已经发现HCMV使用多种病毒蛋白,包括UL31、UL42、UL44、UL82、UL83和UL94,作为免疫拮抗剂来抑制IFN-I信号通路。
除了先天免疫信号之外,凋亡被公认为是一种有效的宿主抗病毒防御机制,特别是在病毒感染的早期阶段,通过清除感染的细胞来实现。凋亡依赖于一组半胱氨酸蛋白酶,可以通过内源或外源途径激活。内源凋亡途径由细胞胁迫引发的线粒体外膜通透性增加引发,随后导致细胞色素c从线粒体释放到细胞质中,结果形成凋亡体、半胱氨酸蛋白酶-9的活化,以及随后的效应半胱氨酸蛋白酶-3和-7的活化。外源凋亡途径依赖于外部诱导,激活引发死亡受体,导致起始半胱氨酸蛋白酶-8和-10的活化。
模式机理图(图片源自Science Advances)
病毒感染可以诱导内源和外源凋亡途径。作为一个复制速度较慢的病毒,HCMV需要感染细胞的存活来建立感染、潜伏和重新激活,因此抑制凋亡对于该病毒尤为重要。已经报道HCMV编码UL37外显子1蛋白(UL37x1)通过结合促凋亡蛋白Bax来抑制内源凋亡,以防止线粒体色素c释放到细胞质中。另一方面,HCMV编码的UL36,可能更为人所熟知的是其另一个名字,即caspase-8活化的病毒抑制剂(vICA),已被发现通过直接结合前凋亡体caspase-8来抑制外源性凋亡,从而抑制其裂解为活性caspase-8。HCMV编码UL37x1和UL36作为对内源性和外源性凋亡的各自对抗措施。
先前曾报道caspase-8可以通过裂解受体相互作用丝氨酸/苏氨酸激酶1(RIP1)来抑制IRF3的激活,RIP1是IRF3磷酸化的信号增强剂。因此,可以合理推测HCMV UL36的表达可以通过抑制caspase-8来增强IRF3的激活,从而上调IRF3依赖的免疫信号。然而,在这里,当在HCMV感染的细胞中敲低或过表达UL36时,作者未能观察到IRF3磷酸化或IRF3下游免疫基因的转录的任何改变。这些有趣的发现引发了UL36可能具有某种免疫抑制活性的假设。作者随后发现,HCMV UL36可以直接结合IRF3,从而抑制其与TBK1和STING的相互作用,进而抑制IRF3的激活和IRF3依赖的免疫信号,这抵消了其作为caspase-8抑制剂的增强效应。此外,UL36对外源性凋亡和IRF3依赖的免疫信号的双重抑制对于感染细胞中的HCMV复制至关重要。
原文链接:
https://www.science.org/doi/10.1126/sciadv.adi6586


