一例食管小细胞癌免疫治疗实践解读 | 免疫治疗能否破除食管小细胞癌难治魔咒?
时间:2023-10-31 14:28:19 热度:37.1℃ 作者:网络
原发性食管小细胞癌(PSCCE)是食管癌的一种特殊病理类型,属于神经内分泌癌,PSCCE发生率较低,较为罕见,具有恶性程度高、早期转移和预后不良等特征1。自1952年由Mckeown首次报告后2,陆续有更多案例报告。据统计,PSCCE约占食管癌的0.5%~2.4%3。
目前,国内外尚无关于PSCCE的标准治疗策略。而近年来免疫治疗在晚期食管癌中发展迅速,众多大型III期临床研究已证实,晚期食管癌患者可从一线免疫治疗中获益,这改变了晚期食管癌的一线治疗策略4-7,。但免疫治疗在PSCCE患者中的疗效如何,尚无大型临床研究论证。本文特分享一例PSCCE免疫治疗的临床实践,为临床探索PSCCE免疫治疗方案提供参考。
病例介绍
一、 基本情况
基本信息:患者男性,52岁。
主诉:因“声音嘶哑3周”于2023-02-23入院。
现病史:患者3周前无明显诱因下出现声音嘶哑,伴咳嗽咳痰,无进食困难、无恶心呕吐、无呕血黑便等不适症状。2023-2-12就诊苍南县第三人民医院查电子胃镜示:距门齿约30cm-27cm处见一约0*2cm隆起凹陷型病灶,食管癌考虑。时未予处理,后于2023.2.20就诊我院,查超声示:胸骨上窝偏左侧近气管旁、左颈及左侧锁骨上淋巴结肿大(转移性首先考虑)。查胸部CT示:食管中段管壁增厚。纵隔多发肿大淋巴结,倾向转移。左锁骨上淋巴结增大。肝脏多发结节影,转移符合,胰腺体部低密度灶。现患者一般可,仍诉声音嘶哑,进食可,为进一步诊治,门诊拟“食管占位”收住入院。病来,精神尚可,食欲睡眠不佳,二便正常,近来体重无明显下降。
既往史:无特殊。
个人史及家族史:有吸烟史 40支/d*30年;饮酒史白酒200ml/d*30年。无肿瘤家族史。
查体:胸骨上窝偏左侧近气管旁、左颈及左侧锁骨上淋巴结肿大,较大者长径约3cm,边界尚清,位置固定,无压痛。心肺腹未及明显异常。
二、 治疗前辅助检查
1、实验室检查:血常规、血生化、凝血功能、肿瘤标记物等未见明显特异性改变。
2、影像学检查:
· 2023.2.20 胸腹增强CT:食管中段管壁增厚。纵隔多发肿大淋巴结,倾向转移。左锁骨上淋巴结增大。肝脏多发结节影,转移符合,胰腺体部低密度灶,请结合MR。
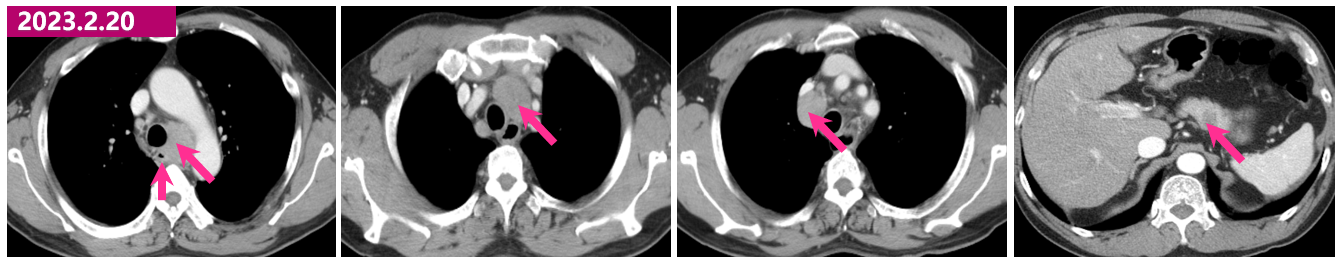
2023.2.20 胸腹增强CT
· 2023.2.21 喉镜:左侧披裂活动受限,右声带、右披裂活动可,左声带麻痹。
· 2023.2.28 PET-CT:
①食管中段管壁略增厚伴稍高代谢,食管癌首先考虑;
②胰腺体部小结节伴高代谢,恶性考虑,原发?转移?
③肝脏多发低密度结节伴高代谢,转移考虑;
④左侧锁骨上、纵隔多发肿大淋巴结伴高代谢,转移考虑;
⑤右侧声带未见占位伴高代谢,倾向炎性或生理性,请结合内镜检查。
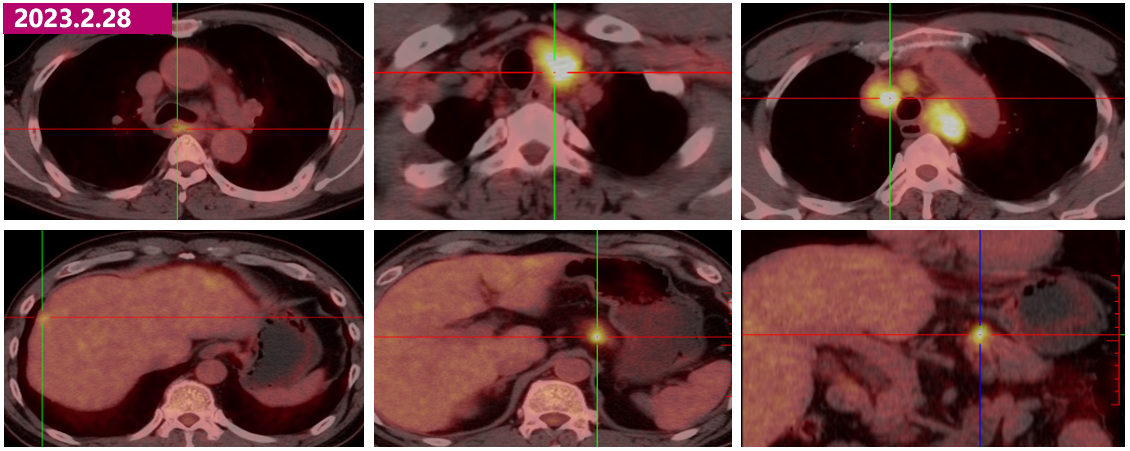
2023.2.28 PET-CT
· 2023.3.6 腹部MR:病灶呈环形强化,最大者约1.5cm,边界清。门脉影未见明显异常。胰腺体部可见大小约2.4cmx2.0cm结节,DWI扩散受限,增强后环形强化。肝实质内多发转移瘤。胰腺体部结节,倾向转移可能大。
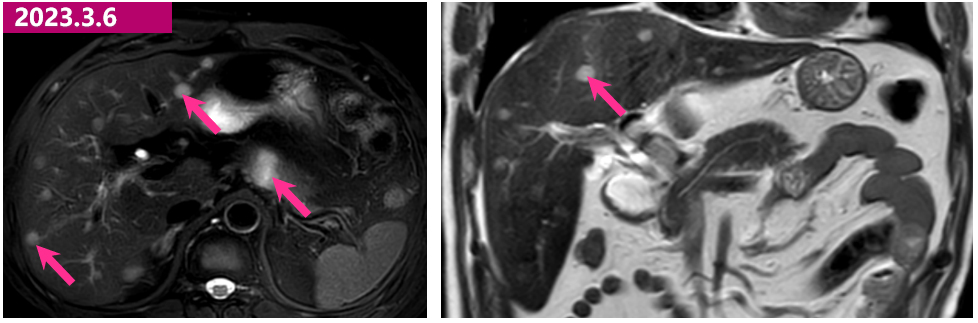
2023.3.6 腹部MR
3、病理学检查:
2023.2.27胃镜活检病理会诊报告:(食管)重度挤压异型细胞,结合免疫组化,符合小细胞神经内分泌癌。免疫组化S23-851片:CK(部分+)、Sy(部分+)、CgA(部分+)、CD56(部分+)、Ki-67(+,80%)、P40(-)、LCA(-)。
三、 诊断
1、临床诊断:
√ 食管恶性肿瘤(胸段,cT2N2M1, IVB期)
√ 胰腺继发恶性肿瘤
√ 肝部和肝内胆管继发性恶性肿瘤
√ 淋巴结继发性恶性肿瘤
2、病理诊断:小细胞神经内分泌癌。
四、 治疗经过
一程治疗方案:
基于多学科会诊(MDT)讨论结果,告知患者知情同意,结合患者意愿,于2023.3.9予以第1周期EP方案化疗联合免疫治疗,具体为:依托泊苷 180mg D1-3+顺铂 45mg D1-3,联合斯鲁利单抗 0.3g D1。
1周期治疗后,患者出现III度血小板减少,于2023.3.28第2周期起减量为依托泊苷140mg+顺铂36mg,继续联合斯鲁利单抗 0.3g D1。
一程疗效评估:PR
2023.4.17 胸腹部增强CT:食管癌化疗联合免疫后,对照2023.02.20CT:食管中段管壁增厚肿胀较前稍好转。原纵隔多发肿大淋巴结较前明显缩小;左锁骨上淋巴结较前缩小。肝脏多发转移瘤,较前缩小、消失,请复查。
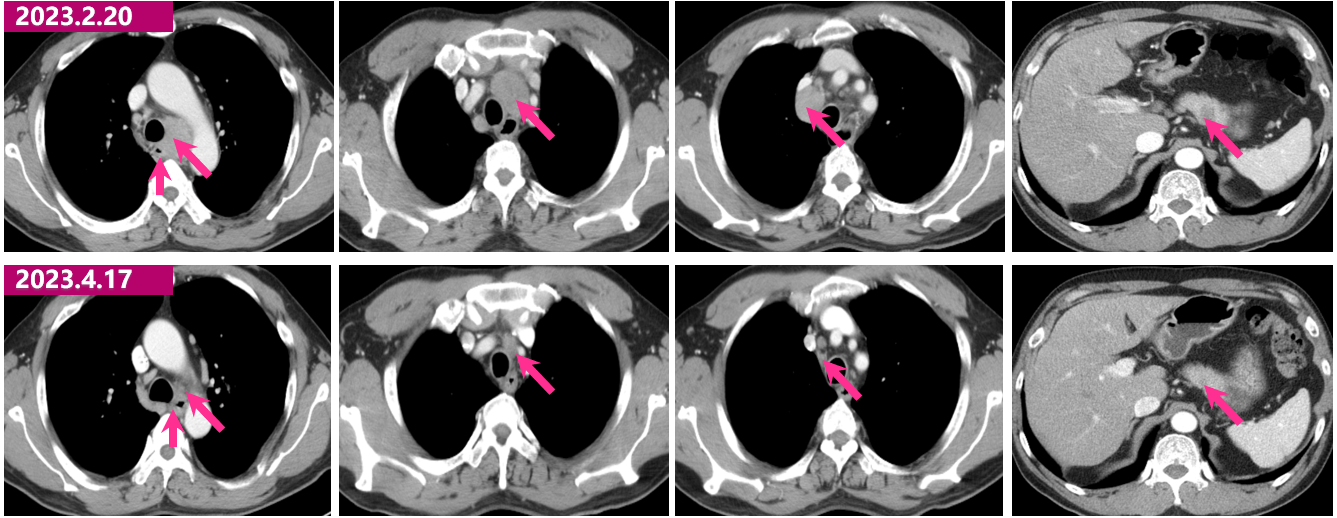
2023.4.17与2023.02.20胸腹部增强CT对比
二程治疗方案:
基于一程疗效评估,疗效为PR, 副反应方面,1周期后出现III度血小板减少,2周期起减量为依托泊苷140mg+顺铂36mg。继续联合斯鲁利单抗 0.3g D1。
2023.4.18、2023.5.9继续予以第3-4周期EP方案联合免疫治疗,具体为:依托泊苷 180mg D1-3+顺铂 45mg D1-3,联合斯鲁利单抗 0.3g D1。
二程疗效评估:PR
2023.5.31 胸腹部增强CT: 食管癌化疗联合免疫后,对照2023.04.17CT:食管中段管壁增厚已不明显。右侧气管食管沟旁、纵隔、左侧锁骨上多发淋巴结,较前大致相仿。肝脏多发转移瘤,较前缩小、减少;胰腺体部低密度灶本次未见明确显示,建议复查。
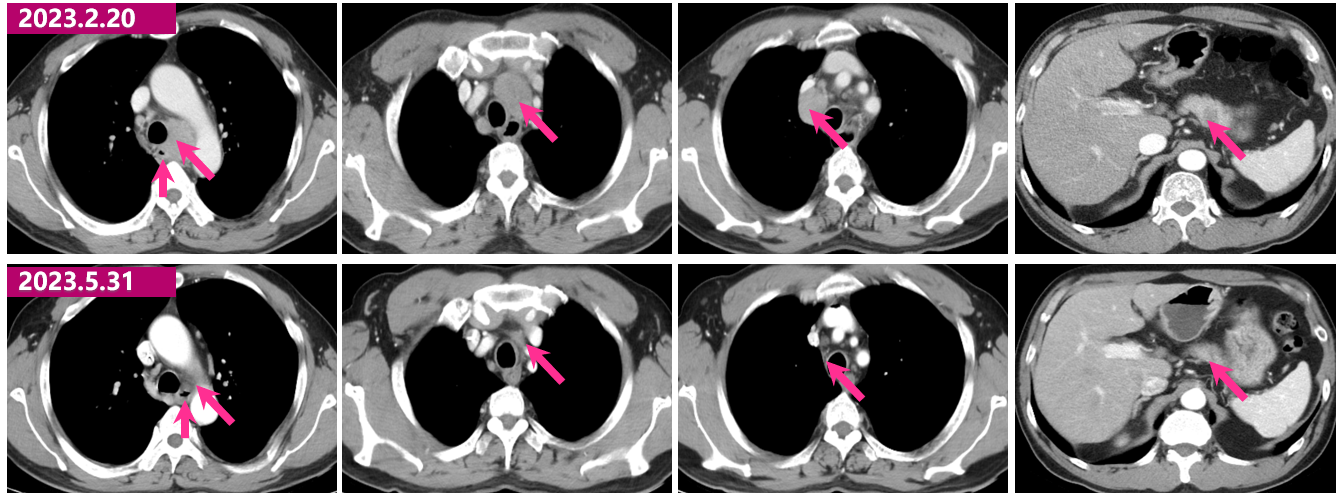
2023.5.31与2023.02.20胸腹部增强CT对比
二程评估后治疗方案调整:
基于二程疗效评估,疗效为PR,副反应方面,减少化疗剂量后,出现II度血小板减少。
2023.6.1、2023.6.26继续予以第5-6周期EP方案联合免疫治疗,具体为:依托泊苷 180mg D1-3+顺铂 45mg D1-3,联合斯鲁利单抗 0.3g D1。
后续治疗方案:
患者疗效评估持续PR,已化疗联合免疫治疗6周期,肝脏、胰腺转移病灶明显退缩、消失,进食梗阻不明显,声音嘶哑明显改善。
基于MDT 讨论结果,告知患者知情同意,结合患者意愿,后续治疗方案制定如下:
1)继续免疫维持治疗,具体为:斯鲁利单抗 0.3g Q3W;
2) 患者病理类型为小细胞神经内分泌癌,前期疗效较好,脑转移风险较高,建议全脑预防性放疗(PCI)。具体为:2023.7.31起行PCI,DT:25Gy/10F;予以预防性全脑放疗。
3)继续定期随访中。
病例小结:

讨论
不同于食管鳞癌,PSCCE恶性程度高、预后差,且目前国内外指南尚无关于PSCCE的治疗规范8,9。根据《2022年CSCO神经内分泌肿瘤诊疗指南》,对于局部晚期、不可切除或转移性PSCCE及其它神经内分泌癌,一线治疗主要采用基于铂类药物的化疗方案10。一项回顾性研究显示,依托泊苷联合顺铂或卡铂化疗一线治疗转移性神经内分泌癌的客观缓解率(ORR)为30%~70%,中位总生存期(OS)为11~19个月11。此外,一线治疗也可考虑伊立替康联合顺铂方案,有回顾性研究显示,伊立替康联合顺铂方案一线治疗晚期PSCCE的ORR为50%,OS为12.6个月12。
近年来,免疫治疗也开始了在神经内分泌癌领域的探索,并获得了初步的疗效13。有研究显示,PSCCE的肿瘤突变负荷及PD-L1阳性率较高,这提示免疫治疗对PSCCE患者可能有效14。但PSCCE的免疫治疗选择暂无相对应的临床试验可参考,免疫治疗药物如何选择值得思考。根据ASTRUM系列研究,斯鲁利单抗在晚期小细胞肺癌、晚期食管癌中均呈现了较好的临床获益和可控的不良反应15,16,这为本例PSCCE患者运用斯鲁利单抗联合依托泊苷和顺铂带来了一定的参考。
本病例患者基于MDT讨论结果,在患者知情同意的情况下,结合患者意愿,给患者制定了斯鲁利单抗免疫治疗联合依托泊苷和顺铂的一线治疗方案,实现了持续PR,复查显示肝脏、胰腺转移病灶明显退缩、消失,同时患者的进食梗阻的症状较治疗前好转,声音嘶哑也得到了明显改善,这给晚期PSCCE患者的治疗带来了极大信心。但免疫治疗在PSCCE一线治疗中应用的实际疗效和安全性,仍需大型临床研究进一步验证。
总的来说,免疫治疗在食管癌中具有广阔前景。随着免疫治疗进展,相信未来免疫治疗能为PSCCE患者带来新的曙光,而对PD-L1表达水平及肿瘤突变负荷等免疫标志物的精准划分,仍是未来免疫治疗持续探索的方向。
参考文献:
1 蔡高科, 陈永顺.原发性食管小细胞癌的治疗进展[J].微循环学杂志, 2022, 32(4):75-79.
2 MCKEOWN F. Oat-cell carcinoma of the oesophagus. J Pathol Bacteriol. 1952;64(4):889-891.
3 Lu XJ, Luo JD, Ling Y, et al. Management of small cell carcinoma of esophagus in China. J Gastrointest Surg. 2013;17(7):1181-1187.
4 Sun JM, Shen L, Shah MA, et al. Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study [published correction appears in Lancet. 2021 Nov 20;398(10314):1874]. Lancet. 2021;398(10302):759-771.
5 Luo H, Lu J, Bai Y, et al. Effect of Camrelizumab vs Placebo Added to Chemotherapy on Survival and Progression-Free Survival in Patients With Advanced or Metastatic Esophageal Squamous Cell Carcinoma: The ESCORT-1st Randomized Clinical Trial. JAMA. 2021;326(10):916-925.
6 Doki Y, Ajani JA, Kato K, et al. Nivolumab Combination Therapy in Advanced Esophageal Squamous-Cell Carcinoma. N Engl J Med. 2022;386(5):449-462.
7 Song Y, Zhang B, Xin D, et al. First-line serplulimab or placebo plus chemotherapy in PD-L1-positive esophageal squamous cell carcinoma: a randomized, double-blind phase 3 trial. Nat Med. 2023;29(2):473-482.
8 中国临床肿瘤学会(CSCO).食管癌诊疗指南2023.
9 NCCN Guidelines Version 3.2023:Esophageal and Esophagogastric Junction Cancers.
10 中国临床肿瘤学会(CSCO).神经内分泌肿瘤诊疗指南2022.
11 Iwasa S, Morizane C, Okusaka T, et al. Cisplatin and etoposide as first-line chemotherapy for poorly differentiated neuroendocrine carcinoma of the hepatobiliary tract and pancreas. Jpn J Clin Oncol. 2010;40(4):313-318.
12 Okuma HS, Iwasa S, Shoji H, et al. Irinotecan plus cisplatin in patients with extensive-disease poorly differentiated neuroendocrine carcinoma of the esophagus. Anticancer Res. 2014;34(9):5037-5041.
13 Klein O, Kee D, Markman B, et al. Immunotherapy of Ipilimumab and Nivolumab in Patients with Advanced Neuroendocrine Tumors: A Subgroup Analysis of the CA209-538 Clinical Trial for Rare Cancers. Clin Cancer Res. 2020;26(17):4454-4459.
14 Zhao Q, Chen YX, Wu QN, et al. Systematic analysis of the transcriptome in small-cell carcinoma of the oesophagus reveals its immune microenvironment. Clin Transl Immunology. 2020;9(10):e1173.
15 Cheng Y, Han L, Wu L, et al. Effect of First-Line Serplulimab vs Placebo Added to Chemotherapy on Survival in Patients With Extensive-Stage Small Cell Lung Cancer: The ASTRUM-005 Randomized Clinical Trial. JAMA. 2022;328(12):1223-1232.
16 Song Y, Zhang B, Xin D, et al. First-line serplulimab or placebo plus chemotherapy in PD-L1-positive esophageal squamous cell carcinoma: a randomized, double-blind phase 3 trial. Nat Med. 2023;29(2):473-482.


