病理干货 | 关于浆液性输卵管上皮内癌,我们真正了解多少?
时间:2023-10-31 14:37:47 热度:37.1℃ 作者:网络
几十年来,卵巢高级别浆液性癌的前期病变通常被认为发生在卵巢。在过去的20年里,来自多种临床病理、免疫组织化学和分子研究的大量数据揭示了这一主题,并阐明输卵管浆液性输卵管上皮内癌(STIC)是绝大多数卵巢、输卵管和腹膜高级别浆液性癌的前期病变。然而,诊断STIC的标准在多项研究中有所不同,因此,需要使用统一标准来促进病理学家之间的沟通,提高诊断STIC的可重复性,以及提高研究中分类的准确性,并确定该病变的自然病史。最近,发表在《Histopathology》中的综述性文章:Serous tubal intra-epithelial carcinoma: what do we really know at this point?,总结了STIC的诊断和发病机制的最新进展,在高风险卵巢/输卵管/腹膜癌行预防性卵巢、输卵管切除术(以及散发性癌症)标本中发生的STIC,其他部位发生的高级别浆液性癌的起源问题及STIC的临床行为。
01 STIC形态学表现
几乎所有输卵管上皮内癌都是高级别浆液性癌,STIC的病变细胞表现出分泌细胞分化。然而,最近也有罕见的子宫内膜样上皮内癌/瘤变的报道。
STIC是可以在组织学水平上识别的最早的输卵管癌。可以是单灶、也可以是多灶的,多数病例局限于输卵管远端或伞端。一些研究人员还认为STIC经常发生在输卵管-腹膜交界处或附近。上皮下层无间质浸润,在浸润性癌附近可能发现STIC/STIC样病变。
低倍镜下,STIC比相邻正常上皮染色深(图1)。上皮是平坦的,但可能存在一定程度的分层。细胞的腔缘侧可以是直的,或者具有不规则轮廓和靴钉状。在细胞层次增加时,输卵管管腔中可能会看到小簇松散或分离的细胞。
高倍镜下,STIC的细胞不含纤毛,它们表现出核增大、核质比增加、染色质分布过深或不规则、极性丧失、显著的细胞核和有丝分裂(图2)。细胞核通常是圆形的,也可以呈现椭圆形或柱状形态。

图1。浆液性输卵管上皮内癌(STIC)。与正常粘膜(右上角)相比,STIC看起来更厚,染色更暗。
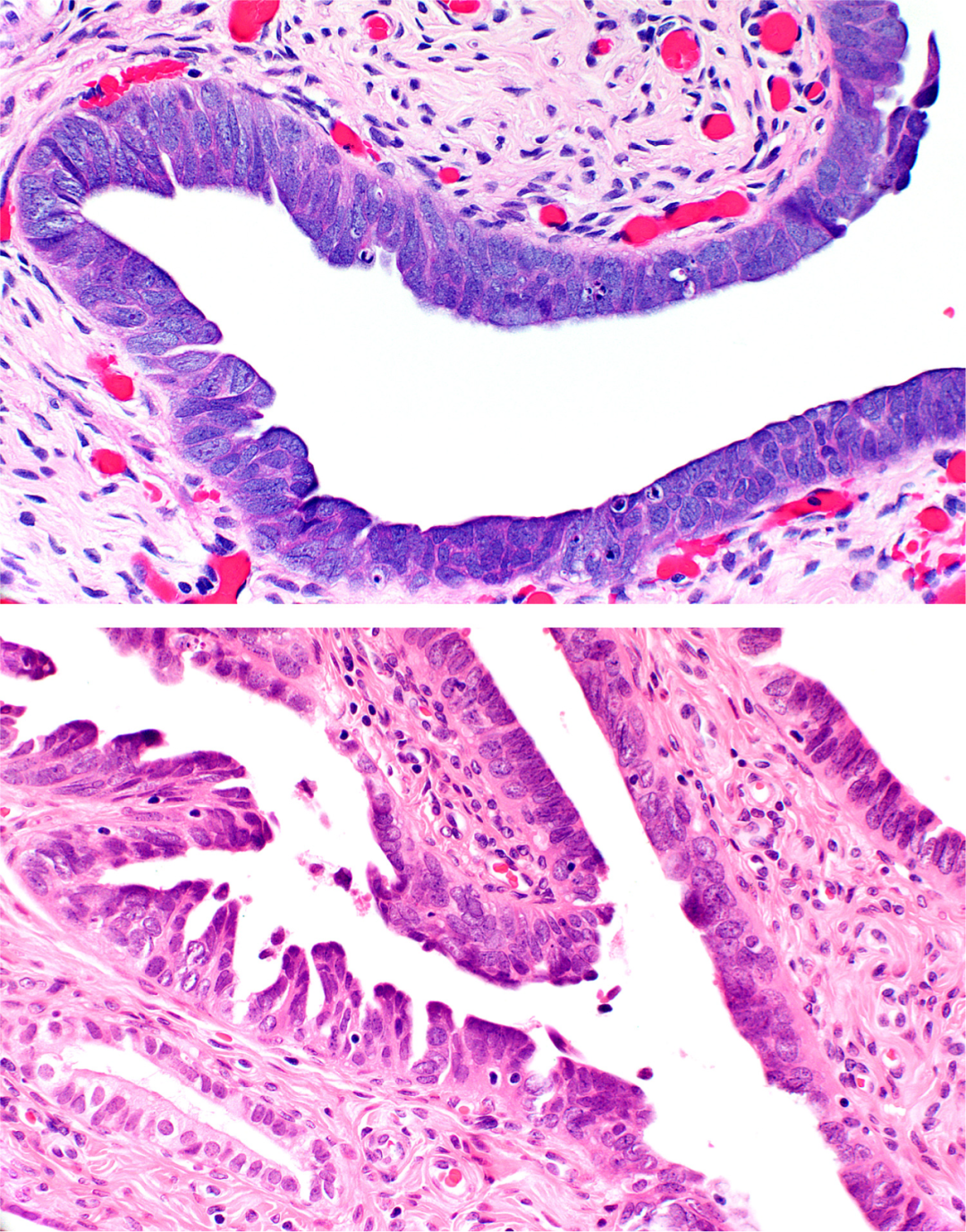
图2。(上)浆液性输卵管上皮内癌(STIC)。管腔边缘平坦,细胞无纤毛。细胞核一致,增大,圆形,偶尔可见明显的核仁和凋亡小体。右上角见早期脱落的上皮簇。
(下)与A相反,管腔边缘是锯齿状的。纤毛细胞缺失,染色质分布异常,细胞核增大,变圆。左下角正常粘膜与之对比。
02 免疫组织化学结果
STIC显示异常的p53表达模式,在大多数情况下,细胞核染色弥漫强阳,这与TP53错义突变相关。在一小部分病例中,STIC将显示完全没有染色。后者与TP53无义突变相关。卵巢癌中也描述了一种罕见的p53细胞质染色模式。
Ki-67增殖指数显著增加。一项研究表明,Ki-67的平均增殖指数为72%,范围为40-95%,在另一项研究中,平均增殖指数和范围分别为36%和12-71%。
p16基本上在所有子宫内膜浆液性癌和一些卵巢高级浆液性癌中都是弥漫性强阳性,STIC可以具有类似的表达模式。但这种模式仅在少数STIC中出现,因此p16染色通常没有帮助。
另一个在STIC中过表达的标志物是laminin,它表现出弥漫强烈的细胞质表达。
03 组织学和免疫组织化学在诊断STIC和非典型上皮病变中的联合应用
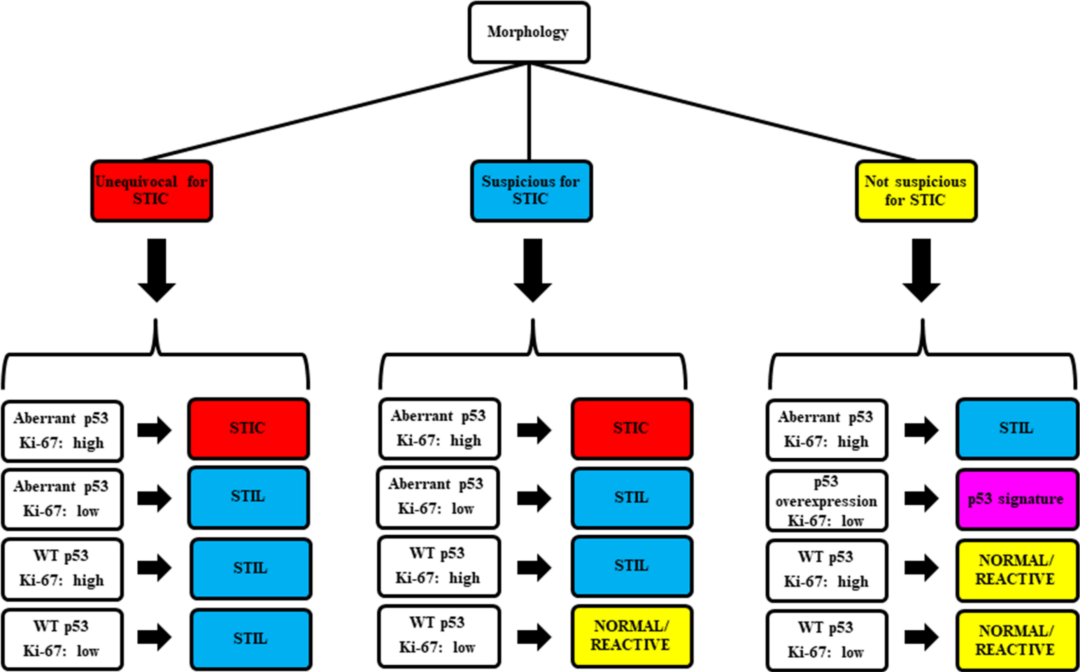
病理学家对STIC的形态学诊断标准各不相同,研究表明,仅使用形态学诊断可重复性不高。因此,研究者开发了一种诊断路径,将组织学特征与p53和Ki-67的免疫组织化学结果相结合,以帮助对输卵管上皮异型性进行分类,提高诊断STIC的可重复性。
疾病分类:STIC、介于STIC和p53印记之间的非典型病变(浆液性输卵管上皮内病变〔STIL〕)、P53印记和正常/反应性(图4-7)。
诊断路径见下图(图3):
第1步
从组织学角度确定STIC分类——明确的STIC,可疑STIC,或者不怀疑是STIC。
第2步
根据P53和KI-67结果进一步分类,p53免疫表型异常(突变型)或正常(野生型)。Ki-67的表达可分为增殖指数低(<10%)或高(≥10%)。
第3步
依据形态及免疫表型将病变分类为STIC、STIL、p53印记或正常/反应性。
研究证明,正常输卵管粘膜和STIC的Ki-67指数通常分别<10%和>10%。此外,在其他研究中,Ki-67低指数与Ki-67高指数的阈值在不同观察者间有较高的可重复性。然而,偶尔也会出现这样的情况,在没有非典性的背景粘膜显示Ki-67增殖略微增加。在这种情况下,评估邻近非典型病变的Ki-67指数可能具有挑战性。需要强调的是,p53和Ki -67评估应在非典型病变中进行。
非典型性病变(明确的STIC或可疑的STIC)加上p53的异常表达模式和高Ki-67指数,增加了STIC诊断的可重复性。应该注意的是,2020年世界卫生组织女性生殖器官肿瘤分类也使用了形态学联合p53/Ki-67免疫组织化学染色作为诊断STIC的基本标准。当STIC细胞扩散到正常粘膜上皮细胞下面和/或之间时,会错误地给人留下野生型/正常p53模式和低Ki-67指数的印象,在评估这些免疫染色时,结合形态学特征至关重要。
在常规实践中,仅评估非典型病灶中的p53和Ki-67的免疫组织化学染色,然而,其他妇科病理学家可能会争辩说,如果在侵袭性高级别浆液性癌的情况下,没有必要进行免疫染色来诊断STIC。此外,符合STIL条件的病变可能被描述为“上皮非典型性”,并且可以在病理报告中发表评论,解释该病变不符合STIC的诊断标准。建议不要使用术语“p53印记”,因为目前这种命名应该仅限于研究目的。
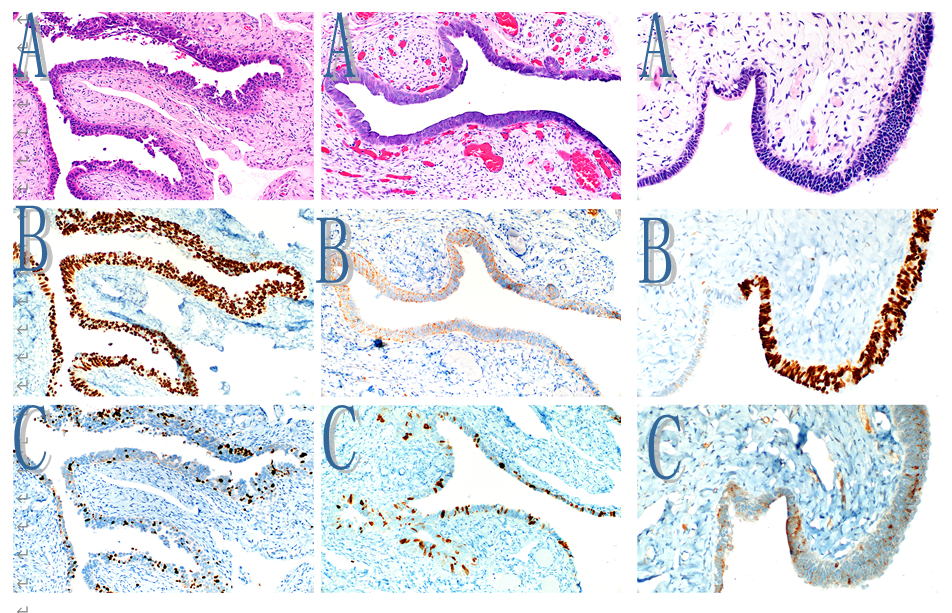
图4 图5 图6
图4。浆液性输卵管上皮内癌(STIC)。A、 本例显示细胞核异型性、上皮分层和管腔表面边缘不规则。B、p53广泛表达(异常模式)。
C、高Ki-67指数。
图5。浆液性输卵管上皮内癌(STIC)。A、粘膜表现出明显的非典型性(高倍放大见图2A)。B、 p53核表达完全丧失(无效模式)。这一发现被认为是一个反常的结果。颗粒状核周染色是人为的,不应被误解为罕见的细胞质突变表达模式。其他地方存在阳性的内部对照(此处未显示)。
C、 Ki-67增殖指数高
图6。浆液性输卵管上皮内病变(STIL)。A、细胞核增大、染色深、分层和细胞核一致(中间、底部和右侧)的存在引起了对浆液性输卵管上皮内癌(STIC)的怀疑。正中央左侧和左下象限显示正常粘膜,以供比较。B、非典型区域显示p53的弥漫性表达(异常模式)。请注意,一些正常的纤毛细胞嵌入在非典型细胞区域内。C、Ki-67指数较低。注意存在细胞质染色假象。这些综合发现(A–C)不符合STIC的诊断条件。
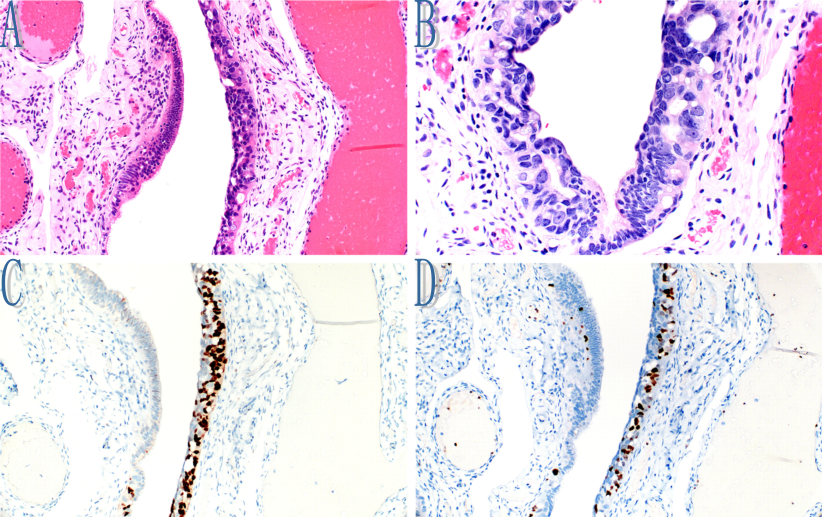
图7。浆液性输卵管上皮内癌(STIC)细胞在正常粘膜上皮细胞下方和之间扩散。
A、右侧包含非典型病灶,仅比左侧显示的正常上皮略厚。然而,在这个放大倍数下,STIC的细胞核显得更大、更浓染。
B、在A中未显示的邻近病灶中,在正常粘膜上皮细胞下方和之间存在具有圆形细胞核和突出核仁的STIC的非典型细胞。照片中央下部有一小块更容易辨认的正常纤毛细胞。
C、p53染色显示STIC细胞内弥漫性表达(与A中所示的病灶相同)。p53阴性的为正常上皮细胞。
D、Ki-67染色显示STIC细胞内的高增殖指数(与a中所示的病灶相同)。Ki-67阴性的为正常上皮细胞。在这种情况下,p53和Ki-67联合使得非典型性病灶(包括与非典型细胞分布的相关性和免疫组织化学表达的定位)明确诊断为STIC。具体来说,这种情况下的p53结果不应仅仅因为p53阳性和阴性细胞混合而被解释为“正常/野生型”。
04 在预防性双侧输卵管卵巢切除术中附带检测STIC
因为BRCA胚系突变人群患卵巢癌/输卵管癌/腹膜癌的风险升高,有人建议对BRCA1和BRCA2突变携带女性,分别在35-40岁和40-45时进行预防性输卵管卵巢切除术,以显著降低癌变风险。为了全面检查输卵管,对这些标本进行大体处理,首选SEE-FIM(FIMbria的切片和广泛检查)方案。建议每个蜡块一张HE切片。此外,一项研究表明,常规深切对于预防性切除标本可能不是必要的,但偶尔,在深切的HE切片发现微小的STIC,而这在第一张H&E切片上并不存在。因此,在许多标本中,微小的STIC可能会被遗漏。在多项大型研究中,2-14%的接受风险降低手术的患者在手术期间或手术标本中发现了卵巢、输卵管或腹膜的偶发癌。然而,在其他几项研究中,这种频率为3-5%,大多数癌症是输卵管或卵巢的原发性肿瘤(以孤立STIC或浸润性癌的形式,有或没有STIC)。尽管如此,一小部分肿瘤原发于腹膜或卵巢转移性乳腺癌。
05 在其他切除标本中偶然发现STIC
偶然的STIC不仅在预防性输卵管卵巢切除术标本中发现。在其他输卵管卵巢切除术中也可以检测到偶发性STICs。这类女性通常没有已知的遗传风险,可能是散发性病例。在这种情况可能是孤立的STIC或与侵袭性高级别浆液性癌相关的STIC。多项研究表明,常规标本中发现STIC的频率<1%。此外,一项加拿大人的研究数据,9392例良性病例中STIC的识别率<0.01%;然而,应该注意的是,这种发生率可能被低估了,因为无法确保输卵管组织的全面取材。
06 STIC的发病机制和分子改变
STIC在输卵管内可能是多灶性的,并且克隆性互相独立。在90%以上的STICs中检测到TP53突变,这表明该基因的突变是致癌的早期事件。其他分子和遗传变化包括:染色体异常;CCNE1/cyclinE拷贝数增加/扩增/过表达;端粒缩短;层粘连蛋白、Rsf-1、脂肪酸合成酶上调和过度表达;和LINE-1反转录转座子失调。STIC被认为是浸润性输卵管高级别浆液性癌的致癌序列中第一个形态学可识别的步骤。
“p53印记”被认为是STIC的一个假定前体病变,由≥12个连续的分泌细胞组成,对p53表现出强烈的染色,但上皮缺乏异型性(图8)。与大多数STIC不同,p53印记具有低Ki-67增殖指数,与正常输卵管上皮相似。一项研究表明,Ki-67的平均增殖指数为3%,范围从0到30%。p53印记还显示c-H2AX的免疫染色,这表明DNA损伤,端粒缩短也存在。p53印记通常存在于输卵管的伞端。目前认为p53印记和STIC是输卵管高级别浆液性癌发生发展的重要步骤。因此,输卵管伞端粘膜受到损伤,随后由于分泌细胞内DNA损伤导致的p53蛋白积累而产生p53印记。在获得TP53突变(通常伴有TP53所在的17号染色体缺失)、持续的细胞增殖和额外的分子改变后,p53印记最终可以进化为STIC。然而,这种p53印记的恶性转化被认为可能只发生在极少数患者中,大多数p53印记在临床上是无害的。
p53印记的一个潜在前体病变是分泌细胞生长(SCOUT)[图9]。该病变由富含分泌细胞的上皮病灶组成;然而,已经报道了具有乳头状结构和纤毛细胞的变型。p53印记可以被视为具有异常(弥漫)p53表达的SCOUT的一个子集(即p53[+]SCOUT),尽管在其他出版物中,SCOUT的名称有时暗示除p53印记之外的分泌细胞丰富的病变。p53阴性的SCOUT通常缺乏DNA损伤,它们可以在整个输卵管黏膜任何部位发现,与p53印记和STIC形成对比,后者优先发生在输卵管伞端。但是,SCOUT具有一些与p53印记和高级别浆液性癌重叠的特征,如PAX2表达减少。后者在正常输卵管粘膜的分泌细胞中表达。SCOUT与患者年龄增长之间存在统计学关联。此外SCOUT在高级别浆液性癌患者中更常见。然而,SCOUT是否是克隆的,SCOUT如何发展为p53印记和STIC,以及SCOUT和p53印记/STIC之间的具体关系尚不清楚。
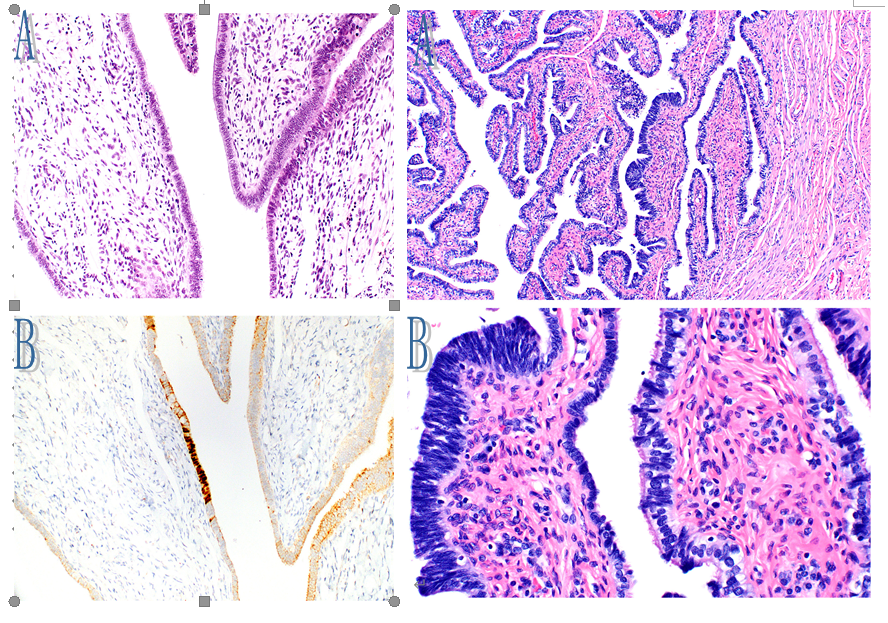
图8 图9
图8。p53印记。A、无纤毛细胞,无明显的异型性;B、p53在离散病灶中广泛表达(异常模式)。Ki-67指数(未显示)较低。
图9。分泌细胞生长(SCOUT)。A、中等放大倍数下(中心)无纤毛细胞的小病灶最初可增加浆液性输卵管上皮内癌的可能性。然而,(B)高倍镜检查显示没有非典型性(SCOUT显示在最左边;用于比较的正常粘膜显示在中间和右边)。
07 同时发生STIC和卵巢/腹膜/子宫内膜高级别浆液性癌时对起源部位的考虑
文献中大量的临床病理和分子证据表明,卵巢或腹膜高级别浆液性癌,若有STIC的存在则表明肿瘤起源于输卵管。19%至61%和29%至61%的原发性“卵巢”和“腹膜”高级别浆液性癌分别被证明共同存在STIC。在卵巢或腹膜高级别浆液性癌时,STIC的缺失还有其他几种可能的原因,例如(a)输卵管内STIC过度生长,(b)STIC存在于组织块中更深部位,在初始H&E切片上看不到,(c)新辅助化疗患者STIC发现率降低,(d)当病理学家在大体检查中分离卵巢和输卵管时,STIC可能仅局限于附着在卵巢上的输卵管伞端,随后在卵巢中形成肿块,而输卵管的其余部分没有病变。有人提出的另一种解释是“前兆逃逸”。根据这一概念,盆腔高级别浆液性癌可能源于含有TP53突变的输卵管非STIC上皮,该上皮最终移位并位于输卵管外部位。
尽管真正起源于输卵管的“卵巢”癌的比例可能被低估了,而且关于卵巢癌是否源于输卵管也有很多争论,但一项研究表明,分别有92%和86%的临床医生和病理学家认为现有已发表的证据支持输卵管起源,但一些研究表明,一些类似STIC的病变实际上可能是卵巢、子宫内膜或子宫颈腺癌的转移(图10),某些情况下继发累及输卵管(图10)。非妇科的一些转移癌沿输卵管上皮内播散,类似STIC,进一步支持了这种可能性。
根据AJCC《癌症分期手册》第8版,累及卵巢且同时共存STIC的高级别浆液性癌应归类为卵巢原发性IA癌。然而,癌症报告国际合作组织提出了在这种情况下确定原发部位的指南。根据这些建议,涉及多个部位并具有STIC,输卵管粘膜的浸润性癌,或未发现输卵管伞的高级别浆液性癌应被认为是原发于输卵管癌。此外,欧洲医学肿瘤学学会和欧洲妇科肿瘤学家协会协商会议建议,发生卵巢的高级别浆液性癌伴STIC应归类为IIA期输卵管原发性癌。
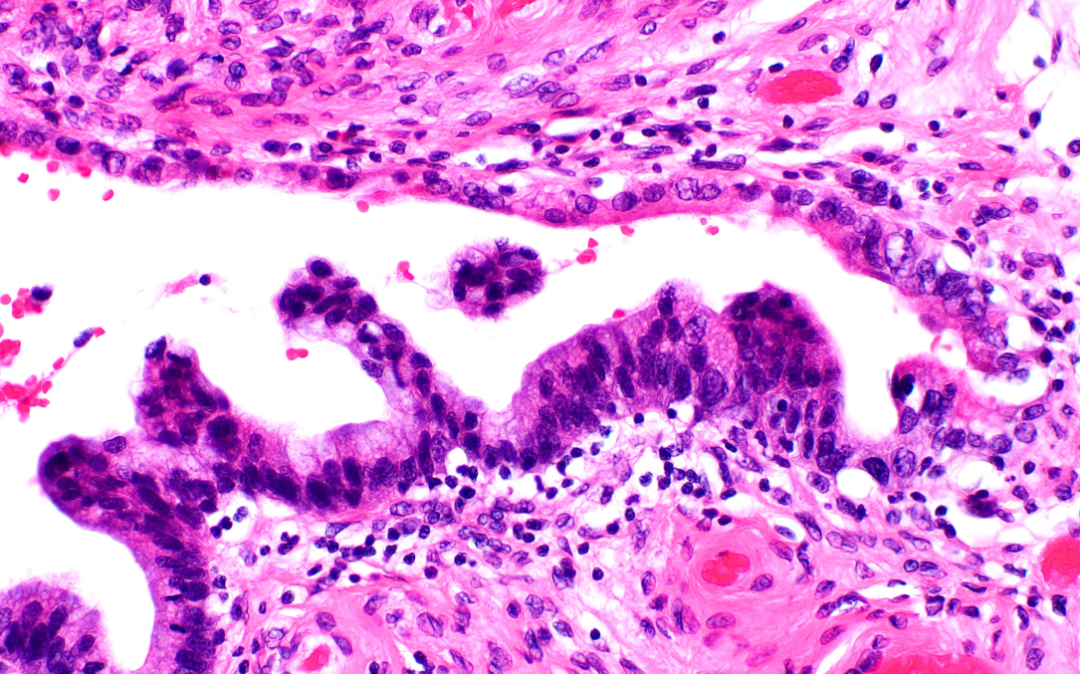
图10。转移性宫颈腺癌,输卵管上皮内播散。在低倍放大下,这样的例子最初可能会引起人们对浆液性输卵管上皮内癌的怀疑。尽管如此,高倍放大(如图所示)细胞质中粘蛋白存在是一个非常微妙的暗示。在这种情况下,患者有浸润性高分化宫颈腺癌的已知病史。本例输卵管病变显示WT-1阴性,p16阳性(弥漫染色模式),以及原位杂交高危型HPV阳性(免疫组织化学和原位杂交染色未显示)。这张照片中的转移性病变位于底部,而用于比较的正常粘膜位于顶部。
08 STIC的临床结果
Patrono等人和Van der Hoeven等人对文献的回顾表明,5-11%的发现了孤立STIC的女性,短期随访2.7-6.0年后患上了腹膜癌。这一时间间隔与基于体细胞突变的计算估计一致。两项研究的数学模型估计,从STIC发展到卵巢高级别浆液性癌的平均时间约为6年。在一些单系列研究中,尽管患者数量很少,但多达22%的STIC女性随后发展为癌。
早期的文献有限,因为病例数量相对较少,许多患者的随访间隔不到4年,并且一些出版物中没有提供随访时间。因此,后续癌症的实际风险基本上是未知的。短期随访的问题很重要,因为一些STIC患者在手术后9.8年内发展为癌症。在发生癌症的患者中,STIC和后续癌症都携带相同的TP53突变,表明它们的共同克隆起源。然而,在Steenbeek等人最近的一项荟萃分析中,包括115名STIC女性,估计发生腹膜癌的5年和10年风险分别为11%和28%。
应该注意的是,在文献中可用的临床数据中,部分STIC患者接受过化疗。此外,在一个系列中,由于发现STIC而进行了完整分期手术的患者中,有相当大比例的患者被检测到浸润性高级别浆液性癌,尽管患者总数很少。其他研究也注意到,在首次诊断STIC后,输卵管外部位出现了肿瘤。尽管如此,欧洲医学肿瘤学会和欧洲妇科肿瘤学家学会协商会议建议,在有明显孤立的STIC病例中应考虑腹膜分期。此外,其他因素也引起了人们对STIC恶性潜能的担忧,一般来说由于STIC通常位于输卵管的伞端,因此有可能将细胞直接种植到腹膜腔中。STIC在组织学和免疫组织化学上也与其他非侵入性病变相似,这些病变可导致扩散到其他解剖部位,如浆液性子宫内膜上皮内癌。
因此,鉴于上述关于临床行为的全部讨论,我们提出STIC作为一种恶性潜能不确定的输卵管病变,以反映当前的困境,更重要的是,促进未来的研究,以确定STIC的生物学性质和自然史。然而,我们承认,其他妇科病理学家可能认为STICs是“低转移潜能”,而不是“不确定的恶性潜能”,因为有人说它们实际上是完全恶性的,但大多数没有转移,类似于浆液性子宫内膜上皮内癌。
参考文献
Russell Vang& Ie-Ming Shih. Serous tubal intra-epithelial carcinoma: what do we really know at this point? (2022) Histopathology 81, 542–555. https://doi.org/10.1111/his.14722.


