病理干货 | 宫颈癌早筛新技术:DNA倍体定量分析
时间:2023-11-01 17:39:29 热度:37.1℃ 作者:网络
01 宫颈癌
宫颈癌发病率居妇科三大恶性肿瘤之首,是导致女性癌症死亡的第四大原因。2020年全世界约有60.4万例宫颈癌新发病例和34.2万例死亡病例,其中我国新发病例10.97万例,死亡病例5.9万例[1]。
宫颈癌的发生是一个漫长的过程,人乳头瘤病毒(HPV)感染是宫颈癌的元凶,宫颈癌的发生包含四个阶段:人乳头瘤病毒(HPV)感染→HPV病毒持续感染→宫颈癌前病变→宫颈癌,这个过程大约需要10年的时间[2-3]。因此,规范宫颈癌的预防、诊断和治疗是提高我国妇女健康水平的关键。开展人群筛查是促进宫颈癌早诊早治的有效措施,所以加强筛查组织管理,完善筛查流程,提高筛查质量和效率,显得尤为重要。
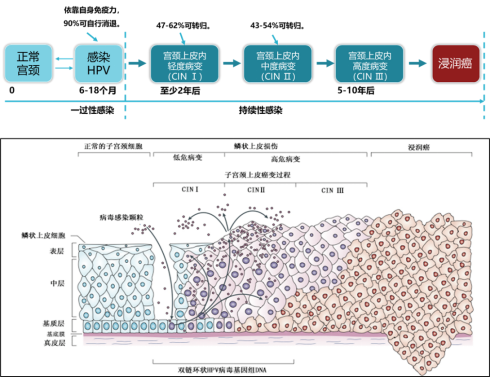
图1:宫颈癌的发展过程
02 DNA倍体定量分析——宫颈癌新型早筛技术
DNA含量的变化能作为反映肿瘤细胞繁殖情况的一项重要的生物学标志,因为每一个正常的体细胞核内均有23对染色体,在生理状态下,人体绝大多数的细胞处于静止期,DNA含量相当恒定。只有增殖期的细胞才会有染色体的复制和加倍,当致癌因素作用于细胞早期,细胞核内DNA结构和含量发生改变,即成为非整倍体细胞,最终发展为细胞形态异常和恶性增殖[4-5]。
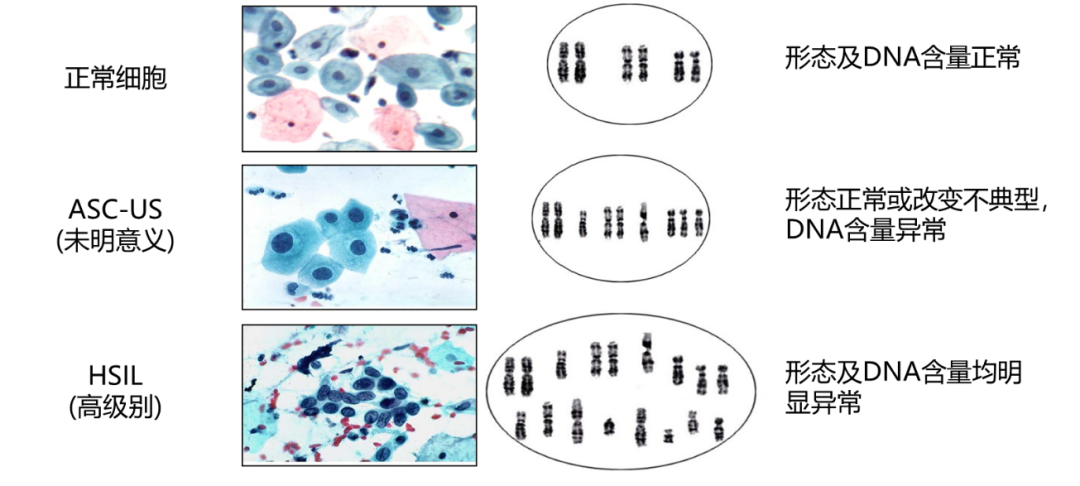
图2:宫颈细胞癌变过程
细胞DNA倍体分析技术通过对细胞核内DNA定量分析,检测早期癌及癌前病变,为病理医师诊断提供依据。细胞核内的遗传物质(DNA)是细胞生长、分化和增殖的基础,当细胞产生癌变时,细胞核的大小、核内DNA含量及DNA在细胞核内的结构和排列形式等都会发生异常改变。而通过DNA特异性染色的细胞核着色深浅度与DNA含量呈正相关。通过图像识别算法检测每一个细胞核内的积分光密度值(IOD),对标本中的细胞进行逐一检测,并分析细胞核内DNA倍体的变化情况,实现对细胞核内DNA含量的测定,从而检测出细胞核内DNA倍体的改变[6]。
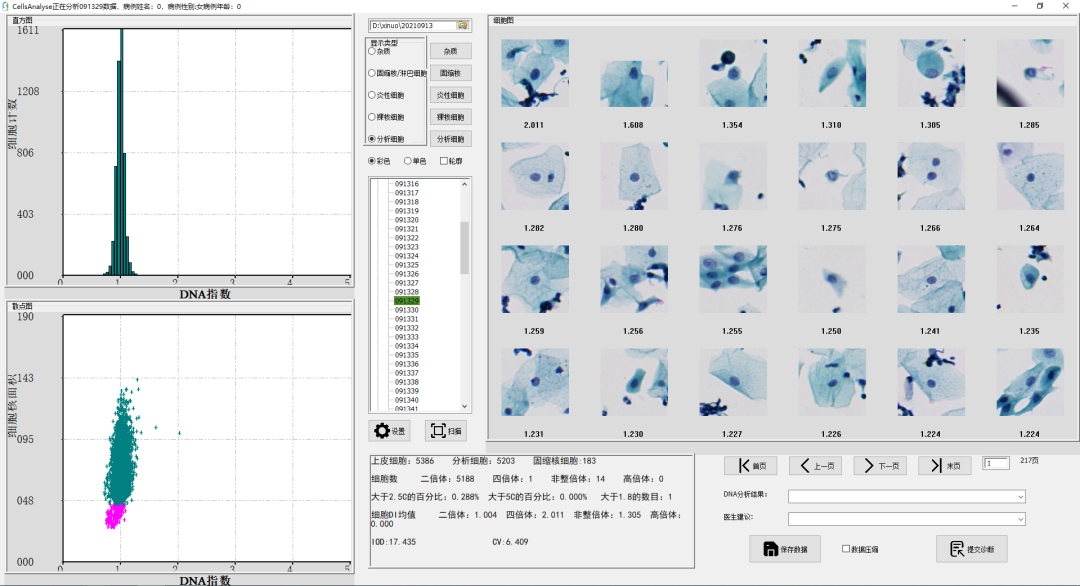
图3:DNA倍体扫描分析界面
在测定DNA含量时,为避免误差用DI指数(DNA index)表示[6]。当DI指数≥2.5时,说明细胞发生了病变。当DI≥2.5的细胞超过3个,则认为受检者为DNA倍体阳性,此时一般建议受检者进一步做阴道镜检测及病理组织活检;当DI≥2.5的细胞为1-2个时,则认为受检者为DNA倍体可疑,此时需要结合其他的筛查结果综合评估;当DI≥2.5的细胞为0时,则认为受检者为DNA倍体阴性,建议受检者按国家宫颈癌筛查方案正常随访即可。
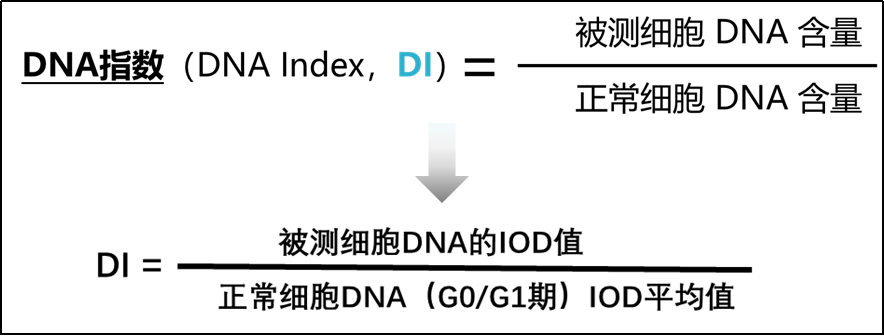
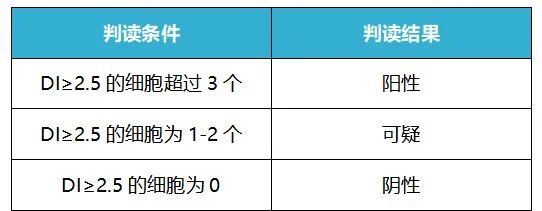
表1:DNA倍体定量分析结果判读标准[6]
03 宫颈癌早筛技术对比
随着全球宫颈癌发病年龄的提前和患病率的增加,宫颈癌筛查越来越普及。目前,临床上常用的宫颈癌早期筛查方法主要有HPV核酸检测、液基薄层细胞学检查(TCT)和DNA倍体定量分析。TCT检测和DNA倍体定量分析都属于宫颈细胞学分析,由于TCT检查读片工作量大、细胞病理学医师诊断水平参差不齐,受主观影响较大,增加了假阳性或假阴性的发生概率。全自动DNA定量分析系统在宫颈癌及癌前病变的诊断及预测中具有自动分析、结果客观、灵敏度和特异性强的优点,在一定程度上可以弥补TCT的劣势,在北美及欧洲,DNA定量分析已是常规的临床检测方法之一[7]。
以上三种检测方法在宫颈癌发生发展过程中不同时期的敏感性和特异性都有所不同。Bao L.等人对比了TCT细胞学检查与DNA倍体分析两种方法学在诊断宫颈上皮内高密度瘤变和宫颈癌的应用,结果表明,DNA倍体分析相比于TCT细胞学检查的灵敏度、特异性更高[8]。上海仁济医院丘丽华教授团队研究了HPV检测、TCT细胞学检测和DNA倍体分析在中国女性宫颈癌症筛查中的临床应用,结果表明DNA倍体分析对于高度鳞状上皮内病变特异性最高,且HPV检测联合DNA倍体分析的特异性高于HPV检测联合TCT细胞学检测,其认为DNA倍体分析在早期检测宫颈高级别癌前病变和癌前病变具有良好的特异性,可用于宫颈癌筛查中HPV阳性的分诊[9]。南昌大学第一附属医院梅金红教授认为DNA定量分析与TCT联合检测可以为分流ASC-US患者、指导临床随访和治疗提供帮助[10]。
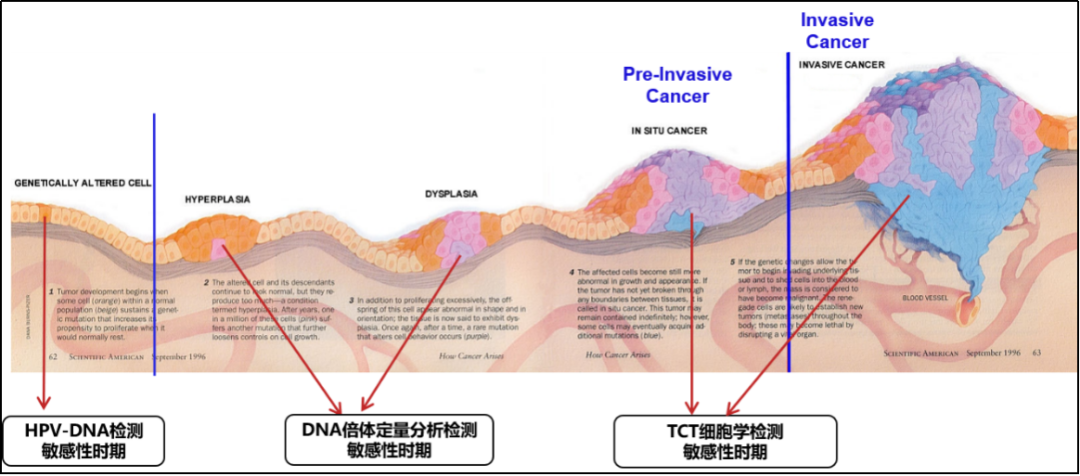
图4:不同方法学检测敏感性示意图
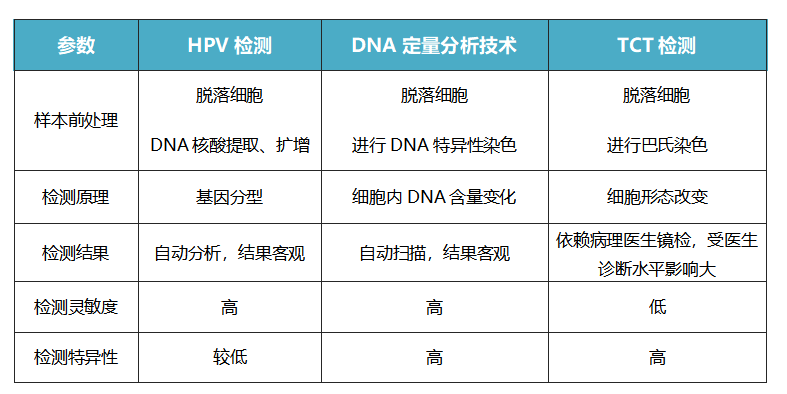
表2:宫颈癌早筛技术比较
04 DNA定量分析临床价值
01 宫颈癌及癌前病变诊断:病变细胞DNA含量异常早于形态学发生改变,通过测定细胞核内DNA含量,可发现早期病变,弥补细胞病理形态学诊断的不足。
02 宫颈癌恶性程度的评估:异倍体细胞越多,肿瘤细胞分化程度低,恶性程度高,生存率越低;反之,肿瘤细胞分化程度高,恶性程度低,生存率高。
03 宫颈癌治疗后疗效评估:经治疗后,非整体细胞数量减少或消失直接反应治疗的效果。
参考文献
[1] 中国临床肿瘤学会(CSCO)宫颈癌诊疗指南2022.
[2] Dong, S., et al., Hypermethylated PCDHGB7 as a universal cancer only marker and its application in early cervical cancer screening. Clin Transl Med, 2021. 11(6): p. e457.
[3] 黄波, Huang, Bo,等. 宫颈细胞DNA倍体定量分析联合液基细胞学在宫颈癌早期筛查中的应用价值[J]. 大医生, 2017(3):2.
[4] Lorenzato M,Caudroy S, Nou JM, et al. Contribution of DNA ploidy image cytometry to the management of ASC cervical lesions[J].Cancer,2008,114(4):263-269.
[5] Cang W, Li Q , Gu L , et al. Clinical Evaluation of DNA Ploidy for the Triage of HPV-Positive Chinese Women During Cervical Cancer Screening.[J]. American Association for Cancer Research (AACR), 2021(3).
[6] Garner D. Clinical application of DNA ploidy to cervical cancer screening: A review[J]. World Journal of Clinical Oncology, 2014, 5(5):35.
[7] Guillaud M, Benedet JL, Cantor SB et al. DNA ploidy compared with human papillomavirus testing (Hybrid CaptureⅡ) and conventional cervical cytology as a primary screening test for cervical high-grade lesions and cancer in 1 555 patients with biopsy confirmation [J]. Cancer, 2006, 107( 2): 309-318.
[8] Bao L. Clinical Observation on the Diagnosis of High-gradeCervical Intraepithelial Neoplasia and Cervical Cancer using Automatic DNA Ploidy Analysis. Zhongguo Jihua Shengyuxue Zazhi 2009; 163: 292-294.
[9] Cang W , Li Q , Gu L , et al. Clinical Evaluation of DNA Ploidy for the Triage of HPV-Positive Chinese Women During Cervical Cancer Screening.[J]. American Association for Cancer Research (AACR), 2021(3).
[10]梅金红, 徐姗, 韩永良, et al. 不能明确意义的不典型鳞状细胞伴DNA倍体异常在宫预早期病变筛查中的意义[J]. 中华病理学杂志, 2013, 42(12):4.


