CCR:特异性TCR-T疗法在滑膜肉瘤患者中显示安全有效
时间:2023-11-03 20:41:55 热度:37.1℃ 作者:网络
滑膜肉瘤(SS)是一种罕见的恶性软组织肿瘤,约占所有软组织肉瘤(STS)的5-10%,它主要出现在四肢;约有30%的病例发生在20岁以下的患者中。由于晚期局部复发和远端转移,滑膜肉瘤预后较差,这些情况在大约50%的病例中发生,并且主要涉及肺部,目前尚无标准的治疗方法。
目前滑膜肉瘤的一线治疗为蒽环类药物为基础的化疗,无论是单独使用还是与异环磷酰胺联合使用,其效果有限。此外,当前的二线化疗在最好的情况下也只能提供非持久的益处,因此需要更好的治疗方法。早期采用针对NY-ESO-1的特异性T细胞受体(anti-NY-ESO-1 TCR)进行过继性细胞免疫治疗用于滑膜肉瘤的临床结果令人充满希望,但存在潜在的缺陷,即转导的TCR α/β链与内源性TCR亚基错配。
近日,由 Akira Kawai 等研究人员在 Clinic Cancer Research 上发表了题为 Safety and Efficacy of NY-ESO-1 Antigen-specific T-cell Receptor Gene-Transduced T Lymphocytes in Patients with Synovial Sarcoma: A Phase I/II Clinical Trial 的文章,主要研究了NY-ESO-1抗原特异性T细胞受体基因转导的T淋巴细胞在治疗滑膜肉瘤患者中的疗效和安全性。这项针对8名晚期滑膜肉瘤患者的I/II期试验采用了可以特异性地下调内源性TCR的新技术,并有与之前使用anti-NY-ESO-1 TCR的研究相似的疗效和可接受的毒性,从而为治疗其他选择有限的滑膜肉瘤患者提供了更多支持。

该研究目的是评估对不适合手术切除且对蒽环类药物耐药的晚期或复发性滑膜肉瘤患者,输注表达NY-ESO-1抗原特异性T细胞受体基因的自体T淋巴细胞和抑制内源性T细胞受体表达的siRNAs(产品代码:TBI-1301)的安全性和有效性。
在本研究中符合条件的日本患者(HLA-A02:01或02:06,NY-ESO-1阳性肿瘤表达)接受环磷酰胺750 mg/m2(诱导期第-3天和第-2天),然后单次剂量为5 x 109(±30%)TBI-1301细胞分次输注(治疗期第0天和第1天)。主要终点是安全性相关(I期部分)和疗效相关(通过RECIST v1.1/irRECIST评估的客观缓解率[ORR];II期部分)。在I/II期部分都考虑了安全相关和疗效相关的次要终点。
患者倾向和基线特征
这项关于滑膜肉瘤治疗的研究分为两个阶段:I期和II期。表1总结了组成FAS的包括I期(n=3)和II期(n=5)的所有8名患者的基线统计学数据。其中7名患者为男性,1名患者为女性。中位年龄(最小值,最大值)为53.0岁(21岁至61岁)。所有病例在进入时均为IV期,并且在之前接受过治疗的患者中,有7名患者有手术史,3名患者有放射治疗史,以及8名患者有抗肿瘤药物治疗史。所有患者都有蒽环类药物治疗史,并且没有违反注册条件的情况。
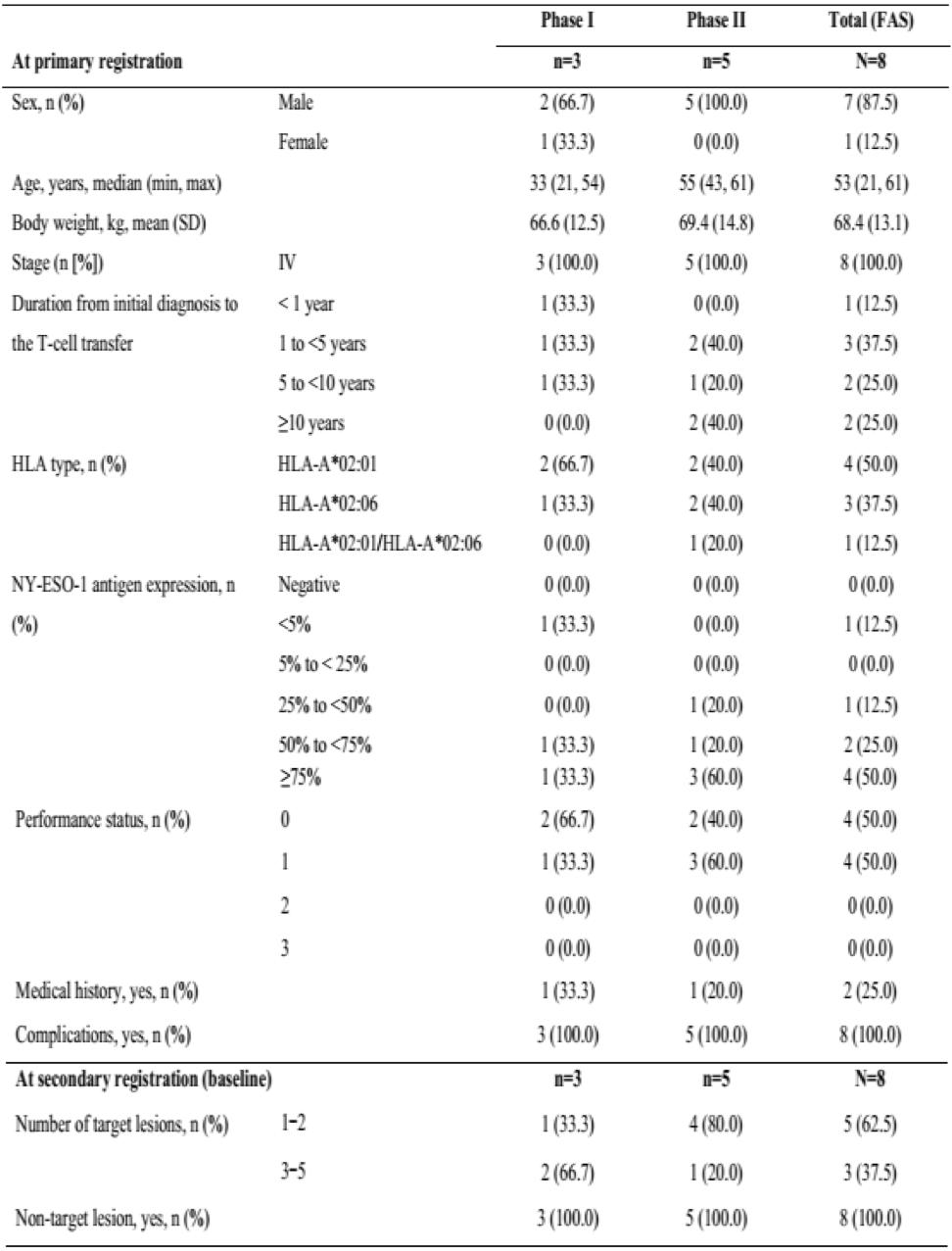
表1: 患者基线特征
在I期部分,筛选了5名同意入组的患者,其中有3名患者符合主要入选标准和次要入选标准,并在淋巴清除期间接受了环磷酰胺治疗后进行了TBI-1301的输注。这3名患者中,有1名患者在52周观察期内完成了治疗,另外2名患者在52周之前因病情恶化而终止了治疗,根据该研究的终止标准。
在II期部分,筛选了12名同意入组的患者,其中有5名患者符合主要入选标准和次要入选标准,并接受了TBI-1301的输注。在这5名患者中,有1名患者完成了研究,另外4名患者在52周之前因病情恶化而终止了治疗,根据该研究的中止标准。根据研究者的判断,II期部分中有1名患者接受了TBI-1301的一半剂量(即总共2.5 x 109个细胞),因为该患者的整体情况与CRS相关,包括高达40ºC的发热。
有效性
根据RECIST 1.1版本,通过完整分析集FAS的中心评估(n=8),ORR为50.0%(n=4/8,95% CI:15.7-84.3),最佳总体反应如下:CR,n=0;PR,n=4;SD,n=1;PD,n=3。TBI-1301治疗的ORR率超过PALETTE研究中帕唑帕尼治疗STS的贝叶斯后验概率为100.0%。根据irRECIST,ORR也为50.0%(n=4/8,95% CI:15.7-84.3),最佳总体反应如下:irCR,n=0;irPR,n=4;irSD,n=2;irPD,n=2。接受了TBI-1301一半剂量的患者(TBI1301-03-08)被评估为部分缓解。
基于RECIST 1.1和irRECIST的FAS评估的PFR为62.5%(n=5/8患者,95% CI:24.5-91.5)。FAS的PFS和OS以Kaplan-Meier曲线的形式显示在图1A和图1B中。根据RECIST 1.1和irRECIST,中位PFS为227.0天。中位OS为650.0天。TBI-1301的风险低于在PALETTE研究中 帕唑帕尼治疗STS的贝叶斯后验概率为97.7%。
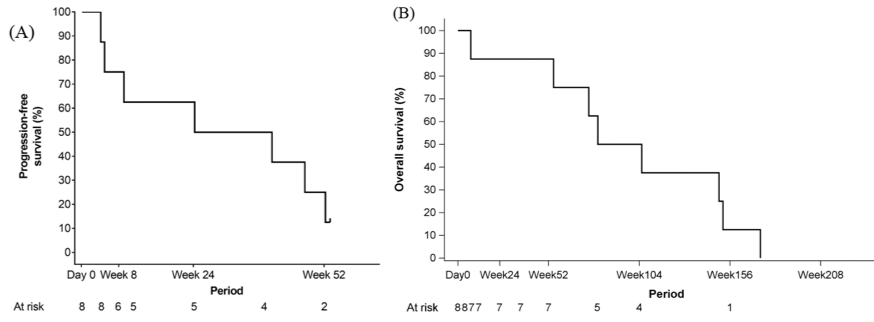
图1:Kaplan-Meier曲线显示的无进展存活率(PFS)和总体存活率(OS)
FAS中个体患者的肿瘤大小变化的蜘蛛图显示在图2A中(基于设备判断)。在8名患者中的7名患者观察到了肿瘤缩小,其中4名患者的缩小持续了超过36周。如图2B所示的游泳者图(基于中心判断)显示每个患者的反应持续时间和类型以及最终结果。一名患者(TBI1301-03-08)在完成一年的观察期时未发生PD。一名21岁男性患者(TBI1301-03-02)肺转移的代表性CT扫描图像显示在图3中,明显可见在36周观察期间的肿瘤缩小程度。
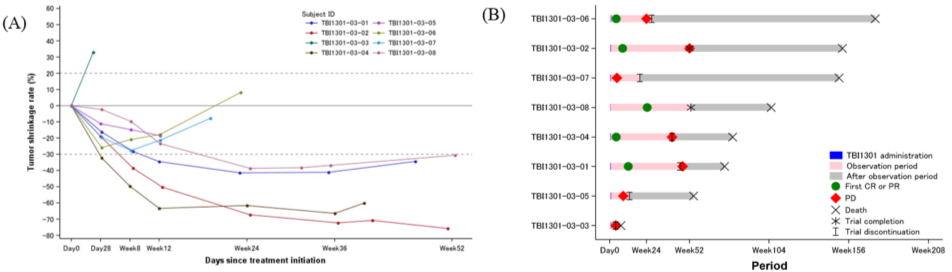
图2:蜘蛛图显示患者肿瘤缩小变化(A)和游泳者图显示在FAS中每个患者的临床反应(B)
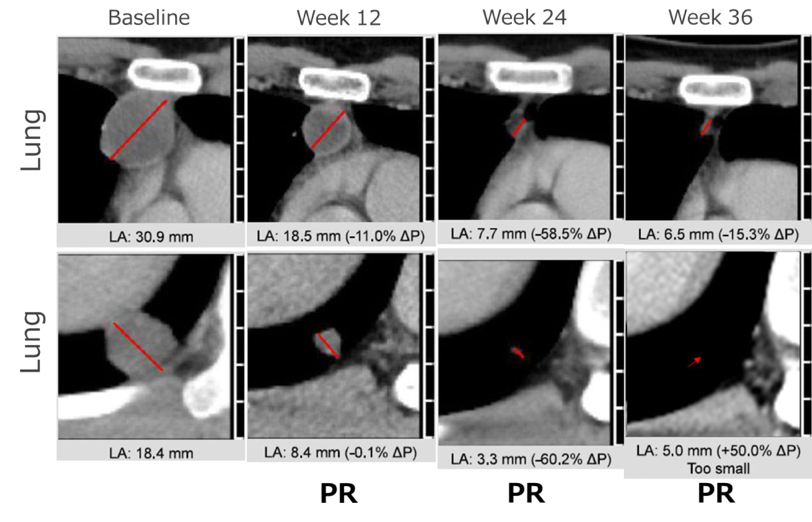
图3:单个患者((TBI1301-03-02)的代表性CT图
安全性
共有8名患者参与了TBI-1301临床试验。所有患者都出现了不良反应,其中7名患者的不良反应与TBI-1301有关(即药物不良反应),8名患者都出现了与环磷酰胺有关的不良反应。没有患者因不良反应死亡或退出研究。
最常见的严重不良事件是血小板计数、中性粒细胞计数、白细胞计数减少和胰酶增加。大多数3级或更高级别的不良反应是由预处理药物环磷酰胺引起的,只有一例与TBI-1301有关。4名患者(50%)发生了细胞因子释放综合征(CRS),其中1名患者为1级,3名患者为2级。CRS的中位发生时间为TBI-1301输注后的2(1,2)天,恢复中位时间为9(5,12)天。所有发生CRS的患者都接受了预定的治疗并康复。
实验室参数值在特定时期内下降,包括白细胞计数、红细胞计数、血红蛋白、血细胞比容和血小板计数。另一方面,血糖倾向于增加,淋巴细胞百分比和绝对计数在前三天倾向于减少。总体而言,实验室参数的变化对于整个人群来说是暂时的,并在第28天恢复到类似于第二次登记时的水平。
生命体征分析发现,TBI-1301输注后体温升高(主要是第0-3天),血压降低;此外,经皮氧饱和度下降,尤其是在出现CRS的患者中。在整个研究期间和随访期间,没有患者出现免疫效应细胞相关的神经毒性综合征(ICANS)。也没有检测到任何受试者的复发性肿瘤细胞再激活(RCR)或克隆优势。
TBI-1301在患者外周血中的动力学特性
图4显示了TBI-1301在每个病人外周血中的细胞动力学特性。在大多数患者中,TCR基因转导细胞的数量在7-10天后上升,然后下降,在第28天下降到检测限以下。总体而言,TBI-1301的药代动力学参数如下:Tmax中位数(最小值,最大值)为7.00(6.8-9.9天,Tlast中位数(最小值,最大值)为17.90(8.9-58.9)天,Cmax平均值(标准差)为6,350(4,090)拷贝/105细胞,AUCt平均值(标准差)为61,900(49,200)拷贝/105细胞x天。
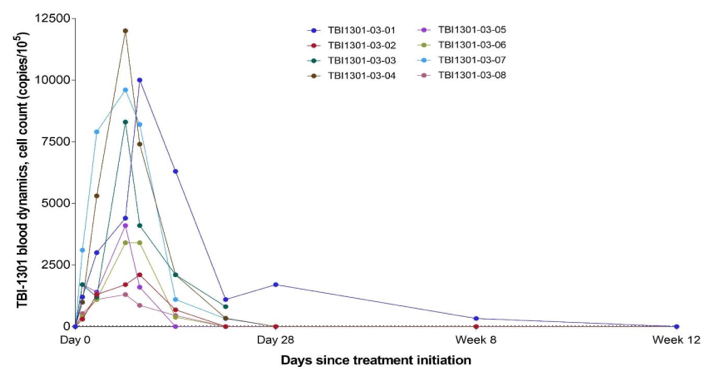
图4:TBI-1301在每个患者外周血中的密度变化
综上所述,这项开放标签、多中心阶段I/II试验显示,在接受淋巴清除和环磷酰胺治疗后,患有滑膜肉瘤的患者接受TBI-1301输注后,总体响应率为50.0%。采用贝叶斯方法评估TBI-1301的疗效,试验结果显著优于作为历史对照的帕唑帕尼(ORR为5.7%)。此外,使用TBI-1301治疗的患者的生存期也比使用帕唑帕尼的患者更长。尽管不良事件的发生率高(所有8名患者均出现),但没有死亡病例。所有8名患者都经历了与环磷酰胺有关但未被排除的不良事件,4名患者出现了CRS,但他们都康复了。总的来说,这项研究的结果与之前使用针对NY-ESO-1特异性TCR工程化的T细胞进行转移性滑膜肉瘤治疗的研究结果大致一致。
关于TBI-1301的细胞动力学,中位Tlast 为17.90天。相比之下,另一项研究报道了输注的抗NY-ESO-1 TCR-T细胞在血液中至少持续了6个月。使用单独环磷酰胺的轻度淋巴耗竭方案可能是导致较短持续时间的原因之一,因此更强力的方案,如添加氟达拉滨,有可能增加持续性并增强疗效。尽管在血液中的循环时间很短,但即使在血液中的水平低于检测限后,TBI-1301的效果似乎仍在继续。这可能是由于TBI-1301有效渗透到肿瘤微环境中以及通过抗原扩散增强的免疫效应。
总之,TBI-1301是由特异性靶向NY-ESO-1 TCR的自体淋巴细胞基因工程构建,被输注给无法手术切除且对蒽环类化疗方案耐药的晚期或复发SS患者。该治疗的疗效(ORR和OS)明显优于帕唑帕尼,并与针对NY-ESO-1抗原的其他过继免疫治疗方案的结果一致。关于安全性方面,包括CRS在内,TBI-1301被认为是可接受的,因为大多数不良事件可以通过预先准备的程序进行管理。虽然需要更大数量的患者一起进行的临床试验进一步确认,但这项研究表明,基于TBI-1301输注的过继免疫治疗有望成为治疗SS的一种有前景的新方法。
DOI: 10.1158/1078-0432.CCR-23-1456


