Science Advances:浙江大学汪浩团队发现高脂肪饮食诱导肥胖的潜在机理
时间:2023-11-05 21:04:42 热度:37.1℃ 作者:网络
暴食症状在很大程度上导致了全球肥胖症的发病率增加。现有的治疗方法有限。
2023年11月1日,浙江大学汪浩团队在Science Advances 在线发表题为“Neural adaption in midbrain GABAergic cells contributes to high-fat diet–induced obesity”的研究论文,该研究发现长期化学遗传学激活腹侧导水管灰质(vlPAG)GABA能神经元可以拯救高脂饮食诱导的肥胖(DIO)小鼠的肥胖症。这与增强的小突触后膜电流(mIPSCs)的恢复、减少的食物摄入、增加的能量消耗以及腹股沟白色脂肪组织(iWAT)棕化有关。
体内钙成像证实了vlPAG GABA能神经元对DIO小鼠的抑制作用,相应降低了内在兴奋性。单核RNA测序确定了DIO小鼠GABA能神经元亚型的转录表达变化,突出显示Cacna2d1的潜在重要性。在DIO小鼠的vlPAG GABA能神经元中过表达CACNA2D1可以恢复增强的mIPSCs和钙响应,逆转肥胖症,因此可能成为肥胖症治疗的潜在靶点。

肥胖是全球最严重的公共卫生问题之一,因为它与许多其他相关疾病,如心脏病、糖尿病和中风,存在关联。数百万人目前受肥胖影响,通常与过多的卡路里摄入有关。这一因素显然受到低成本、高可获性和不断的媒体推广高热量食物(如富含脂肪或糖的食物)的加剧。一旦发展成肥胖,治疗通常非常困难。饮食和生活方式的改变是实现减重的有效途径,但结果通常是暂时的,许多人在5年内恢复体重。这可能是由于能量平衡,包括能量摄入和消耗,由中枢神经系统(CNS)紧密控制,高脂饮食(HFD)对这一系统的改建难以逆转。
中枢神经系统,特别是下丘脑,包括弓状核(ARC)、侧下丘脑(LH)、腹内侧下丘脑和下丘脑室旁核,起着维持能量平衡的关键作用。以前在高脂饮食诱导的肥胖(DIO)小鼠中的研究发现,肥胖与下丘脑神经回路的功能和结构变化之间存在密切关系。例如,已经证明HFD会导致抑制食欲的前促黑素细胞在ARC中接收的兴奋性和抑制性突触连接数量的变化。类似地,ARC中表达促食欲蛋白的神经元的固有兴奋性不仅在DIO小鼠中表现出HFD诱导的增强,而且这种变化还是持久的,即使在恢复正常食物饮食(NFD)后也难以逆转。
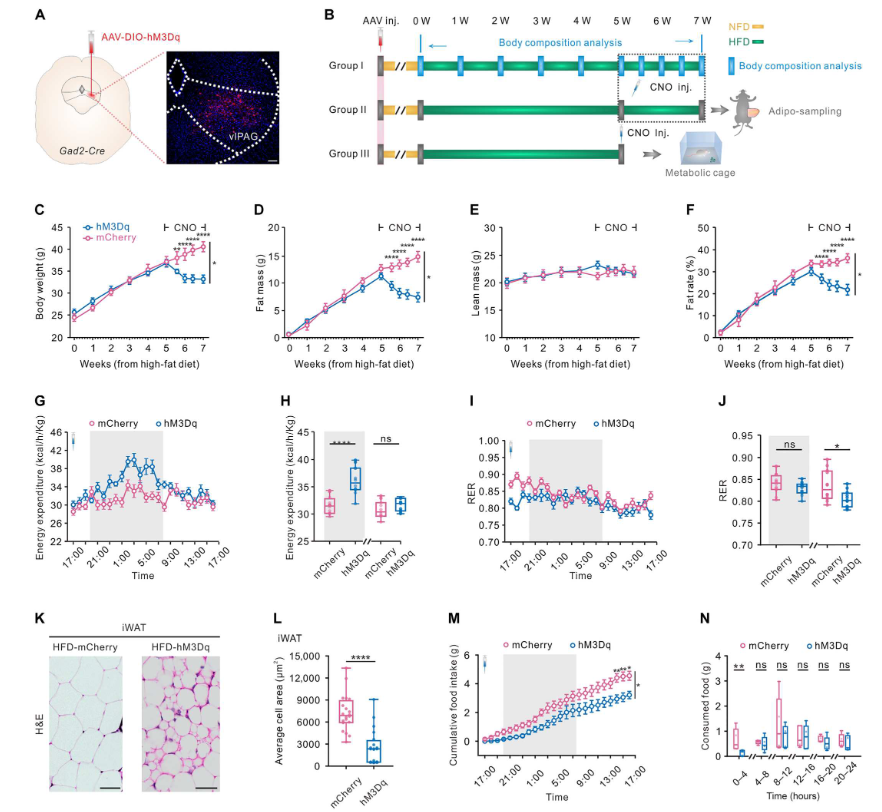
长期激活vlPAG-GABAergic细胞可逆转DIO(图片源自Science Advances )
除了ARC外,LH被认为是一个重要的调节能量平衡的区域,特别是与将其视为奖励中心的理解相关。促食欲的两种不同类型的神经元,促食素和黑色素浓缩激素神经元,在LH中都会在摄入HFD后兴奋。除了LH谷氨酸能神经元的转录谱受肥胖影响外,它们在HFD暴露后的奖励反应也明显减弱。这些先前的研究表明,HFD会影响下丘脑摄食相关神经元的突触传递或固有兴奋性。然而,这些改变对肥胖病理的贡献,以及HFD对其他与能量平衡相关的脑区域产生的任何改变,仍然大多不清楚。
最近,已经确定腹侧导水管灰质(vlPAG)中的GABA能神经元是摄食调节的另一个关键组成部分。全脑c-Fos蛋白表达调查发现,vlPAG细胞在不同能量状态下被激活。作者以前的研究报告指出,抑制vlPAG中的GABA能神经元活动足以迅速诱发饱食小鼠的进食行为。相反,激活这些细胞中断了进食,因此即使在饥饿小鼠中也减少了食物摄入。尽管这些研究暗示了vlPAG GABA能神经元在进食行为中发挥了关键作用,但这些神经元的功能和转录谱是否在DIO小鼠中发生了改变,特别是它们与能量消耗相关的作用,仍然不清楚。
该研究发现长期化学遗传学激活腹侧导水管灰质(vlPAG)GABA能神经元可以拯救高脂饮食诱导的肥胖(DIO)小鼠的肥胖症。这与增强的小突触后膜电流(mIPSCs)的恢复、减少的食物摄入、增加的能量消耗以及腹股沟白色脂肪组织(iWAT)棕化有关。体内钙成像证实了vlPAG GABA能神经元对DIO小鼠的抑制作用,相应降低了内在兴奋性。单核RNA测序确定了DIO小鼠GABA能神经元亚型的转录表达变化,突出显示Cacna2d1的潜在重要性。在DIO小鼠的vlPAG GABA能神经元中过表达CACNA2D1可以恢复增强的mIPSCs和钙响应,逆转肥胖症,因此可能成为肥胖症治疗的潜在靶点。
原文链接:
https://www.science.org/doi/10.1126/sciadv.adh2884


