从一份检出RAD51D胚系致病突变的肺癌报告,关注遗传性基因检测的重要性!
时间:2023-12-17 14:41:09 热度:37.1℃ 作者:网络
肺癌基因突变检测指导靶向治疗已经受到国内外指南共识的强烈推荐,成为肺癌治疗必不可少的步骤。而从遗传角度来说,遗传性肺癌整体发生率不高,因而较少引起大家的重视(美国国立卫生研究院统计比例为5%以内)。但对于家族性肺癌,即家族中有多个被诊断为肺癌患者的家系,则理应关注基因变异的筛查,基于分子层面的基因检测能够对肺癌发生的风险提供科学指导。
近期,就有一位肺癌患者通过我司NGS检测项目,检出RAD51D基因的胚系致病性突变,不仅为患者提供后续治疗方案参考,也能提高我们对肺癌遗传性基因检测的认识。
案例介绍
患者信息:男、45岁
临床诊断:肺腺癌
送检样本:外周血
检测项目:实体瘤全景680基因检测(血液版)
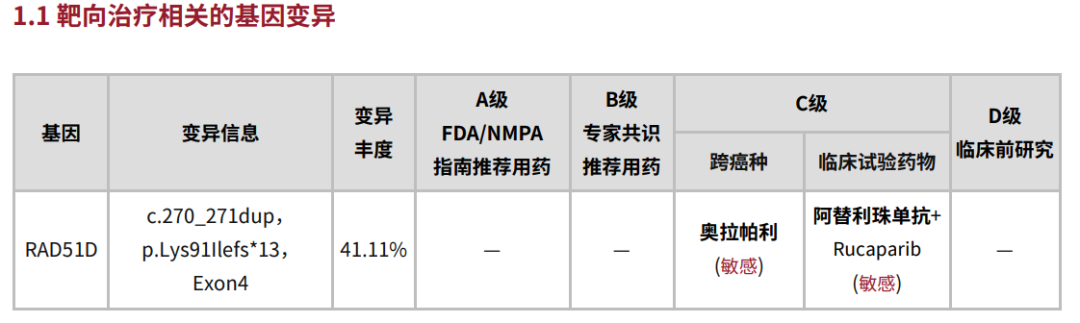
图1 患者报告结果
RAD51D突变肺癌患者是否考虑PARPi治疗?
本次肺癌患者检出的RAD51D基因,又名RAD51L3,与BRCA1/2基因一样,已经被证明属于同源重组修复基因(HRR),参与DNA修复和重组过程。RAD51D与XRCC2、XRCC3、RAD51B(RAD51L1)、RAD51C(RAD51L2)共5个同源基因一同组成RAD51基因家族[1],都能在同源重组(HR)介导的双链DNA断裂(DSBs)修复中发挥作⽤(图2),并可以通过与PARP酶的“合成致死”效应来抑制肿瘤的发生发展。因此,奥拉帕利、尼拉帕利等PARP抑制剂可能成为RAD51D基因缺陷的靶向药物。
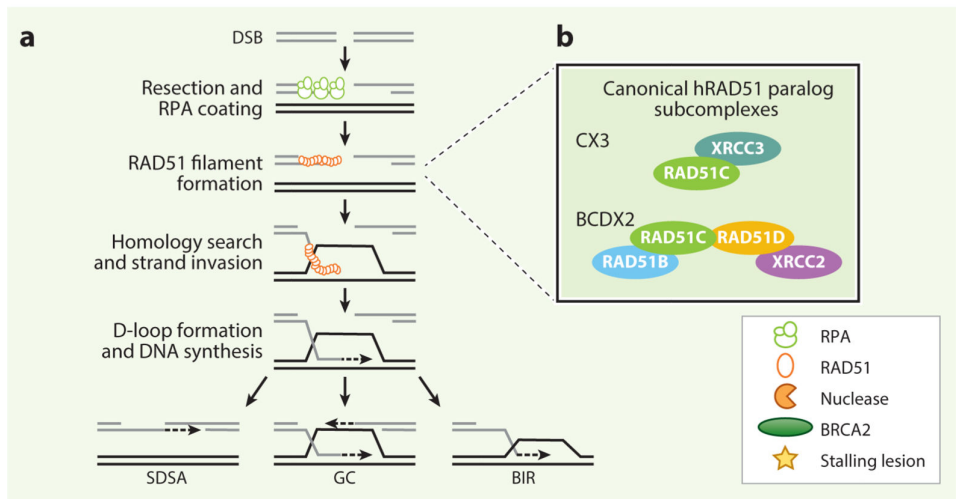
图2 同源重组(HR)介导的双链DNA断裂(DSBs)修复
目前,FDA已经批准了携带HRR基因(包含RAD51D基因)突变的去势抵抗性前列腺癌使用奥拉帕利靶向治疗。另外,起始于2019年的单臂II期研究EYLYNK-007,也证实了帕博利珠单抗联合奥拉帕利在HRR基因突变和/或HRD阳性的晚期实体瘤患者中的良好疗效和可控的不良反应[2]。II期开放标签LODESTAR临床研究证实了Rucaparib(卢卡帕利)对HRR基因突变的实体瘤患者的疗效[3]。还有多个案例表明携带RAD51D基因突变的卵巢癌患者能够从PARP抑制剂中获益显著。虽然,携带RAD51D的肺癌患者案例鲜有报道,基于当下“异病同治”的理念,为本案例肺癌患者提供治疗参考。另外,值得说明的是,有大型回顾性研究显示,像RAD51D这类HRR/DDR基因致病性变异的肺癌通常与放疗和免疫检查点抑制剂疗效较好相关,强调免疫治疗也可以作为该患者的候选方案(参考:非小细胞肺癌检测的DDR基因是个啥?竟与放疗、免疫治疗的疗效相关)。
携带RAD51D基因胚系突变需要关注其他癌种
研究表明,RAD51D基因常发生于卵巢癌,乳腺癌,前列腺癌等其他癌症,其中以卵巢癌最常见。所以,RAD51D基因胚系突变携带者也需要关注其他更常见癌种的发生风险。
北京协和医院一项研究纳入2015年至2021年的781名卵巢癌患者[4],对RAD51D基因的全长进行NGS测序。结果检出1.7%(13/781)的患者携带RAD51D基因胚系致病突变(图3),其中,以RAD51D c.270_271dup(p.Lys91fs)突变最常见,占比 53.1%(7/13)。而本案例肺癌患者检出的正是RAD51D基因这个最常见的突变!
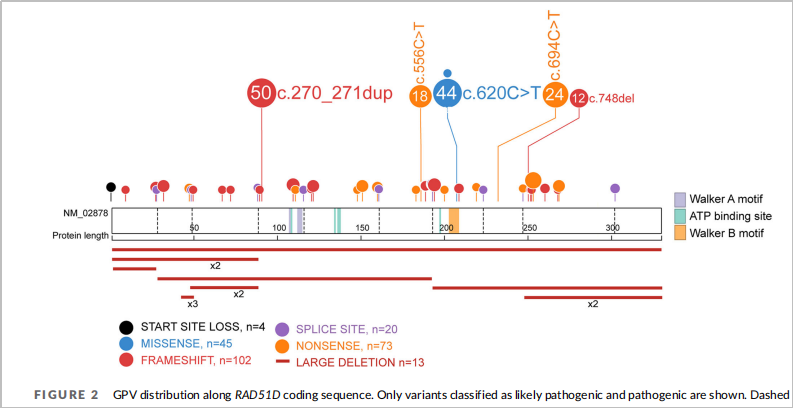
图3 RAD51D基因致病性突变分布
针对RAD51D突变的卵巢癌患者,在病理上,患者诊断时中位年龄仅58岁(45-69岁)。92.3%(12/13)患者患有高级浆液性癌。在药物指导上,整个队列中92.3%(12/13)的患者对铂敏感,无铂间隔(PFI)> 6个月。对于接受PARPis进行二线维持治疗的患者 (n=5),其中两名患者在持续33.5个月和8.1个月后停止了PARPi治疗,其他3名患者仍在接受治疗,持续缓解时间分别为2.4、13.8和30.1个月(图4)。这也能为本案例肺癌患者提供跨适应症的用药参考。

图4 RAD51D胚系突变治疗管理案例
在卵巢癌的遗传上,英国有指南提到[5]对于RAD51D女性携带者,在50岁时,罹患卵巢癌风险为0.9%,80岁时,风险为13%。而如果患者一级亲属中有卵巢癌患者的话,50岁时罹患风险提高至23%,将会显著提高卵巢癌患者的罹患风险(图5)。指南同步建议携带者在50岁时考虑进行卵巢切除手术(RRSO),在50岁以下,可以根据个体化风险评估、评估绝经症状和共同决策来考虑是否进行RRSO。
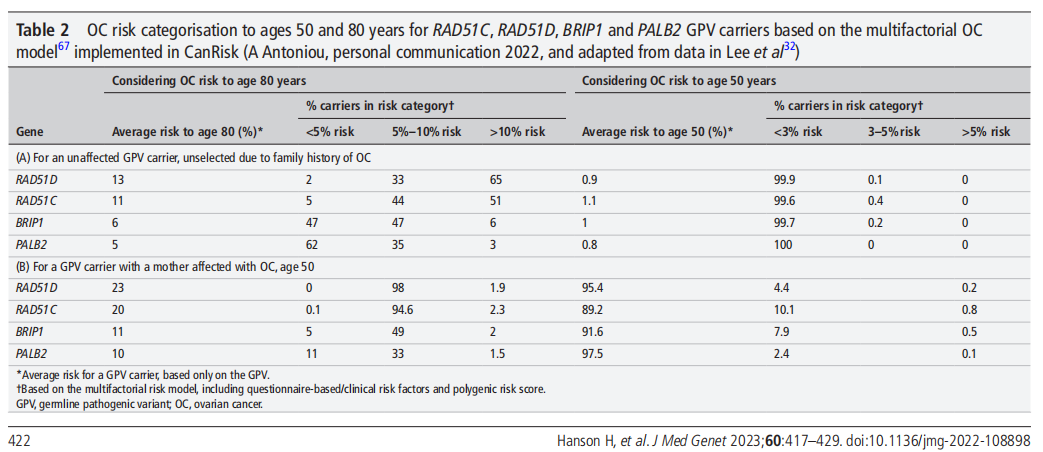
图5 RAD51C, RAD51D, BRIP1和PALB2 胚系突变携带者50岁和80岁的患癌风险
肺癌的遗传性指南怎么说?相关基因有哪些?
在《2022版原发性肺癌诊疗指南》中提到[6],目前认为涉及机体对致癌物代谢、基因组不稳定、DNA修复及细胞增殖和凋亡调控的基因多态性均可能是肺癌的遗传易感因素,其中代谢酶基因和DNA 损伤修复基因多态性是其中研究较多的两个方面。因此,如果携带这些遗传致病性基因突变的人群,很有必要关注遗传性肺癌发生的可能。
《2023版中华医学会肺癌诊疗指南》中提到:一二级亲属肺癌家族史:一级亲属被诊断为肺癌的个体患肺癌的风险明显升高。有肺癌家族史的人群可能存在可遗传的肺癌易感位点[7]。

图6 肺癌指南推荐遗传性基因检测
由此可见,肺癌的遗传性基因检测也是受到指南推荐,尤其是对于那些具有家族史或者发病年轻的家系成员!那么肺癌的遗传性评估具体需要关注哪些基因呢?我们循证介绍。
肺癌HRR基因胚系突变的整体发生率在2%—9%之间。其中,发生率最高的依次是BRCA1/2、FANCA、RAD51D、ATMD等胚系突变(图7)。既往我司也在其他肺癌患者中检出了BRCA1/2等基因变异(关注:“绘”解读“真”报告 | 肺癌检出BRCA2胚系致病突变,靶向、遗传面面俱到)。有研究在56/1109例(5.0%)肺癌标本中发现了HR通路基因变异,并强调对于所有体细胞检测发现高丰度致病性变异的患者,应考虑进行胚系检测,评估遗传风险[8]。

图7 肺癌遗传性基因突变谱
除了RAD51D、BRCA1/2这些HRR基因之外,还有更多的基因胚系突变影响着患者的遗传,如发表在Journal of Thoracic Oncology期刊上的文章提到[9],研究对31126名非小细胞肺癌患者进行NGS测序分析,发现约2.3%的肺癌患者存在胚系致病性突变(PGVs),其中,超过90%的突变发生在同源重组修复(HRR)途径中,3%的突变涉及在错配修复(MMR)途径,而5%的患者是由EGFR胚系突变导致。
在EGFR胚系突变中,包括T790M、V834L、V843I、R776H、R776G、V769M等均与遗传性肺癌相关,其中以T790M最为常见。而且不同的EGFR胚系突变对于EGFR-TKI的治疗反应具有高度的异质性。所以,EGFR胚系突变不仅能够提供肺癌的遗传性评估,还可以对患者使用不同的EGFR-TKI治疗提供指导方案!
以TP53胚系突变为标志的Li-Fraumeni综合征(李-佛美尼综合征,LFS)是一种常染色体显性遗传疾病。LFS可能导致软组织肉瘤、乳腺癌、中枢神经系统肿瘤等多种肿瘤罹患风险同步提高!其中肺癌占比为2%—7%。对于同时携带EGFR突变的肺癌患者,同步携带TP53胚系突变也是EGFR-TKI疗效不佳的因素。此外,抽烟也会进一步提高LFS患者发生肺癌的风险。
以MMR基因突变为标志的Lynch综合征(LS)多见于结直肠癌、子宫内膜癌等,肺癌中相关报道虽然罕见,但确实不可忽视遗传性。有研究就报告了一例局部晚期非小细胞肺癌患者[10],经NGS确认患者及其女儿均携带PMS2 c.1144+1G>A胚系突变,被诊断为林奇综合征家系。由于MMR基因缺陷,患者同时呈现MSI-H/TMB-H/dMMR,患者术后接受了四个周期的纳武利尤单抗联合化疗治疗,最终获得了16个月的无病生存期(DFS)。文章同步总结了多个携带MMR基因胚系突变的遗传性肺癌案例(图8),并提出免疫治疗是该类型患者的潜在治疗策略。
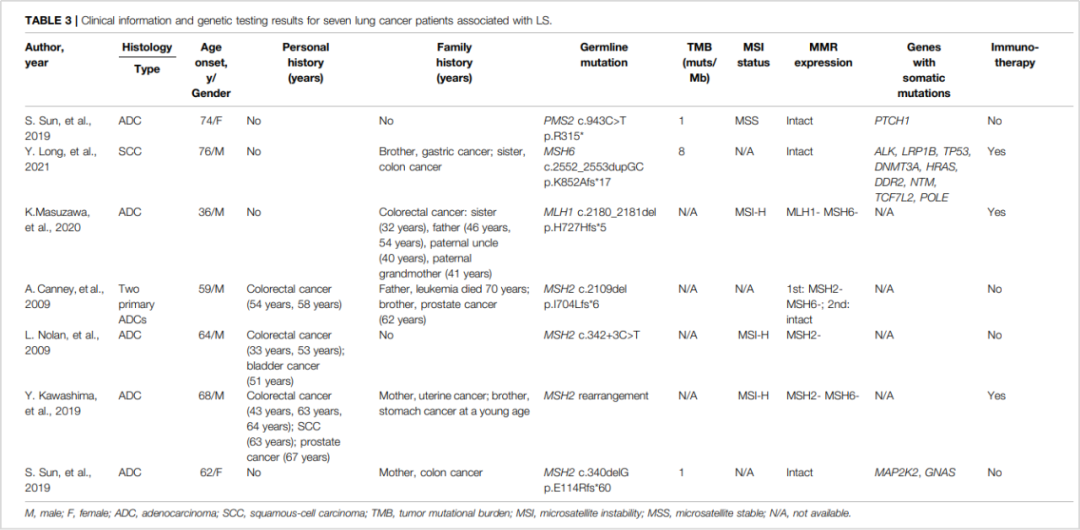
图8 肺癌MMR基因胚系突变案例
当然,关于遗传性肺癌的胚系突变还有其他更多的基因相关,随着研究的深入,也陆续挖掘出更多的风险基因并治疗指导!而一旦发现携带胚系突变的高危人群,建议是采取更密切的肿瘤筛查监测和定期体检,以做到早发现、早确诊、早治疗!
参考文献:
[1] Greenhough LA, Liang CC, Belan O, Kunzelmann S, Maslen S, Rodrigo-Brenni MC, Anand R, Skehel M, Boulton SJ, West SC. Structure and function of the RAD51B-RAD51C-RAD51D-XRCC2 tumour suppressor. Nature. 2023 Jul;619(7970):650-657. doi: 10.1038/s41586-023-06179-1. Epub 2023 Jun 21. PMID: 37344587; PMCID: PMC7614784.
[2] Maio M, Shapira-Frommer R, Yap T A, et al. Abstract CT178: Olaparib plus pembrolizumab in patients with previously treated advanced solid tumors with homologous recombination repair mutation (HRRm) and/or homologous recombination deficiency (HRD): Initial results of the phase 2 KEYLYNK-007 study[J]. Cancer Research, 2021, 81(13_Supplement): CT178-CT178.
[3] Grechko N, Skarbova V, Tomaszewska-Kiecana M, Ramlau R, Centkowski P, Drew Y, Dziadziuszko R, Zemanova M, Beltman J, Nash E, Habeck J, Liao M, Xiao J. Pharmacokinetics and safety of rucaparib in patients with advanced solid tumors and hepatic impairment. Cancer Chemother Pharmacol. 2021 Aug;88(2):259-270. doi: 10.1007/s00280-021-04278-2. Epub 2021 Apr 28. PMID: 33909097; PMCID: PMC8236452.
[4] Yao H, Li N, Yuan H. Clinical characteristics and survival analysis of Chinese ovarian cancer patients with RAD51D germline mutations. BMC Cancer. 2022 Dec 21;22(1):1337. doi: 10.1186/s12885-022-10456-z. PMID: 36544182; PMCID: PMC9768941.
[5] Hanson H, Kulkarni A, Loong L, Kavanaugh G, Torr B, Allen S, Ahmed M, Antoniou AC, Cleaver R, Dabir T, Evans DG, Golightly E, Jewell R, Kohut K, Manchanda R, Murray A, Murray J, Ong KR, Rosenthal AN, Woodward ER, Eccles DM, Turnbull C, Tischkowitz M; Consensus meeting attendees; Lalloo F. UK consensus recommendations for clinical management of cancer risk for women with germline pathogenic variants in cancer predisposition genes: RAD51C, RAD51D, BRIP1 and PALB2. J Med Genet. 2023 May;60(5):417-429. doi: 10.1136/jmg-2022-108898. Epub 2022 Nov 21. PMID: 36411032; PMCID: PMC10176381.
[6] 中华人民共和国国家卫生健康委员会,赫捷,吴一龙,等.原发性肺癌诊疗指南(2022年版)[J].中国合理用药探索, 2022, 19(9):28.DOI:10.3969/j.issn.2096-3327.2022.09.001.
[7] 中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会肺癌临床诊疗指南(2023版) [J] . 中华医学杂志, 2023, 103(27) : 2037-2074. DOI: 10.3760/cma.j.cn112137-20230510-00767.
[8] Yoon JY, Roth JJ, Rushton CA, Morrissette JJD, Nathanson KL, Cohen RB, Rosenbaum JN. Homologous recombination pathway gene variants identified by tumor-only sequencing assays in lung carcinoma patients. Transl Lung Cancer Res. 2023 Jun 30;12(6):1236-1244. doi: 10.21037/tlcr-22-749. Epub 2023 Jun 8. PMID: 37425424; PMCID: PMC10326790.
[9] Farinea G, Crespi V, Listì A, et al. The Role of Germline Mutations in Thoracic Malignancies: Between Myth and Reality. J Thorac Oncol. 2023;18(9):1146-1164.
[10] Han Q, Liu S, Cui Z, Wang Q, Ma T, Jiang L, Li X, Dai G. Case Report and Literature Review: Diagnosis, Tailored Genetic Counseling and Cancer Prevention for a Locally Advanced dMMR/MSI-H/TMB-H Lung Cancer Patient With Concurrent Lynch Syndrome Mediated by a Rare PMS2 Splicing Variant (c.1144+1G>A). Front Genet. 2022 Jan 18;12:799807. doi: 10.3389/fgene.2021.799807. PMID: 35116055; PMCID: PMC8804326.


