IVD技术:新型一步、等温、无需DNA提取及扩增的基因检测方法
时间:2024-01-12 21:19:47 热度:37.1℃ 作者:网络
具有序列特异性催化特性的内切酶已成为核酸靶标鉴定的重要工具,特别是CRISPR/ Cas系统。但CRISPR/Cas系统的诊断应用仍面临着一些挑战,包括与使用引导RNA相关的成本增加和不稳定性。为了解决这些限制,研究人员正在积极研究开发其他的策略。
Argonaute (Ago)蛋白在RNA干扰(RNAi)和小RNA引导的基因调控途径中发挥关键作用。它们能够切割目标核酸而不需要特定的序列基序,Ago可以精确切割引导DNA 位置10和11核苷酸之间的互补靶标,从而对核酸选择较少限制性。在目前的研究中,Ago蛋白主要用于核酸扩增反应后的直接切割,如PCR、环介导等温扩增(LAMP)等,产生增强的荧光信号。但这些方法需要更多的酶和程序步骤,导致相对复杂的过程。与此同时,也有研究团队设计了使用Ago蛋白而不进行核酸扩增的方法,但性能相对较差。
近日,一组研究团队在杂志Nature Communications上发表了一篇题为“ANCA: artificial nucleic acid circuit with argonaute protein for one-step isothermal detection of antibiotic-resistant bacteria”的文章。这篇文章中,作者提出了一种DNA检测技术,该技术将人工核酸回路与Ago蛋白切割活性相结合(ANCA),建立了一个高特异性和指数级信号放大的正反馈回路。该反应为一步反应,并且可以很容易地通过改变核酸识别位点来检测不同的目标。作者采用ANCA方法结合三维纳米柱拭子,直接识别从猪皮、桌子、手套、剪刀、把手和镊子等表面擦拭的产碳青霉烯酶的细菌的能力。ANCA检测应用于直肠拭子标本诊断产碳青霉烯酶肺炎克雷伯菌(CPKP)感染患者,临床敏感性和特异性分别为100%和100%。

图片来源:Nature Communications
主要内容
ANCA方法的设计
ANCA试验利用了Ago蛋白的两种特性。首先,Ago蛋白的切割位点位于引导DNA (guide DNA)5 '端的第10和第11个位置。其次,Ago蛋白切割出的DNA链可以用作引导DNA。作者利用这两种特性建立了一个循环,开发了ANCA方法(如下图)。作者设计了引导DNA 1 (G1)、引导DNA 2 (G2)、报告基因(R)和报告基因互补序列(R*)。设计所有序列确保在反应过程中产生的Trigger 1 (T1)和Trigger 2 (T2)也可以作为引导DNA。
Ago/G1和Ago/G2复合物与互补的靶DNA序列杂交,切割相应靶标,从靶DNA产生短DNA片段(T1)。T1可作为另一种引导DNA, Ago/T1复合体形成并识别和切割R,导致两条短DNA链(Output和T2)的释放。output产生荧光信号,T2与Ago再次识别并切割R*,产生T1并完成DNA循环。通过这个正反馈循环,在目标DNA存在的情况下重复切割反应,最后通过监测荧光信号来确定样品中目标DNA的存在。
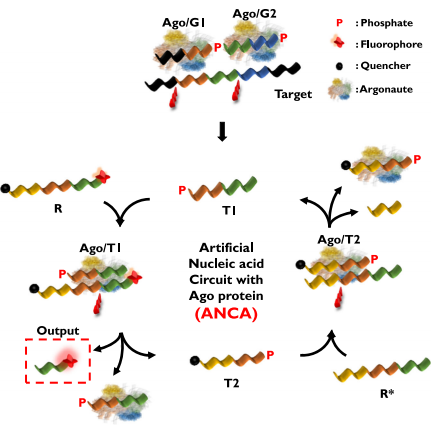
ANCA法检测靶核酸的示意图。图片来源:Nature Communications
ANCA方法的评价
ANCA方法被设计为通过正反馈回路提供指数放大(图a)。作者首先以肺炎克雷伯菌碳青霉烯酶(KPC)为靶标,对ANCA方法的不同组分进行了评估。所有反应组分(靶标DNA、G1、G2、Ago蛋白)存在的情况下,在ANCA反应过程中观察到强烈的荧光信号以及观察到被降解的R-R*结构的条带(图c)。而在缺乏某个反应组分的情况下,荧光信号可忽略,且具有完整的R-R*条带。
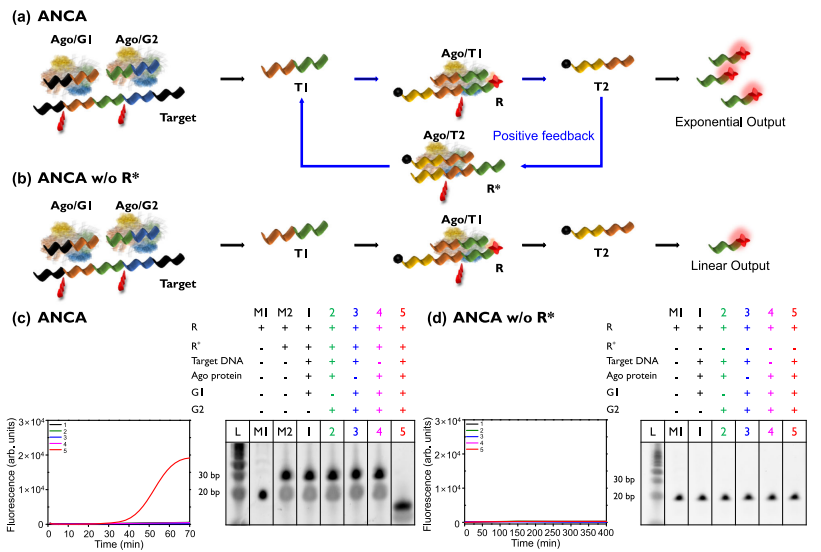
ANCA方法的评价。图片来源:Nature Communications
ANCA方法的优化及灵敏度
作者优化了ANCA法的反应温度和R、R*、Ago蛋白和Mg2+的浓度。最佳检测条件为反应温度为75℃,R和R*浓度为500 nM, Ago蛋白浓度为200 nM, MgCl2浓度为10 mM。此外,酶储存缓冲液中NaCl和牛血清白蛋白(BSA)的浓度分别优化为75 mM和10µg/mL,这些条件用于后续实验。
在优化条件下,分别以肺炎克雷伯菌碳青霉烯酶(KPC)和亚胺培南酶(IMP)为目标序列评价了ANCA方法的灵敏度。下图a显示了不同浓度KPC序列的随时间变化的荧光强度。阈值时间确定为荧光强度达到10000的反应时间。在10 fM ~ 10 nM范围内呈线性关系,检出限(LOD)为1.87 fM。采用ANCA方法检测IMP。在1 fM至1 nM范围内观察到线性关系,LOD计算为178 aM(图c, d)。同样,作者设计了用于检测其它碳青霉烯酶比如VIM, NDM和OXA-48的核酸回路并评估了灵敏度。结果显示,ANCA方法具有灵活性和广泛的靶标适用性,通过对ANCA方法进行轻微修改,成功检测了KPC, IMP, VIM, NDM和OXA-48序列。
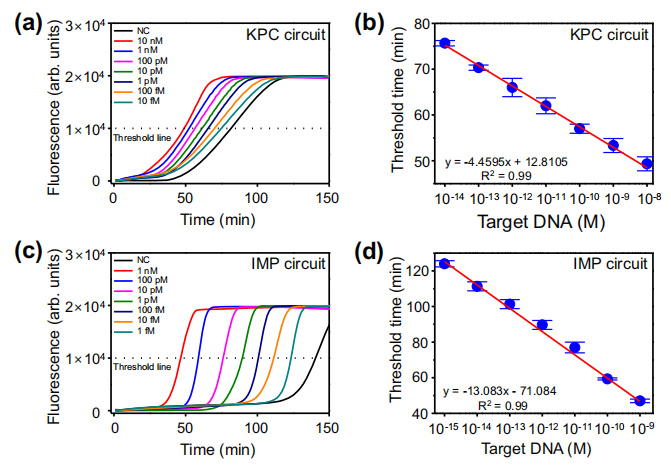
ANCA方法的灵敏度。图片来源:Nature Communications
用ANCA法直接检测耐药菌
作者尝试用未经DNA纯化的ANCA法检测产碳青霉烯酶肺炎克雷伯菌(CPKP)。将耐药菌直接加入含有ANCA反应混合物的试管中,在75℃下孵育。结果证实了使用针对KPC和IMP的ANCA反应直接检测到目标抗生素耐药菌(图b和c)。作者还尝试使用VIM、NDM和OXA-48回路检测CPKP,发现每个回路都能很好地区分WT和CPKP。ANCA方法允许以一种简化的方式检测CPKP,而不需要预浓缩,裂解和DNA纯化步骤,可归因于在60℃以上的温度下,细菌可以在15分钟内被裂解。
为了探讨ANCA法在临床标本细菌检测中的应用,作者将细菌加入尿液和血液样本,并直接加入含有ANCA反应混合物的管中并孵育。KPC回路能够在99%的人类尿液中检测到 KPC(图e)。IMP电路也成功地检测到了尿中的肺炎克雷普菌(IMP)(图f)。此外,ANCA方法可分别在90%和99%的血液样本中鉴定出KPC和IMP(图h, i)。
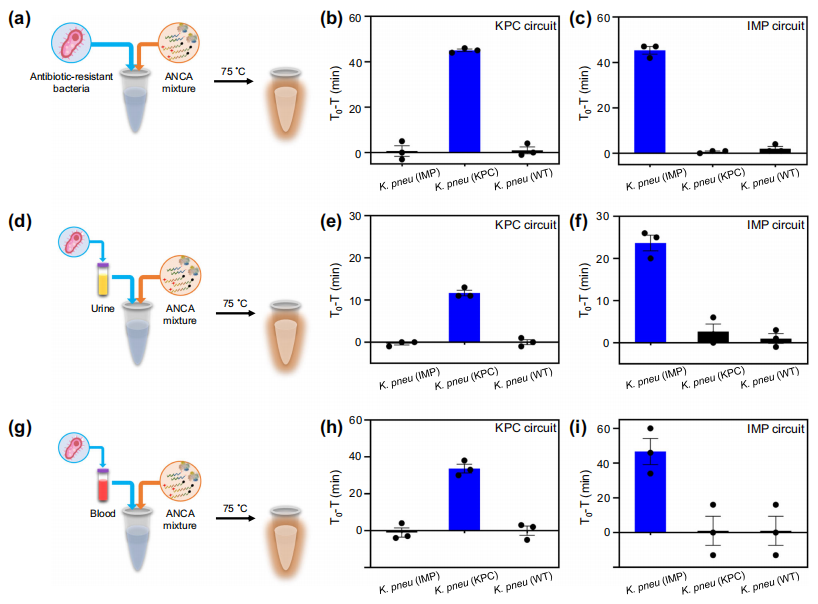
用ANCA法直接检测耐药菌。图片来源:Nature Communications
应用ANCA方法诊断耐药菌
作者尝试用ANCA方法从临床样本中诊断CPKP。使用棉签收集患者直肠拭子143份(KPC阳性63份,阴性80份),每个拭子放置在运输介质中。将运输介质与ANCA试剂直接混合,在荧光监测下孵育。结果显示ANCA方法能够区分63个KPC阳性样本和79个阴性样本(图b),只有样品2检测到假阳性信号,且ANCA法和PCR法之间存在很强的相关性(图c)。共200份临床和加菌样品的KPC诊断结果显示,临床敏感性和特异性分别为100%和98.7%。ROC分析得出曲线下面积(AUC)值为0.9997(图d)。共160例临床和模拟临床标本(80例IMP性,80例IMP阴性)的IMP诊断结果显示,IMP回路的临床敏感性和特异性分别为100%和100%,AUC为1.0(图e)。
作者尝试使用ANCA方法从患者棉签中直接检测肺炎克雷伯菌(KPC)。结果显示,直肠拭子的诊断结果(灵敏度= 100%,特异性= 100%)比直肠拭子浸没的运输介质的诊断结果(灵敏度= 98.7%,特异性= 100%)具有更高的准确性。
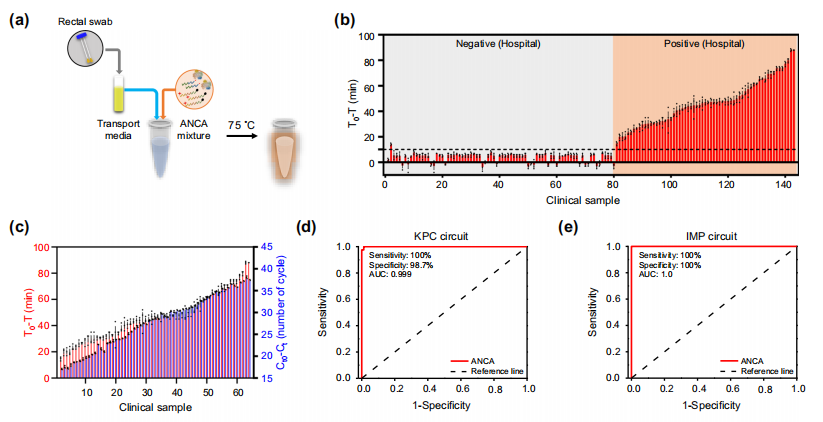
应用ANCA方法诊断耐药菌。图片来源:Nature Communications
三维纳米柱拭子ANCA法捕获和检测耐药菌
作者进一步使用ANCA方法从污染表面捕获和检测抗生素耐药细菌(图a)。作者采用了3D纳米柱阵列拭子,尝试从猪皮肤、桌子、手套、剪刀、旋钮和镊子等表面来捕获细菌。将捕获细菌的拭子直接放入管中,进行ANCA反应。复杂的三维纳米柱阵列结构通过纳米拓扑相互作用促进细菌粘附,允许不可逆的细菌捕获,从而防止继发性感染。对每个目标使用ANCA方法检测KPC和IMP的结果显示,荧光信号具有特异性(下图c和d)。
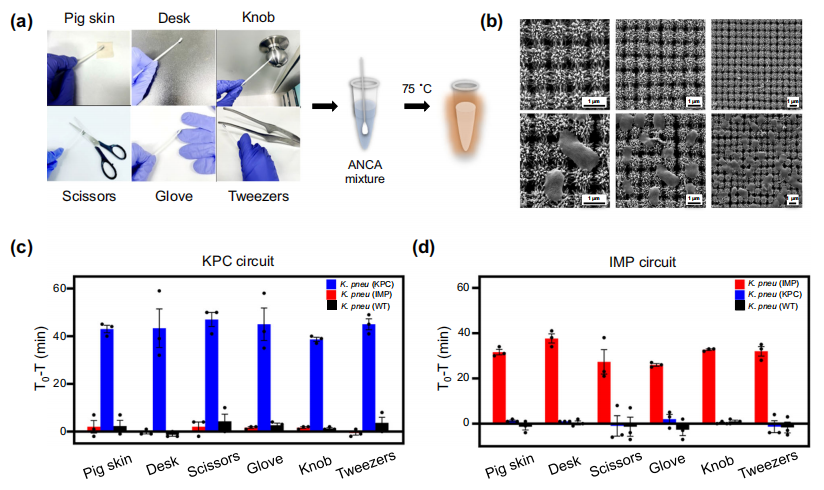
使用ANCA捕获和检测抗生素耐药菌三维纳米柱拭子法。图片来源:Nature Communications
总结与讨论
作者报告了一种分子诊断策略(ANCA),通过Ago蛋白的交叉催化裂解进行连续的自催化反应,实现一步、无扩增和等温DNA检测,无需DNA提取和扩增步骤,即可成功检测出产碳青霉烯酶肺炎克雷伯菌(CPKP)。此外,作者还展示了使用该方法检测人类尿液和血液样本中的碳青霉烯类耐药细菌以及结合三维纳米柱拭子从表面直接识别CPKP。应用ANCA方法检测感染患者直肠拭子标本中的CPKP,灵敏度和特异性分别达到100%和100%。该方法可简便、快速、准确地诊断CPKP,有助于预防院内感染。
ANCA方法能够从患者收集的直肠拭子中直接检测CPKP,且从直肠拭子获得的诊断结果证明比从拭子浸没的运输介质获得的诊断结果更准确。通过使用3D纳米柱阵列拭子获取临床样本并直接进行ANCA,可以预测CPKP的准确诊断,而不会有继发感染的风险,因为这种方法可以规避样本污染的可能性并限制细菌的传播。下一步,将仔细评估ANCA方法与3D纳米柱阵列拭子结合的效果。这将涉及与医生密切合作,以提高实施这种方法在现实世界的临床设置。
未来的研究途径可能是探索提高Ago蛋白/引导DNA的切割效率。与其他技术相比,相对较长的反应时间是ANCA的缺点。在缺乏引导DNA的情况下,Ago蛋白经常会形成Apo,引起dsDNA的非特异性裂解反应。为了抑制这种情况,Ago蛋白的浓度不能太高。然而,Ago蛋白浓度越高,反应动力学越有利。因此作者选择了200 nM Ago蛋白适度解决这两个问题的浓度条件,希望这个问题将在不久的将来得到解决。这一期望是基于蛋白质工程的最新进展,出现无Apo形式的Ago蛋白。另一个缺点是,目前的NEB DNA设计指南中提供的数据高度可变,导致每个回路的灵敏度值的差异。随着收集的数据越来越多,有可能以一致的效率检测不同的靶核酸。


