Scientific reports:基于病原体核酸检测的ELISA方法
时间:2024-01-26 19:14:59 热度:37.1℃ 作者:网络
准确识别导致感染的病原体对于有效治疗和控制感染至关重要。目前,大多数病原鉴定的分子诊断依赖于抗原检测试验或核酸检测(NATs)。尽管NATs具有很高的敏感性和特异性,但它们受到来自病原体的靶序列扩增要求和专业实验室基础设施的限制,这限制了它们在常规临床或现场环境中的使用。
低成本和快速的病原体检测,如酶联免疫吸附测定法(ELISA)或侧流免疫层析测定(LFAs),已经开发出来检测病原体特异性抗原。然而,抗原检测作为公共卫生工具并不理想,因为它们可能无法及早发现感染。相比之下,NATs可以检测到感染早期阶段生物体特异性的DNA或RNA序列。因此,需要低成本、快速的病原体检测,同时保留NATs的敏感性优势。
近日,在杂志Scientific reports上发表了一篇题为“S9.6-based hybrid capture immunoassay for pathogen detection”的文章。在这项研究中,作者利用S9.6作为检测平台,开发了一种基于病原体特异性核酸的ELISA和LFA形式的检测方法。这种被称为DNA-RNA杂交捕获免疫分析(HC)的检测方法可以检测病原体特异性RNA,并且可以调整以检测任何病原体。HC检测不需要分子操作,如逆转录或病原体RNA或DNA的预扩增,也不需要先进的仪器或专门的培训来执行。本文证明了HC法可特异性检测炭疽芽孢杆菌的pagA、rpoB和gyrA基因,SARS-CoV-2的Spike E基因和刚地弓形虫的B1基因的RNA。该检测方法可用于低资源环境下的病原体检测,也可用于定性基因表达分析。

图片来源:Scientific reports
主要内容
S9.6特异性结合DNA-RNA杂合体
作者研究了S9.6在总细胞RNA提取物中结合的核酸种类。结果显示,用RNase H处理导致了大约75%的信号损失(图A,B),证实了S9.6与总核酸中预先存在的DNA-RNA杂合体结合。用dsRNA特异性核酸酶RNase III处理同样会导致大约75%的信号减少,这表明尽管S9.6对dsRNA的亲和力较低,但大部分信号来自dsRNA。类似的实验还证明了S9.6不结合ssDNA或ssRNA。综上所述,作者证明了S9.6可以检测细胞RNA中已有的杂合体,并且可能非特异性地结合高度丰富的dsRNA。体外合成的炭疽杆菌基因pagA杂合体的点印迹检测限(LOD)在亚纳摩尔范围内(0.82 nM或1.25 ng/µL),对应5 × 108个pagA DNA-RNA杂合体分子。
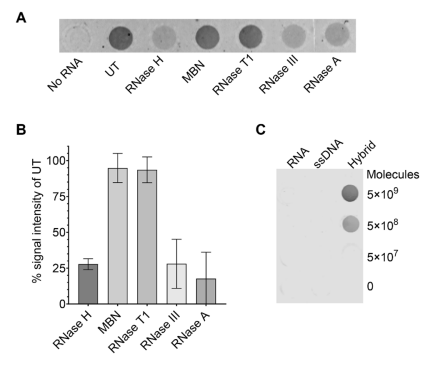
S9.6对DNA-RNA杂合体的特异性结合。图片来源:Scientific reports
HC-ELISA试剂盒的研制
作者尝试开发一种通过选择性地富集细胞RNA转录本来排除dsRNA和已经存在的DNA-RNA杂合体的检测方法。通过HC-ELISA,在链霉亲和素表面捕获生物素化的互补ssDNA探针-RNA杂合体。然后使用S9.6检测捕获的杂合体,化学发光作为信号输出(图A)。作者最终通过实验确定了多生物素化探针(P1和P10探针)为pagA RNA检测的最佳探针类型(图B)。

HC-ELISA的原理概述以及探针优化。图片来源:Scientific reports
HC-ELISA的敏感性和特异性
作者使用HC-ELISA对炭疽芽胞杆菌细胞RNA进行敏感性试验。将PM、P1和P10探针(相当于约3.5 kb的全长基因)与细胞RNA中的rpoB转录本杂交,并通过HC-ELISA检测(图C)。P1和P10探针分别在5µg和500 ng炭疽杆菌细胞RNA中检测到rpoB mRNA的存在。
为了检验HC-ELISA的定量能力,作者使用相同细菌RNA对比了RT-qPCR和HC-ELISA。结果显示,HC-ELISA能显著鉴定CO2条件下pagA mRNA表达提高了6倍,而rpoB表达无变化(图E), RT-qPCR显示CO2条件下pagA转录提高了40倍,rpoB转录无变化(图F)。
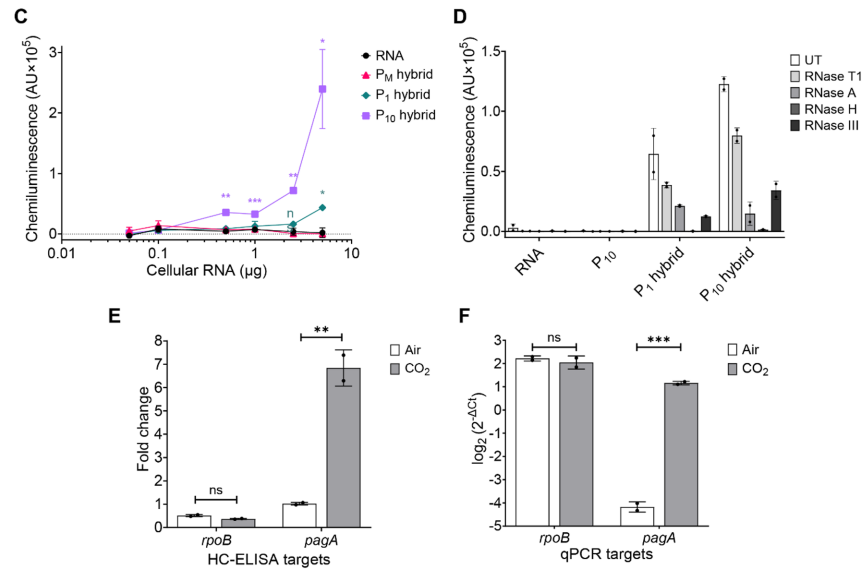
HC-ELISA的敏感性和特异性。图片来源:Scientific reports
HC-ELISA可检测小鼠模拟炭疽芽胞杆菌感染
作者将炭疽芽胞杆菌添加到小鼠脾悬液中,细菌剂量从107到109 CFU/100 mg不等。然后用HC-ELISA和P10杂交探针分析脾脏细胞RNA中炭疽杆菌rpoB和pagA mRNA的存在(图A,B)。结果显示,rpoB和pagA两种基因的化学发光倍数变化在109 CFU组中最高,在107 CFU组中最低。对于最高细菌负荷(109 CFU/100 mg),模拟感染中rpoB和pagA RNA的检测与细菌单独检测相当,但效率随着细菌负荷的降低而下降。
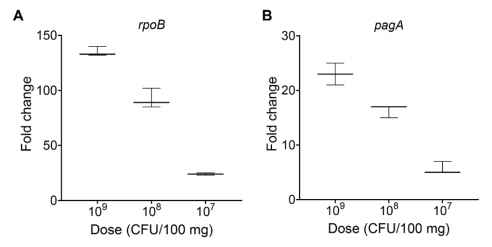
HC-ELISA可检测小鼠模拟炭疽芽胞杆菌感染。图片来源:Scientific reports
HC-ELISA可与侧流试验(HC-LFA)平行
接下来,作者开发了一种基于HC-ELISA方法的杂交捕获测流试验(HC-LFA),通过DNA-RNA杂交检测病原体特异性RNA。测试了PM, P1和P10探针与炭疽芽孢杆菌总核酸中的rpoB mRNA杂交,以确定用于HC-LFA的最佳探针。P1探针提供了真阳性和假阳性测试线强度的最佳平衡,并被选择用于所有后续的HC-LFA实验(图B)。
为了验证HC-LFA检测炭疽芽孢杆菌感染的能力,从添加了炭疽芽孢杆菌的脾脏悬液中提取细胞RNA并进行测定。从107 CFU/100 mg组织开始,该试验对加标脾脏和细菌的杂合体均呈阳性(图C)。

HC-LFA可检测小鼠模拟炭疽杆菌感染。图片来源:Scientific reports
HC检测可以检测到来自寄生虫和病毒病原体的RNA
作者将该方法的适用性扩展到不同的病原体,如刚地弓形虫和SARS-CoV-2。为了评估HC-ELISA检测弓形虫存在的能力,将P10探针(~ 2.2 kb)与从感染的人包皮成纤维细胞(HFF)中提取的细胞RNA进行杂交。图A结果显示,当约40%的细胞被裂解时,HC-ELISA可以特异性地从弓形虫感染的HFF细胞中鉴定出B1基因RNA。在较高的寄生虫负荷下,信号增加,表明细胞裂解百分比增加。
接下来,作者评估了HC-ELISA和HC-LFA检测SARS-CoV-2 Spike E(也称为S)基因RNA的能力。HC-ELISA可以清晰地检测到2 × 109分子的P10杂合体(图B)。对于HC-LFA,该试验能够检测到多达108个Spike E RNA分子(图C)。
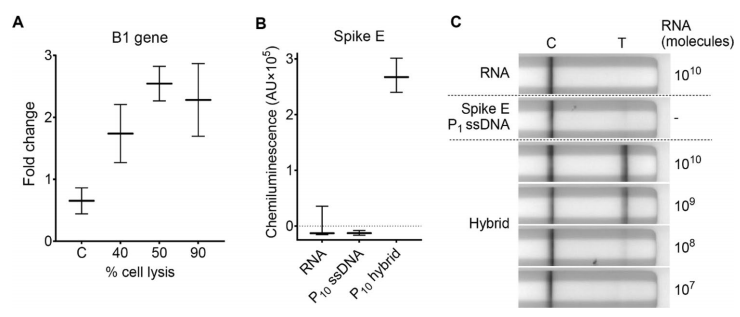
HC检测可以检测弓形虫和SARS-CoV-2 RNA。图片来源:Scientific reports
总结与讨论
本研究开发的杂交捕获免疫分析法(HC)利用S9.6的DNA-RNA结合特性特异性捕获和检测病原体特异性RNA转录物,而无需序列扩增。该方法成功地鉴定了已知病原体(如炭疽芽胞杆菌、弓形虫和SARS-CoV-2)的mRNA,证明了其泛病原体适应性。
S9.6不加区分地识别所有DNA-RNA杂交体的能力提供了泛病原体适应性,这是HC检测的显著优势。然而,作者观察到病原体或HC形式之间的检出限(LOD)存在很大差异。HC-ELISA和HC-LFA之间的LOD差异可归因于HC-ELISA在时间、灵敏度和半定量检测之间的权衡,而HC-LFA着重于速度、简单性和定性检测。该分析的主要局限性:它不太可能用于检测未特征的病原体。一个合适的靶标应该是病原体特异性的,靶转录物丰度和长度也是一个重要的考虑因素。
针对病原体特异性的多个基因的多重探针具有增强检测灵敏度的潜力。使用全长探针检测多个病原体特异性靶转录本可以从更大比例的细胞RNA中产生信号,而使用多个小检测探针结合捕获探针可以克服长RNA转录本中二级结构导致的杂交效率降低。HC-ELISA法操作简单,可用于哨点实验室等实验室进行病原体检测,检测活动性感染的成本较低。


