皮肤常驻记忆T细胞参与白癜风复发的研究现状
时间:2024-05-25 23:01:53 热度:37.1℃ 作者:网络
白癜风是一种以表皮色素脱失为表型的常见顽固性皮肤病,其治疗起效慢,易复发,停止治疗一年内复发率高达40%,给患者带来了沉重的时间和经济负担。白癜风复发常出现在原色素脱失部位,提示皮肤病变部位具有自身免疫记忆。记忆T细胞能够长期存在于机体中,介导对抗原再次刺激的免疫应答。
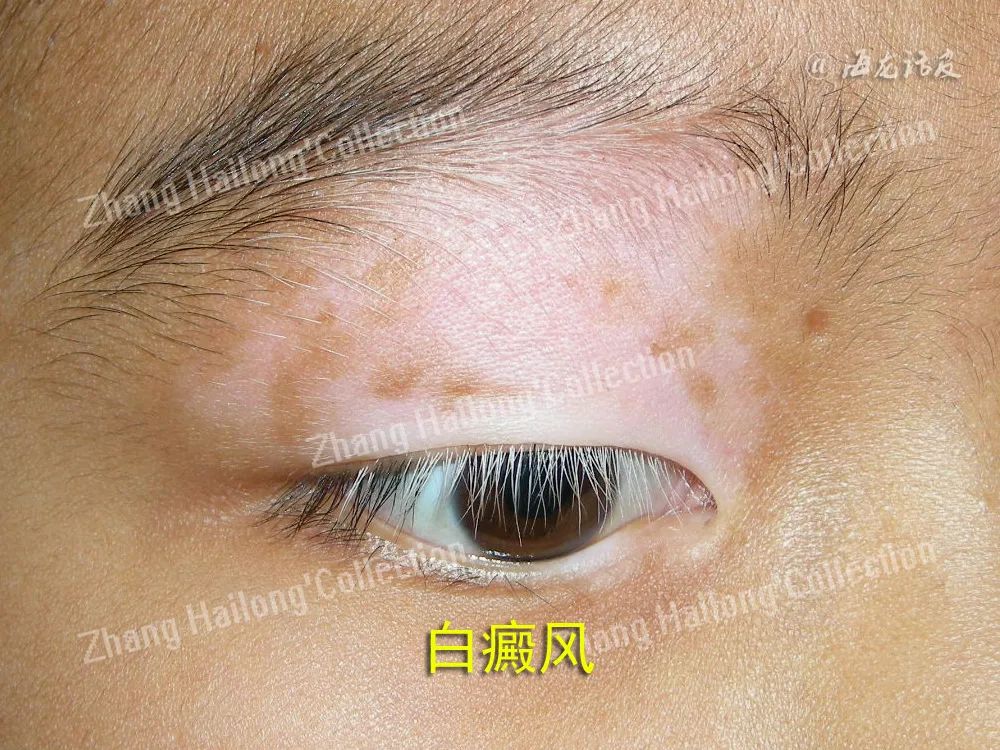
根据表型及功能的不同,记忆T细胞主要分为干细胞样记忆T细胞(stem like memory T cell,TSCM)、中央记忆T细胞 (central memory T cell,TCM)、效应记忆T细胞(effector memory T cell,TEM)和组织常驻记忆T细胞(tissue resident memory T cell,TRM),其中TRM是一种长寿命的非迁移性组织驻留细胞,在大多数非淋巴组织中持续存在,介导机体强大的免疫防御功能,但其异常激活可能导致发病。目前的研究认为,CD8+TRM是介导白癜风复发的关键亚群。
皮肤TRM的产生
健康人的皮肤中具有大约200亿个T细胞,其中 80%为CD45RO+记忆T细胞,50%~70%表达TRM细胞标志分子。与健康皮肤相似,白癜风皮损处记忆T细胞由TCM、TEM和TRM组成。目前对于记忆T细胞的产生仍存在一定的争议。
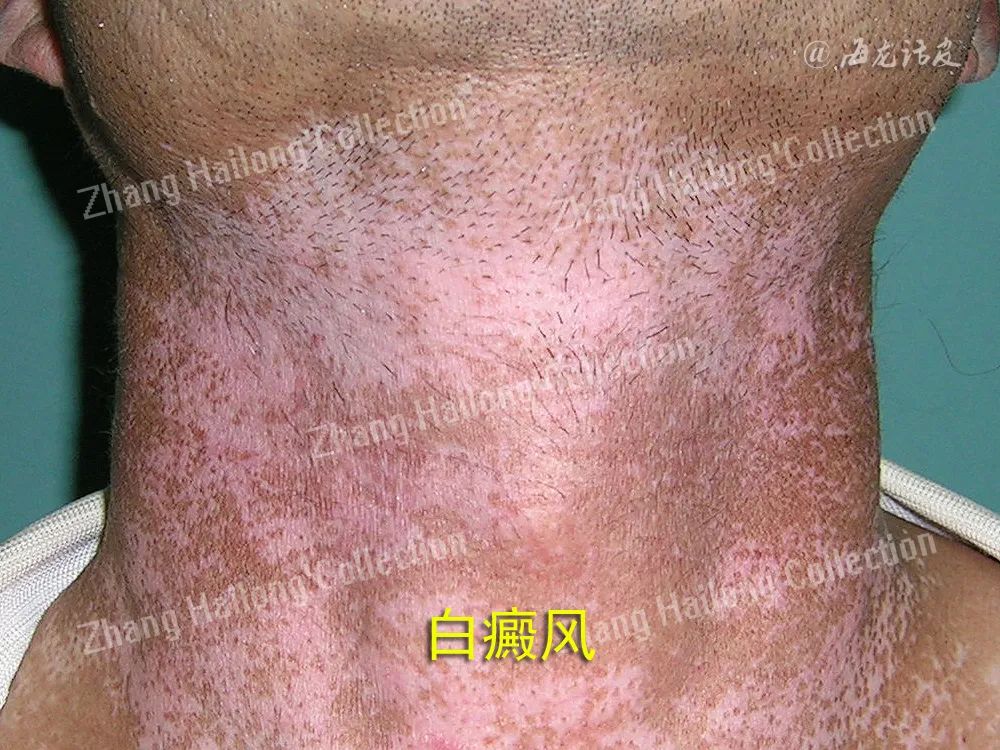
循环分化模型认为,在免疫应答急性期,初始T细胞增殖分化为效应细胞,迁移到炎症部位执行效应功能,抗原清除后,大部分效应细胞发生凋亡,而仍有小部分效应细胞存活并形成异质性的记忆T细胞。而线性分化模型认为,抗原或炎症信号的强度和持续时间是T细胞分化的关键因素。强烈而持续的抗原刺激下,初始T细胞活化增殖,分化为效应细胞,迁移到炎症部位执行效应功能,并随后死亡。而微弱的抗原刺激的T细胞最终分化为记忆T细胞。
除此以外,强烈和(或)慢性的抗原刺激也可导致T细胞持续表达抑制性受体,处于耗竭状态。当前对于TRM发育的认识仍处于起步阶段,除外初始T细胞、效应T细胞,还有文献认为TCM是皮肤TRM的主要前体细胞。目前普遍接受的观点是,组织特异性微环境调节信号有助于TRM的发育,导致不同组织中TRM的维持和功能差异,
对于皮肤TRM而言,转化生长因子β(transforming growth factor beta,TGF-β)、白细胞介素(IL)-15、IL-7、芳烃受体(the aryl hydro carbon receptor,AhR)等信号在其特异性的产生和发育过程中发挥重要作用。
皮肤TRM的表型
皮肤TRM分为CD4+TRM和CD8+TRM。CD4+TRM多位于真皮层,围绕毛囊与CD11b+抗原呈递细胞形成簇状结构,尽管其具有典型的TRM细胞表型,但与其他TRM不同,循环T细胞可以逐渐取代原有的CD4+TRM,就此而言,部分CD4+TRM本质上为组织循环TEM而非严格意义的TRM。CD8+TRM主要存在于表皮,与树突状γδT细胞(DETC)竞争生态位,具有特殊的树突状细胞结构,其树突状突起可以延伸到基底细胞层,在角质形成细胞之间缓慢但持续地迁移,能够在几分钟到几小时内识别抗原呈递细胞。

与其他TRM相比,表皮TRM特异性地表达皮肤归巢受体,如皮肤淋巴细胞抗原(CLA)及CCR8,皮肤驻留标志分子CD69及CD103的表达也持续上调。CD69是一种T细胞活化标志物,也是鞘氨醇-1-磷酸1(S1P1)的拮抗剂,通过介导S1P1内化和降解限制TRM的迁移能力。CD103与整合素β7配对为异源二聚体αEβ7整合素,与上皮细胞表达的粘附分子E-钙粘蛋白结合以协助TRM的定位、驻留和细胞形态的维持。事实上,CD69与CD103 的表达具有时间顺序性,CD69有助于TRM的早期趋化,而CD103则与TRM到达皮肤组织后的长期维持有关。
目前尚无关于白癜风TRM特异性表型的研究,但相比于其他皮肤疾病(如银屑病,以分泌IL-17的CD49aTRM17细胞为主),白癜风患者皮损周围的CD8+CD49a+TRM1细胞比例可达近50%,其能够组成性表达穿孔素、颗粒酶等毒性杀伤介质,分泌γ干扰素(interferon-γ,IFN-γ),产生较强的细胞毒性。白癜风皮损周围还富含一种特殊的CD8+TRM亚群,表达 CD69、CD103和趋化因子受体3(chemokine receptor 3,CXCR3),能够分泌IFN-γ和肿瘤坏死因子α(tumor necrosis factor α,TNF-α),发挥细胞毒作用。
皮肤TRM的组织定植和维持
组织趋化、定植及长期维持是TRM快速响应抗原再次刺激的前提。在小鼠模型中,TRM在免疫反应的效应阶段逐渐转移至皮肤等外周组织,在第7周达到峰值。TRM前体杀伤细胞凝集素样受体亚家族G成员1(killer cell lectin like receptor G1,KLRG1)阴性细胞上调CXCR3,能够感应角质形成细胞分泌的高浓度趋化因子CXCL9和CXCL10,从而向表皮定向迁移。
迁移至表皮后,KLRG1-前体细胞接受来自上皮细胞的TGF-β,上调CD103表达,维持TRM的组织定植状态。缺乏TGF-β受体的小鼠TRM缺乏CD103的表达,并逐渐从皮肤组织丢失。TGF-β还能够诱导皮肤中的树突状细胞上调V-整合素,从而在免疫稳定状态下与前体细胞相互作用,促进TRM的形成。此外,TGF-β信号传导还下调T-box家族蛋白T-bet和Eomes,从而促进TRM的分化。除外TGF-β,角质形成细胞、朗格汉斯细胞等分泌的IL-15也对TRM的分化成熟至关重要。IL-15还可以被角质形成细胞反式递呈,与TRM表面受体CD122结合从而维持TRM的定位和生存,还能刺激CD8+CD49a+TRM产生穿孔素、颗粒酶和IFN-γ,发挥细胞毒性杀伤作用。
除外皮肤微环境信号的调控,表皮TRM的代谢重编程也是其能够长期存活的重要前提。由于表皮富含脂质而其他营养素相对缺乏,表皮TRM上调脂肪酸结合蛋白(fatty-acid-binding protein,FABP)FABP4和FABP5以摄取外源性脂肪酸,从而维持其长期存活和生理功能。敲除FABP4和FABP5能够抑制TRM对外源性脂肪酸的摄取,从而影响其长期存活。
还有研究证实,将肝脏中的TRM转移到表皮后,TRM的FABP1表达下调,而FABP4和FABP5的表达上调,证明TRM可以根据其驻留环境的不同而适应性改变FABP的表达,从而更好地维持其长期存活和功能。除外自身的长期存活,TRM的自我更新也是其长期维持的关键。目前认为,TRM局部增殖是维持其自我更新的主要动力,从循环中招募的T细胞不能取代原TRM的生态位,且抗原依赖性竞争能够微调局部TRM库, 这可能部分性地解释白癜风皮损部位黑素细胞特异性TRM的积聚。
TRM与白癜风复发
目前,TRM介导白癜风复发的机制尚未完全阐明。有观点认为,TRM活化后分泌穿孔素与颗粒酶可直接导致黑素细胞死亡。在小鼠模型中,表皮TRM单独即可维持对于黑素瘤的免疫力,保护机体免受肿瘤复发的风险。也有观点认为,TRM 不能单独介导白斑脱色,而是充当前哨细胞,识别白斑复色过程中从毛囊中迁移出的黑素细胞,活化后分泌IFN-γ与CXCL9,从而招募循环记忆T细胞,通过IFNγ-CXCL9/CX-CL10-CXCR3轴共同驱动白癜风复发。
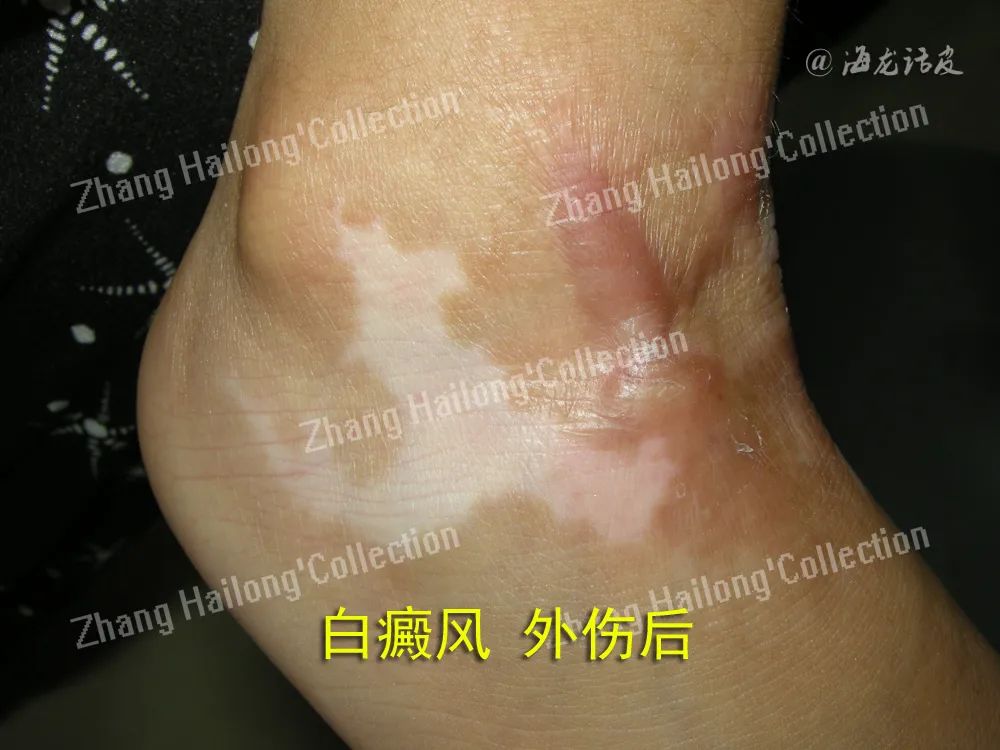
考虑TRM是异质性群体,除外CD49a+亚群可直接发挥细胞毒性作用,还可能存在其他亚群,负责募集循环中细胞毒性T细胞,共同介导白癜风的复发。此外,还有研究认为,IL-15能够促进TEM表达激活性受体(natural killer group 2,member D,NKG2D),从而表现出活化表型,并能够分泌IFN-γ及TNF-α,募集效应T细胞,也有可能介导白癜风的复发。
针对白癜风复发,目前尚未有理想的治疗方案。JAK抑制剂能够抑制成纤维细胞及角质形成细胞等分泌CXCL9/CXCL10,从而有效诱导白癜风白斑复色,但仍具有很高的复发风险,这是因为JAK抑制剂仅是阻断JAK/STAT通路从而抑制T细胞的募集,但并不能减少皮肤TRM数量。有研究发现,IL-15-CD122信号轴对于TRM的组织定植与长期生存至关重要,使用抗CD122抗体靶向抑制IL-15信号,2周即可降低IFN-γ的表达,而长期治疗则可减少皮肤组织TRM数量,逆转白癜风病程,目前正在进行临床2期试验(NCT04338581)。
此外,TRM存活和功能还取决于外源性脂质的摄取及其氧化代谢。过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)抑制剂(GW9662)或脂肪酸线粒体β-氧化抑制剂(etomoxir)治疗会导致皮肤中TRM的长期维持受损。因此,阐明调节TRM存活及凋亡的关键分子机制和信号传导通路,开发持久性白癜风治疗策略无疑是一项有前景的工作。
目前的进展与展望
TRM是白癜风复发的关键因素,但该亚群在白癜风中的作用机制研究尚处于起步阶段。在现有的动物模型中,很难通过靶向其表面标志物的抗体来耗竭TRM,且TRM分离效率较低,离体的TRM失活较快,这限制了对TRM的进一步研究。由于TRM的高度异质性,不同的解剖部位是否存在不同的TRM?表皮与真皮TRM之间、TRM与其他组织细胞之间是否存在一定的细胞间交叉对话?此外,表皮TRM终生暴露于皮肤微生物抗原刺激下,其与皮肤微生物组之间的相互作用是否会影响TRM的分化或功能?这些问题目前都尚未可知。
尽管目前的研究尚未阐明白癜风复发的具体机制,但其观测到的现象为进一步的研究和治疗提供了方向。一项长期随访研究显示,对局部白癜风及早进行全身免疫治疗能够显著抑制疾病复发,这可能是因为早期治疗能够防止其建立免疫记忆,但治疗启动的关键节点尚不明确。还有研究提出,早期靶向TGF-β可以阻止TRM前体细胞的分化,但目前未在白癜风模型中开展研究。TRM独特的树突状形态与迁移过程使得其能够与大量的皮肤组织细胞广泛接触,例如TRM在迁移阶段有规律地定期与朗格汉斯细胞(langerhans cell,LC)胞体接触,耗竭LC可以导致TRM迁移速度降低,但尚无文献直接研究这种细胞间接触对于TRM的功能及维持的作用。
此外,目前的研究大多关注于表皮CD8+TRM,对于真皮TRM、γδT细胞的研究较少。在小鼠模型中,TRM与DETC竞争生态位,且研究证实白癜风皮损部位DETC的数量下降,因此,如果能恢复DETC等其他细胞的生态位竞争能力,有可能在靶向抑制TRM减少白癜风复发的同时降低其对于系统免疫的影响。TRM接受不同组织的特异性信号来介导细胞的生存和维持,进一步阐明这些信号将提高治疗的靶向性和特异性。最新的研究发现,靶向c-Maf或ICOS分子可选择性清除皮肤中CD49aTRM17细胞而不影响皮肤CD49a+TRM1细胞,为以Th17为主的免疫性疾病(如银屑病等)的治疗带来新的思路,但靶向CD49a+TRM1细胞的方法尚不清楚。
也有研究提出表皮TRM能够诱导产生淋巴结TRM,其中一亚群存在于引流淋巴结被膜下窦,与CD169+巨噬细胞存在接触,但尚无证据证明这一环节是否影响再次免疫的启动或维持。此外,皮肤组织外的TRM激活后能够重新进入循环,而后再分化为TRM重新充填至不同组织,这种"由外而内"的免疫反应及TRM发育和迁移的可塑性提示应关注不同组织间TRM亚群的相互作用,而非仅局限于白癜风皮损部位的TRM亚群。
综上所述,阐明早期干预对于免疫记忆的影响、细胞间接触及串扰对于TRM功能的影响及TRM产生、存活的具体机制,将有助于进一步研究白癜风复发的具体机制,开发更有效的治疗方法。
参考文献:
1.吴畏,王鑫菊,贺楷乔等.皮肤常驻记忆T细胞参与白癜风复发的研究现状[J],临床皮肤科杂志,2024,53(5):317-320.
2.WANG Y, LI S, LI C.Clinical features, immunopathogenesis and therapeutic strategies in vitiligo[J].Clin Rev Allergy Immunol,2021,61(3):299-323.
3.EZZEDINE K, ELEFTHERIADOU V, WHITTON M, et al.Vi-tiligo[J].Lancet,2015,386(9988):74-84.
4.其他文献(略)


