DNA突变阴性的晚期肺癌有必要进行RNA-NGS检测,非吸烟者融合检出率更高!
时间:2024-07-08 15:00:44 热度:37.1℃ 作者:网络
转移性非小细胞肺癌(NSCLC)表现出RAS-MAPK通路的多种分子变异。特别是,NSCLCs表现出可作为靶点的ALK、RET、ROS1、NRG1和NTRK融合或MET外显子14跳跃的高发生率。在EGFR/KRAS/BRAF突变中快速准确地检测基因融合对于治疗选择非常重要,特别是对于一线适应症。基于RNA的二代测序(NGS)panel似乎是最合适的,因为所有靶点都在一次运行中进行了多重检测。虽然全面的NGS panel在日常实践中仍然昂贵,但使用靶向DNA/RNA panel方法的最佳测序策略需要验证。在本研究中,研究者描述了其肺癌筛查策略,使用DNA和RNA靶向方法,在一个包含589例NSCLC患者的真实队列中进行分子检测。研究者采用两步策略对174例癌基因驱动突变阴性或ALK免疫组化阴性的患者进行了基因融合分析。
在提供的样本中,有28%发现了可作为靶点的变异。非吸烟者有63.7%的概率出现可作为靶点的变异,而吸烟者为21.5%。接受分子匹配治疗的患者总生存率显著较高(p=0.03)。本研究表明,在成本和时间可控的情况下,对所有样本进行NSCLC DNA/RNA分子筛查的常规检测是可行的。RAS-MAPK野生型肿瘤患者中显著的高融合检出率凸显了在NSCLC中修改检测策略的重要性。
研究背景
多种体细胞变异参与了癌症的恶性转化,其中的致癌驱动基因可能是治疗的靶点。由于大规模全面的分子研究,我们可以在基因组水平评估肿瘤获得的异常。驱动肺癌发生的许多不同癌基因是可靶向的,并且在许多情况下,使用激酶抑制剂已成为标准治疗。然而,全基因组、全外显子组或RNA测序作为常规诊断工具的可行性和临床效用仍存在争议。随着新治疗药物的批准过程继续挑战临床实验室高效检测分子靶点的能力,我们需要探索替代策略。事实上,医疗机构的组织样本往往有限,而福尔马林固定的样本限制了进行基因组规模检测的选择。在检测突变、拷贝数变异和基因融合方面,寻找最佳测序策略可能具有挑战性。基因融合是主要的可靶向的致癌事件,通常以较低的频率单独被发现。基因融合是由两个基因或部分远隔基因并置、易位、大片段缺失或染色体倒位形成的杂交体。融合基因在许多肿瘤中被描述,许多不同的融合类型已被鉴定。迄今为止,数据库至少描述了21,000个融合。近年来,随着分子匹配靶向治疗的出现,临床对融合基因的兴趣激增。
在转移性非小细胞肺癌(NSCLC)中,现行指南推荐多种生物标志物用于预先检测,包括突变和融合分析。总共有50%以上的肺癌患者携带潜在驱动突变。
NSCLC中RAS/MAPK通路的突变频率高,EGFR(10-15%)或KRAS(30-40%)突变常见,BRAF(2-3%)、HER2(1%)或MET(2%)分子变异的频率较低,所有这些分子变异均可被特异性抑制剂靶向。融合发生于5%-10%的病例,并且在诊断时与其他驱动因素相互排斥。大多数基因融合涉及ALK(5%)、ROS1(1-2%)和RET(1-2%)。BRAF、NRG1、NTRK1-2-3和FGFR1-2-3也存在融合(各<1%)。虽然一些基因变异看起来可能罕见,但全面识别所有可作为治疗靶点的基因变异是必要的,因为这可能改变患者的治疗,并最终改变病程。肺癌患者已有基于分子的治疗方案,无论是已批准的还是通过临床试验的,因此应提供检测。与化疗相比,在一线中将分子变异匹配靶向治疗可延长生存期,这一事实对确定分子特征的时间提出了挑战。此外,在有驱动突变的NSCLC患者中,支持使用免疫疗法的证据水平较低。在这种情况下,从筛查效果、获得结果的时间和成本方面确定最佳方法是很重要的。经验证后,可以首先使用免疫组织化学(IHC)检测融合物。最好的例子是NSCLC中的ALK融合,但荧光原位杂交(FISH)仍然被认为是金标准。由于许多原因(包括更高的通量和融合伴侣的特征),RNA测序方法代表了一种有吸引力的替代方法。此外,了解在肺癌中具有临床价值的不同融合基因的数量提供了一个泛诊断解决方案。全转录组测序(WTS)可对融合基因进行全面分析;然而,由于目前的成本和对新鲜冷冻组织的需求,WTS尚不适合常规临床应用。将基因融合抑制剂作为一线治疗的试验强调了开发可多靶点治疗策略的必要性。靶向RNAseq panels可在小型测序平台上实施,针对福尔马林固定石蜡包埋(FFPE)RNA进行了优化,并在基因融合检测中显示出良好的灵敏度。基于PCR的技术被设计用于检测独立于其伴侣的融合,特别是不同类型的融合变异体。基于等位基因不平衡的其他策略也可能从伴侣那里盲检出基因融合。最后,基于融合特异性探针的纳米链技术开发了用于研究融合基因的非二代测序多重检测方法,以检测临床感兴趣的融合。
在这项研究中,研究者描述了其在临床上使用序贯但时间高效的DNA/RNA工作流程对晚期和转移性NSCLC进行常规检测的经验,并报告了临床数据,表明接受分子匹配治疗的患者生存改善。
研究方法
排除EGFR(第18-19-20-21号外显子)、KRAS(第2-3-4号外显子)、BRAF(第11-15号外显子)和ERBB2(第20号外显子)突变,以及ALK IHC 3+的患者。肿瘤突变检测采用两步算法。使用TaqMan探针(ThermoFisher Scientific)对样本进行分析,以快速鉴定EGFR和KRAS频繁突变。突变样本只接受靶向DNA NGS panel检测,而EGFR和KRAS野生型样本同时接受靶向DNA和RNA NGS panels检测。
研究结果
NSCLC患者和基因融合变异:
共收集589例肺癌组织进行分子检测。DNA分析发现4例BRAF p.V600E + 10例BRAF非p.V600E、53例EGFR、176例KRAS、2例NRAS、6例MET和8例ERBB2样本,14例没有突变,208例有TP53突变。在EGFR、KRAS、ERBB2和MET野生型肿瘤患者中,174例患者有可用于融合检测的RNA,并被纳入融合研究。患者平均年龄63岁(范围:29-93岁)(图1)。该队列包括109名男性和65名女性,98名吸烟者和43名非吸烟者(33名数据缺失)。在这174例患者中,26例样本未能提供cDNA文库(15%),并且在两次尝试后,基因融合状态仍然无效(表1)。对于失败的样本,18例的RNA浓度较低(<2 ng/μL),另外8例的浓度范围为4-3,000 ng/μL。在148例有数据的样本中,42例(28%)为RET(n=11)、ROS1(n=7)、NRG1(n=6)、ALK(n=5)和MET外显子14跳跃(n=9)融合阳性,或者有EGFR(n=3)和BRAF(n=1)致癌异构体(表2)。RET融合最常见的伴侣是KIF5B(9/11),ROS1融合最常见的伴侣是CD74(5/9)。
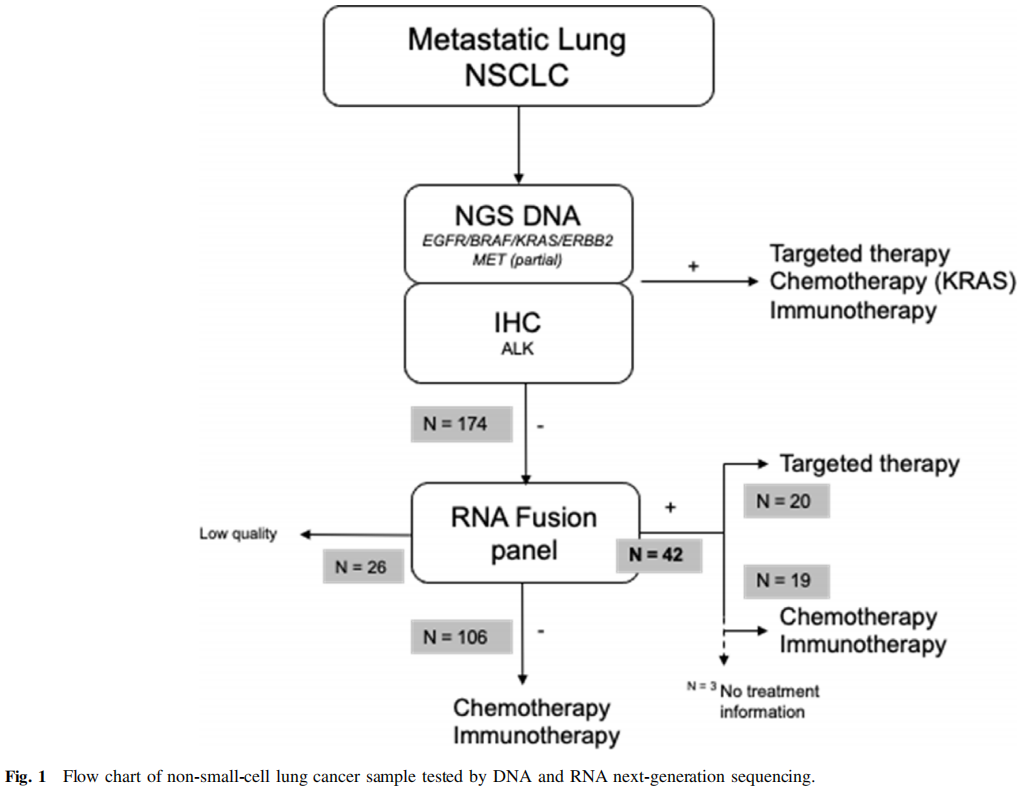
图1
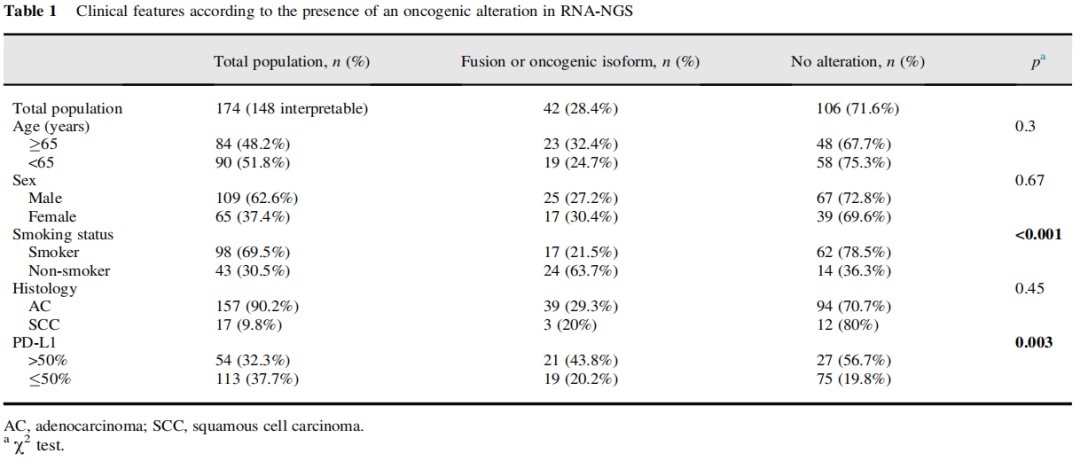
表1
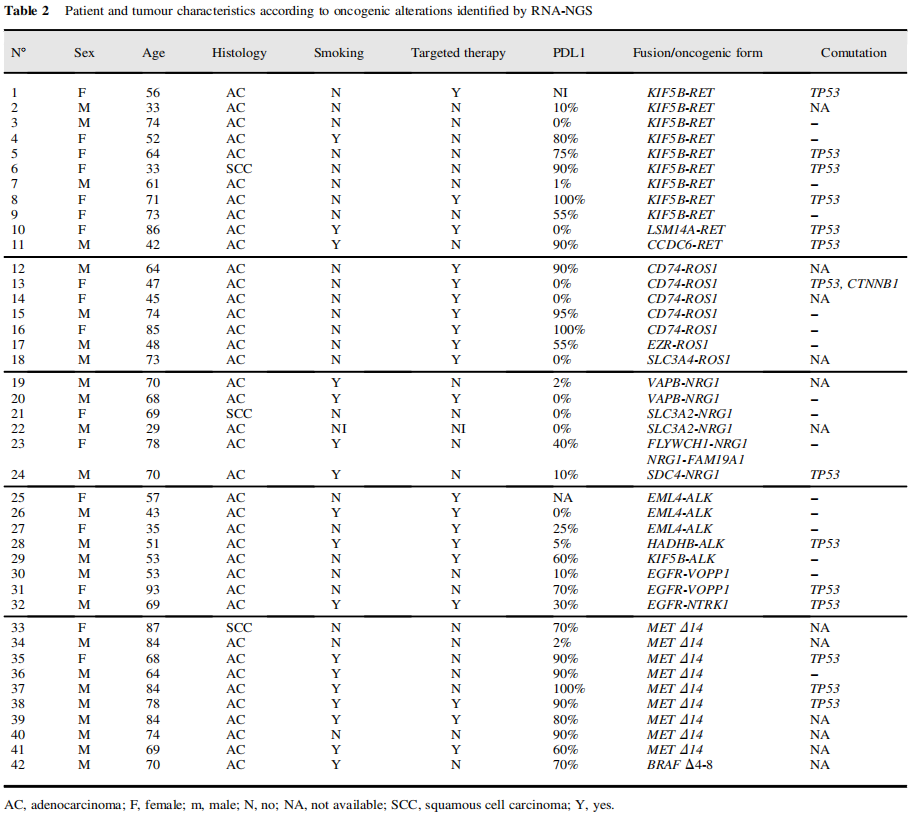
表2
其他融合基因包括NRG1(6/42)、对应于IHC 2+样本的ALK(5/42)、一个NTRK1融合和一个BRAF外显子4-8剪接变异体(表2)。在两个肿瘤中,研究者发现了EGFR-VOPP1(囊泡,在癌症中过表达,促生存蛋白1)融合。在这两个病例中,框内融合是明确的,显示超过150个连接读数。但2个基因均位于7号染色体,且2例样本均有EGFR扩增,因此该事件可能与EGFR扩增有关。融合在不吸烟者中显著较高(p<0.001),在PD-L1肿瘤细胞表达>50%的肿瘤中显著较高(p=0.003)。值得注意的是,非吸烟者有63.7%的可能性发生可靶向变异,而吸烟者只有21.5%。未发现与年龄、性别或组织学亚型相关。
融合与另一种癌基因驱动基因相互排斥,但常与TP53突变相关,1例ROS1阳性肿瘤有CTNNB1激活突变(表2)。9例肿瘤有MET外显子14跳跃转录本。
FISH与靶向RNAseq的一致性:
19例样本进行FISH验证。FISH和NGS检测ROS1、ALK和RET结果一致。研究者发现了2例关于RET融合不一致的病例。1例FISH结果不确定,12%的阳性细胞,NGS为阳性,另1例FISH结果阳性(21%的阳性细胞)但未得到NGS证实。该病例涉及一名71岁女性,有吸烟史(25包年),患局限性(pT2N0)TTF1阳性腺癌,于2015年11月切除,PD-L1肿瘤细胞表达率为90%。患者接受了长春瑞滨-顺铂辅助化疗,术后数月复发,伴淋巴结、骨、胸膜和肺转移。患者接受了培美曲塞-卡铂二线化疗,随后接受了培美曲塞维持治疗,但在4个周期的维持治疗后,患者的疾病进展。由于耐受性差(间质性肺疾病、胃肠道出血),患者从2017年5月至2018年4月开始接受纳武利尤单抗三线治疗,并且膈上和膈下淋巴结分离性进展。由于对切除肿瘤的初始分子分析显示RET FISH重排(21%的肿瘤细胞)(图2),因此患者于2018年6月接受RET特异性抑制剂塞普替尼靶向治疗,且疾病稳定。塞普替尼治疗后进行了活检,结果显示MET外显子14跳跃转录物。患者接受了MET抑制剂(研究性药物)的第二种方案,2个月时的应答轻微,耐受性差(恶心、肌酐升高、心动过速和脂质血症)。第二种MET抑制剂克唑替尼于2018年12月至2019年5月使用,耐受性和应答良好。经两种MET抑制剂治疗9个月,患者的疾病得到了控制,RNAseq未证实RET融合,患者被考虑为MET重排。
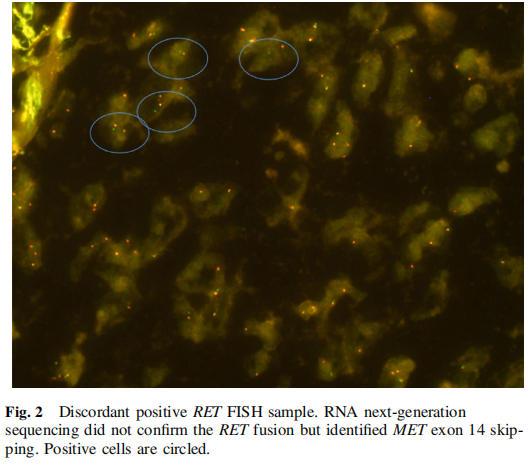
图2
生存:
研究者分析了融合和致癌基因重排阳性癌症患者的临床数据和生存情况。在有变异的42例患者中,20例患者接受了匹配的靶向治疗,但没有获得无进展生存期(PFS)数据,仅根据治疗比较了组间总生存期(OS)(图3)。OS计算自诊断日期至死亡日期。与未接受匹配靶向治疗且接受化疗和/或免疫治疗的患者相比,接受匹配靶向治疗的患者有显著改善(p=0.033)。未接受分子匹配治疗的患者与未发生可靶向变异的患者的OS相似。在去除ALK和ROS1后的患者亚组中观察到类似的生存改善趋势。考虑到所有的融合,TP53共突变对总生存无影响。
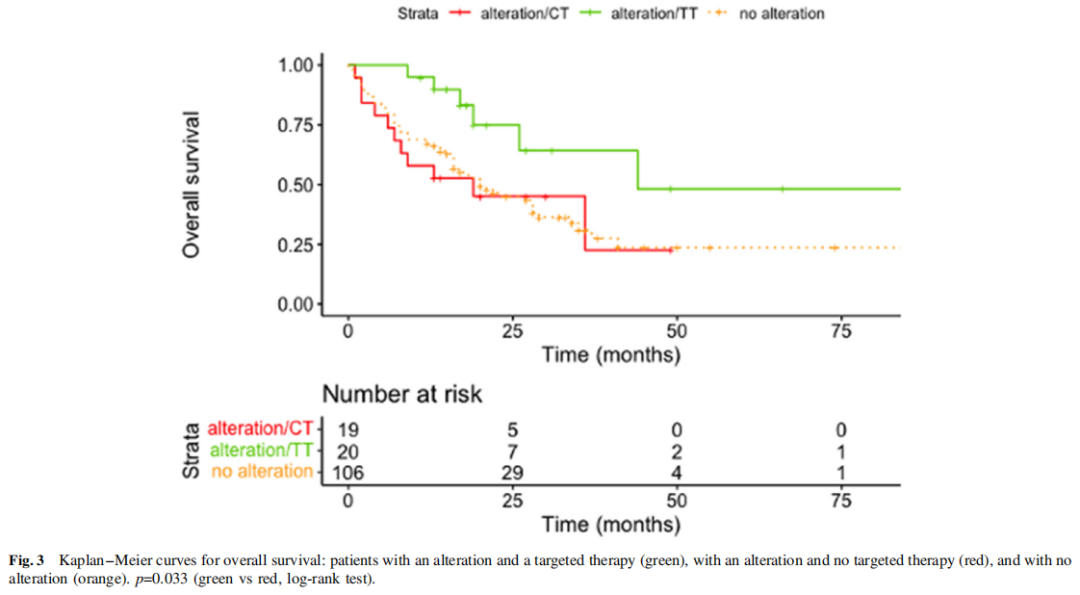
图3
讨 论
融合基因和异常转录本是由染色体重排或剪接事件引起的癌症的标志。在肺癌中,基因融合的发生率为10-15%,范围从ALK的5%到NTRK的不到1%。然而,靶向罕见融合事件的新药获得批准,因此有必要对其进行大型分子特征分析。基因融合或METex14与其他RAS/MAPK通路变异(EGFR/ERBB2/KRAS/BRAF)是互斥的,因此对可用于治疗的突变进行预筛查增加了发现致癌融合的机会。在本研究中,研究者在42例(28%)热点突变野生型肿瘤的患者中发现了可作为靶点的融合基因或致癌异构体。提前进行RNA分析将在特别低比例的检测样本中产生阳性结果,成本效益较差,在未经选择的NSCLC人群中,阳性结果的比例将降低50%以上。除了未表达的基因外,突变数据可以通过靶向RNAseq产生,在临床环境中,仅RNAseq可以作为分析肺癌样本的一种选择。然而,与DNA测序相比,RNAseq的不确定样本比例更高。这一观察结果对FFPE组织RNA提取这一关键步骤提出了挑战,因为近15%的肿瘤样本不适合进行基于NGS的分析。然而,由于许多样本来自回收的旧FFPE块,这一失败率不能反映当前的情况,即提取的大部分是近期的活检。对于这些患者,潜在存在的融合未得到诊断。对于DNA测序后为野生型肺肿瘤且无适合RNA用于融合检测的非吸烟者,需要讨论重新活检,因为发现融合驱动基因的可能性高。在本研究中,研究者检测到超过50%的患者发生了融合(表1)。值得注意的是,本研究表明,质量的缺乏与数量的缺乏同样重要。本研究失败样本中有一半的RNA含量很高。现有的提取试剂盒显示出总体相似的性能;新鲜冷冻组织的使用或甲醛固定技术的发展可能有助于保持RNA质量。作为分子生物学家,面临的挑战是优化肿瘤分子特征,考虑到可用组织的缺乏、诊断时间、大量可靶向变异和检测成本。选择DNA-RNA检测对诊断时间(如果先后进行)或成本(如果同时进行)提出了挑战。在诊断时,基因融合与其他驱动基因(如EGFR、KRAS或BRAF)的共变异在文献中罕见。此外,目前尚不清楚有共突变的患者可否从靶向治疗中获益,因为激活下游通路会绕过抑制作用。Cohen等人建议,对于非吸烟者,基于RNA和DNA的检测panels应平行进行,以缩短测序时间。然而,这些信息并非总是可用,并且可能难以分别管理吸烟者和非吸烟者的样本。在本研究中,研究者根据无可作为靶点的突变而选择患者后,在近2/3(63.7%)的非吸烟者和21.5%的吸烟者肿瘤中发现了可用于治疗的变异。这表明,吸烟不应影响检测策略,然而,非吸烟者有更大的机会检测到可靶向的融合。
为了平衡出结果时间和成本,研究者采用了半序贯策略,使用TaqMan探针分析EGFR和KRAS常见突变。提取后数小时内可获得结果,然后对野生型样本并行进行靶向DNA和RNAseq,而对EGFR或KRAS突变样本取消RNAseq(图4)。根据2021年的评估(729个需求,对485个野生型样本进行了RNAseq),这种特定的DNA/RNA策略避免了33%的患者进行不必要的RNA检测。周转时间略有增加,但仍符合临床需要。在研究者过去6个月的临床实践中,当进行融合基因的DNA NGS + RNA NGS时,93%的结果(62/67)在<15天内得到,平均为10.8天;而当仅进行DNA NGS时,96.5%的结果在<15天内得到,平均为9.1天。这一序贯策略优化了诊断时的检测,但对于接受靶向治疗的患者,不应在复发时使用,因为已有报道称突变和融合同时发生。基于qPCR和5′/3′不平衡的极速基因融合检测技术,或具有24小时内优化的自动化工作流程的NGS,有可能显著改善全球周转时间和改变实验室策略。尽管它们表现出良好的性能,灵敏度和特异度约为90%,但仍不足以取代目前的NGS panels。因此,这些技术可作为有足够材料的紧急患者的初始筛查策略。
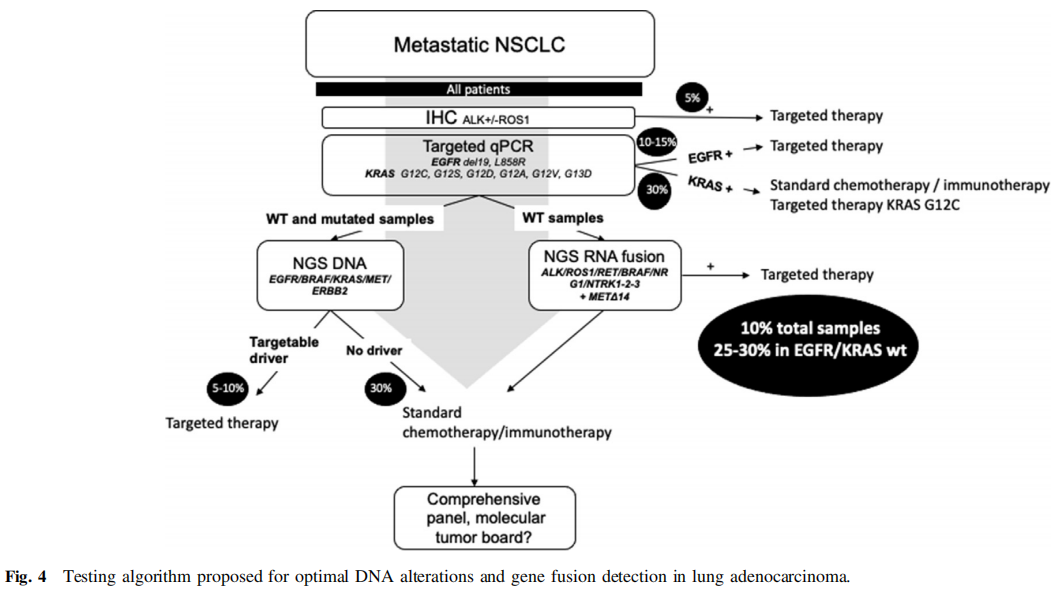
图4
不同的研究比较了RNAseq panels检测结果判定融合事件的准确性。在本研究中,研究者没有比较不同的NGS选择。对于有数据的样本,将FISH与靶向RNAseq进行比较。研究者发现了RET融合的不一致,研究者报告了一个假阳性FISH结果的例子。这种情况已经有描述,并且通常与低阳性/临界阳性相关,本研究中(20%)的原因是RET重排并不总是导致功能性融合。在本研究的患者中,METex14突变的存在,以及MET抑制剂作为第五线给药时观察到的反应,支持RET融合为假阳性(图2)。对于RET筛查和检测,FISH是一种敏感但不特异的技术,检测结果需要得到证实。
在临床关联方面,与之前的研究结果相反,本研究未发现性别/年龄与融合/剪接转录本检测之间有显著关联。
生存分析显示,接受分子匹配治疗的患者从诊断开始的OS显著高于其他患者。在发生可靶向变异的患者中,未接受靶向治疗的患者的OS较低(从诊断开始计算),中位生存期为22个月,而接受靶向治疗的患者为45个月。这不是由于PS的差异,也不是由于它们不适合临床试验。有可靶向变异但未接受靶向治疗的患者的OS与无可靶向驱动因素的患者相似。在ALK+肿瘤中,TP53突变与较低的PFS和OS相关。在本研究中,TP53突变与携带可靶向融合患者的生存期无关,这提示这种关联仅针对ALK+肿瘤。接受靶向治疗的患者分布不平衡,以ALK和ROS1为主。然而,在非ALK、非ROS1变异的患者亚群中观察到较好的OS趋势(数据未显示),这凸显了融合检测在NSCLC中的重要性。最后,本研究证实了高PD-L1染色和融合驱动基因之间的关联。高PD-L1表达肿瘤患者适合接受一线免疫治疗,而高PD-L1表达融合阳性肿瘤患者可能不适合。事实上,正如对ALK、ROS、RET和MET所示,免疫疗法可能仅对其无效。MET外显子14跳跃的策略可能包括DNA和/或RNA panels。由于难以检测或判定大片段缺失,MET突变可通过DNA测序漏检。RNA策略可能用于补救这一问题,也可能证实未描述的剪接变异体的致病性。
研究者对常规分子检测的分析表明,靶向DNA/RNA NGS检测对于肺癌患者选择最佳治疗方案是必要的。这允许识别所有已报道的基因突变和融合。优化的工作流程(可能取决于当地组织)可能经过验证,以改善临床检测的成本和周转时间。对所有DNA突变阴性的肺癌患者进行基因融合检测具有重要意义,因为并不是所有患者都能从个体化治疗中获益。对于无组织样本或低质量RNA的患者,应强烈考虑再次活检。
参考文献:
Garinet S, Lupo A, Denize T, Loyaux R, Timsit S, Gazeau B, Fabre E, Maaradji Z, Gibault L, Giroux-Leprieur E, Duchemann B, Monnet I, Jouveshomme S, Aldea M, Besse B, Le Pimpec-Barthes F, Leroy K, Wislez M, Blons H. Successive next-generation sequencing strategy for optimal fusion gene detection in non-small-cell lung cancer in clinical practice. Pathology. 2024 May 18:S0031-3025(24)00124-7. doi: 10.1016/j.pathol.2024.02.014. Epub ahead of print. PMID: 38834439.



