【AJH】EBV阳性DLBCL-NOS的诊断、风险分层和治疗(2024更新)
时间:2024-07-12 19:01:24 热度:37.1℃ 作者:网络
EBV阳性DLBCL-NOS
Epstein Barr病毒阳性(EBV+)弥漫型大B细胞淋巴瘤(DLBCL)-非特指型(NOS)是一种与EBV感染相关的侵袭性B细胞淋巴瘤,自2016年以来被WHO列入淋巴样肿瘤分类。EBV感染在DLBCL患者中的真实患病率尚不清楚,因为还没有进行过大规模的基于人群的研究,但根据病例系列报道,西方国家的患病率为5%,亚洲、东欧和南美洲的患病率为10%-15%。虽然历史上与预后不良有关,但在免疫化疗时代结局似乎有所改善。
《American Journal of Hematology》近日发表综述,阐述了EBV阳性DLBCL-NOS的诊断、风险分层和治疗及其更新。

诊断
有两种淋巴肿瘤分类:WHO-5HAEM和2022-ICC。在命名方面,5HAEM删除了“非特指型(NOS)”一词,而2022-ICC保留了与之前WHO第四版分类相同的命名法。在疾病定义、诊断标准、形态亚型和疾病生物学方面,两种分类相似。
EBV阳性DLBCL-NOS可涉及淋巴结和结外部位,EBV阳性 DLBCL 的形态学可分为两大类:多形性和单形性亚型(图1)。
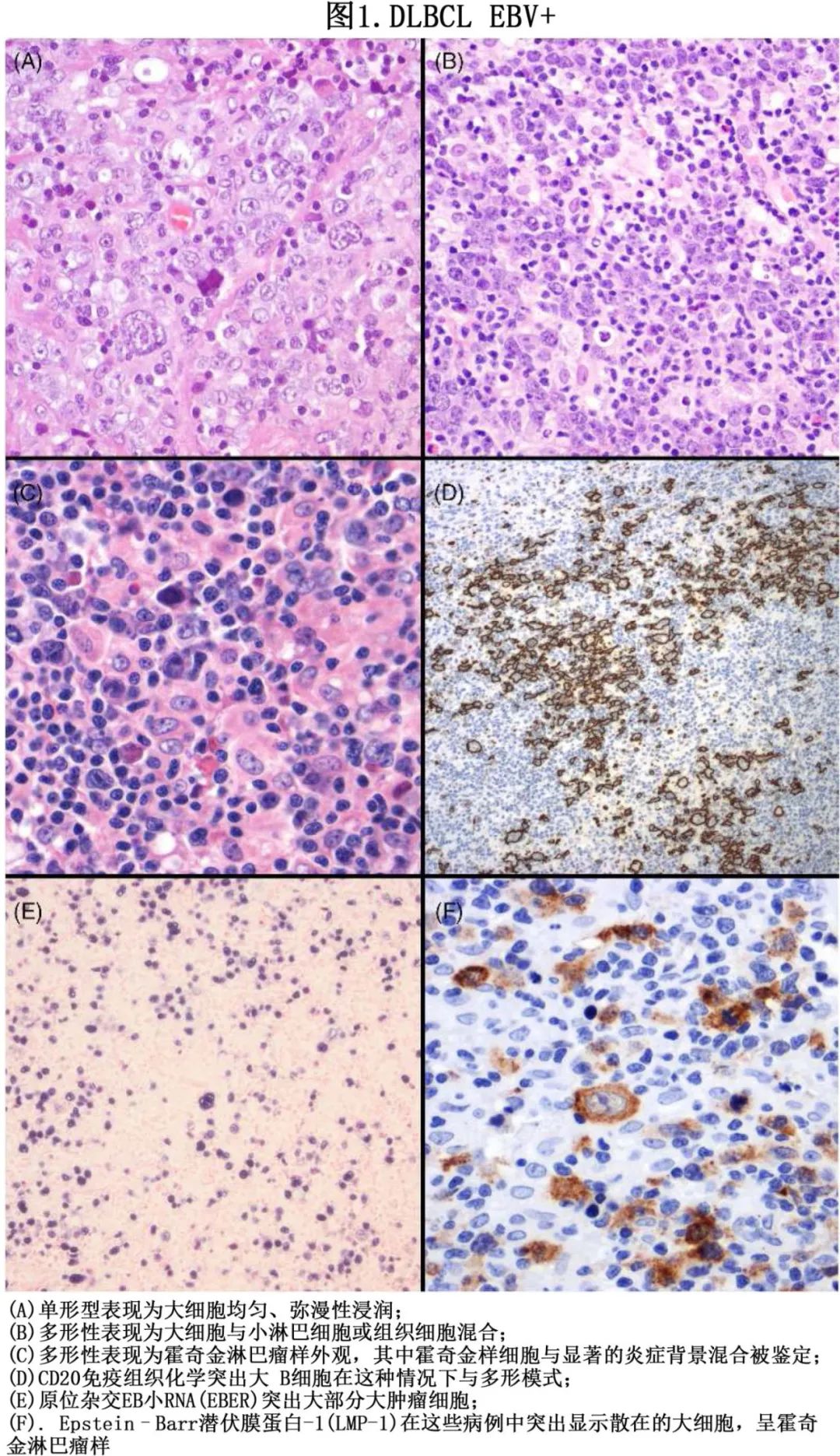
多形性是最常见的亚型,约占70%的病例,其特征是由很少和分散的肿瘤细胞组成的多形性浸润,掺杂 Reed-Sternberg-like 细胞和淋巴细胞、浆细胞和组织细胞的反应性免疫微环境。根据肿瘤细胞的不同比例,将多态组分为DLBCL 样、霍奇金淋巴瘤样和多态性淋巴增生性疾病样。约30%的病例为单形性亚型,其特征为肿瘤细胞弥漫性和单调(monotonous)增殖,显示中心母细胞、免疫母细胞或浆母细胞细胞学谱系。该肿瘤的主要免疫组织化学特征为表达泛 B 细胞标志物(CD20+、CD79a+ 和PAX-5+),具有共同的活化 B 细胞表型,正如 Hans 算法 (CD10-、BCL-6-/+、IRF4/MUM1 +) 所定义(图2)。
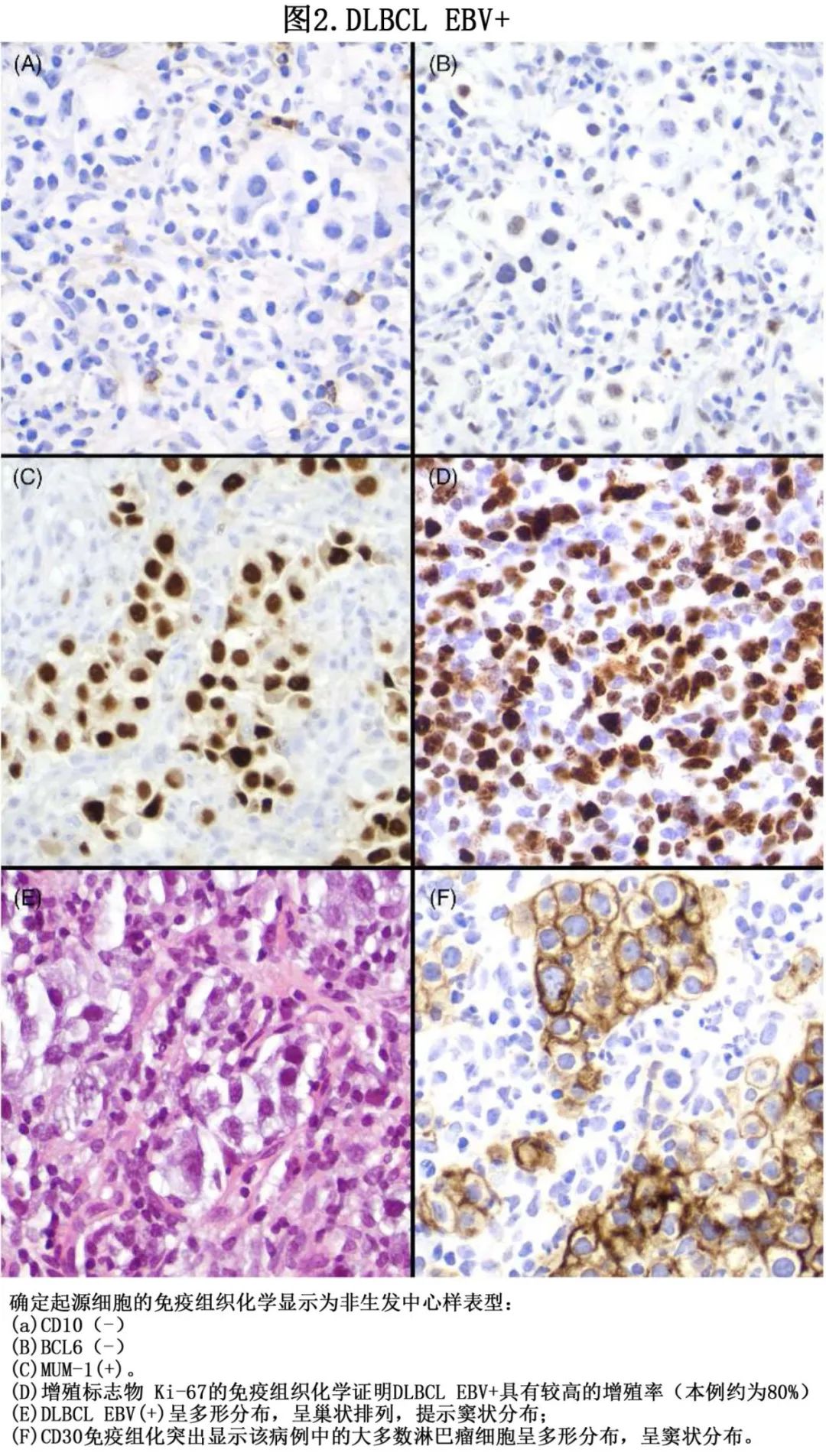
根据定义,EBV表达存在于所有病例中,通常具有潜伏模式III,表达主要的 EBV 相关潜伏蛋白(EBER、LMP-1和EBNA2)。应通过细致的病理评估建立诊断,检测EB病毒编码RNA (EBER)是标准诊断方法。但EBV 阳性的临界值存在争议,文献较为多变,ICC 2022规定应在>80%的恶性细胞表达EBER时诊断EBV+ DLBCL-NOS,CD30、c-MET、c-Myc和 PD-L1 通常为阳性;而WHO-HAEM5强调大多数肿瘤细胞应该是EBER阳性,但没有设定明确阈值。CD30是独立预后因素,因其在肿瘤细胞中的表达是线粒体功能障碍的保护因素。PD-L1 在年轻人中的表达比老年人中更常见,可能是由于 EBNA-2 上调所致。Ki-67的解释可能具有挑战性,尤其是在具有多态性特征的病例中;但Ki-67通常较高。分子学上具有较大异质性,但 IGH 基因重排和 NF-B 和 JAK/STAT 通路的活化突变以及 TET2 和 LILRB1 突变是其恒定特征。有趣的是,其中一些突变如TET2、TP53、APC和 PTPN11 与潜能未定的克隆性造血(CHIP)有关。与 EBV 阴性 DLBCL 病例相比,EBV阳性 DLBCL 病例似乎具有更多的拷贝数变异和缺失,尤其是在 PD-L1 和 JAK2 基因中。microRNA-24 水平的增加似乎受到 EBNA2 上调的调节,可减少ICOSL表达和维持c-MYC 高增殖率。
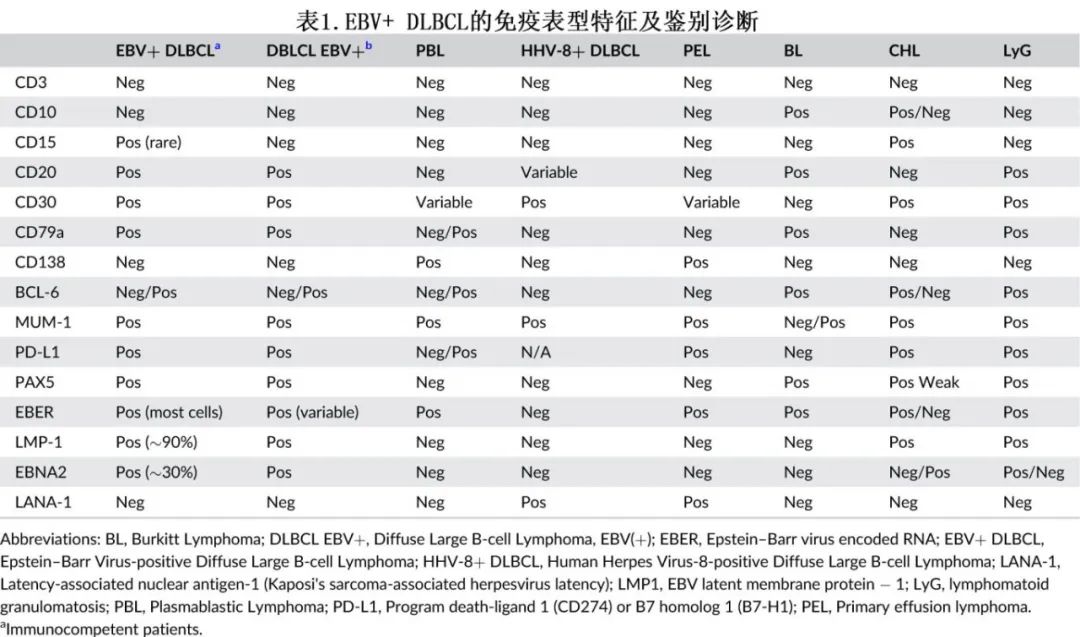
由于疾病的临床病理学表现和形态学谱各不相同,鉴别诊断很广泛,在某些情况下非常具有挑战性。表1总结了EBV+ DLBCL的主要免疫组化特征,并与鉴别诊断中的疾病进行了比较。EBV阳性DLBCL-NOS的鉴别诊断包括浆母细胞淋巴瘤、伴慢性炎症的DLBCL、原发性渗出性淋巴瘤(primary effusion lymphoma)等。
预后因素和风险分层
EBV阳性时DLBCL化疗时的不良预后因素,包括免疫化疗治疗下也是如此,但也有研究认为EBV+ 和EBV- DLBCL接受免疫化疗的预后相似。总的来说,EBV+ DLBCL患者在接受化疗时预后比EBV阴性患者差。尽管EBV+ DLBCL患者比EBV- DLBCL患者接受免疫化疗的疗效仍要差一些,但似乎优于化疗。
国际预后指数(IPI)和Oyama评分可用于风险分层。Oyama评分包括年龄>70岁和存在B型症状。GELL评分包括ECOG>2、>1个结外受累部位、血清白蛋白<3.5 g/dL、血清 LDH 水平高于正常上限和血小板-淋巴细胞比值>455。噬血细胞性淋巴组织细胞增生症 (HLH) 是EBV+ DLBCL(NOS) 不良预后的重要风险因素,鉴于缺乏特定的治疗建议,HLH的早期筛查对于及时启动免疫化疗至关重要。继发性 HLH 通常由感染(如 EBV 或恶性肿瘤)触发,使预后进一步复杂化,强调在管理EBV+ DLBCL时需要提高临床警惕。CD30和PD-1/PD-L1表达也正在成为潜在的不良但可靶向的生物标志物,其他标志物包括生物素(survivin)、M2肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)、神经纤毛蛋白-1(Neuropilin-1,NRP1)、MYC和KMT2突变以及EBV DNA病毒载量等。新出现的数据支持CD30和PD-L1表达以及EBV DNA的预后价值。
治疗
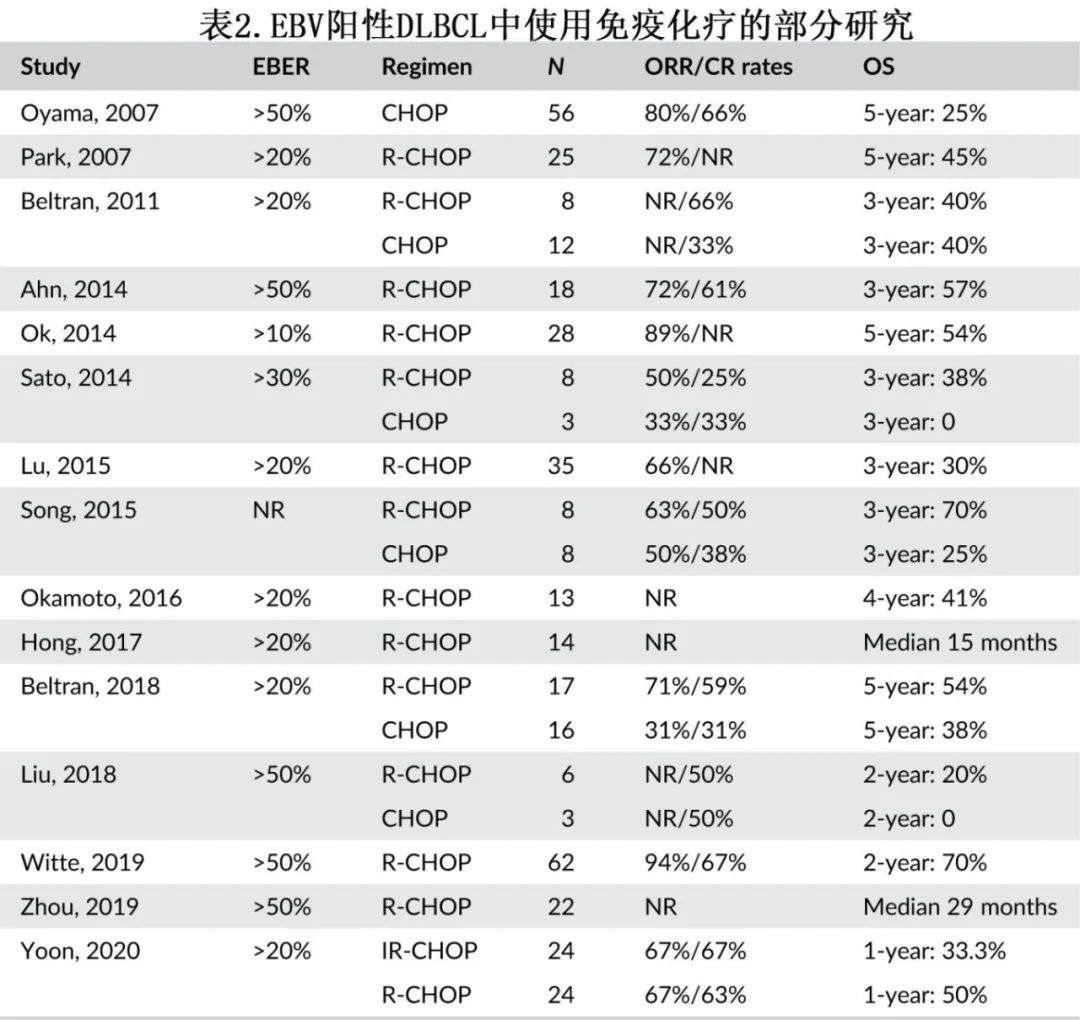
EBV+ DLBCL患者应按照与初治DLBCL患者相似的指南进行分期和管理。但在免疫化疗时代,EBV+ DLBCL-NOS的预后可能比EBV阴性DLBCL更差。因此,建议在有条件的情况下将患者纳入临床试验。此外应进一步研究和开发EBV+ DLBCL-NOS患者的靶向治疗。在部分研究中,初治EBV+ DLBCL患者对化疗和免疫化疗的反应率见表2。
维泊妥珠单抗联合R-CHP治疗DLBCL的研究获益且未排除EBV+ DLBCL-NOS患者,或许将会成为其首选方案,但还需要进一步确认该方案治疗EBV+ DLBCL的疗效。
复发/难治性EBV+ DLBCL如果对挽救性化疗敏感,可考虑自体造血干细胞移植。对于既往自体造血干细胞移植失败或由于化疗难治性而无法进行自体造血干细胞移植的患者,如果适合移植且有合适供者,则可以考虑异基因移植。随着CAR-T疗法获批治疗一线免疫化疗12个月内难治或复发的DLBCL,自体和以及异基因移植的作用将继续发展,且排序也仍有待确定。
新型疗法
由于目前尚无特异性靶向EBV+淋巴组织恶性肿瘤的靶向治疗获批,新的方案旨在解决EBV生理病理中涉及的不同通路(如病毒复制),包括通过疫苗开发EBV特异性免疫、靶向EBV特异性激活通路,以及改善/调节针对EBV+淋巴组织恶性肿瘤的免疫反应。
靶向EBV的治疗
由于典型的抗病毒治疗无法有效根除转化 B 细胞中的EBV(因为其潜伏期),因此诱导 EBV 进入裂解期可能导致更有效的抗病毒治疗暴露,裂解期诱导剂包括甲基转移酶抑制剂、组蛋白去乙酰化酶抑制剂 (HDACi)、蛋白酶体抑制剂等。
EBV潜伏膜蛋白LMP2A是一种B细胞受体(BCR)模拟器,可以保护BCR耗尽的B细胞免于凋亡。该机制依赖于脾脏酪氨酸激酶和布鲁顿酪氨酸激酶(BTK)的激活,两种酪氨酸激酶都可增强EBV+ DLBCL的细胞增殖和存活信号。因此开展评估BTK抑制剂联合R-CHOP治疗EBV+ DLBCL,但初步效果不佳。
过继细胞疗法(ACT)与细胞毒性T淋巴细胞(CTL)有效且对正常组织无附带损伤。使用EBV特异性CTL的ACT治疗EBV相关移植后淋巴细胞增生性疾病(PTLD)的疗效已进行评估。输注EBV CTL对于接受移植的PTLD患者是有效的治疗和预防。鉴于制造CTL的时间可能很长(长达6-12周),可以通过快速选择过程(如四聚体选择或γ干扰素捕获)或通过新的培养方法从供者血液中选择病毒反应性细胞来加速CTL的制备(约3天)和可用性。为了提高免疫原性并扩增可能被CTL靶向的EBV抗原谱,使用腺病毒转导的树突状细胞和EBV转化的LCL作为抗原提呈细胞来激活和扩增LMP-1/2特异性T细胞。
Tabelecleucel是一种现成的异基因EBV特异性CTL,已在EBV+ PTLD、EBV+ PTLD伴中枢神经系统受累、EBV+平滑肌肉瘤和EBV病毒血症危及生命的并发症患者中显示出临床疗效,是治疗CAEBV和HLH的潜在疗法。
非靶向EBV的治疗
EBV+ DLBCL表现为后生发中心,ABC型DLBCL。ABC样DLBCL更频繁地表现出JAK-STAT和NF-κB通路的激活,因此对ABC型DLBCL有疗效的药物进行了试验。蛋白酶体抑制剂硼替佐米是NF-κB活化的抑制因子,可诱导EBV转化的B细胞凋亡。虽然在免疫化疗中加入硼替佐米并没有显示出总体获益,但根据REMoLD-B研究,ABC亚型患者的生存结局得到改善。来那度胺也可通过下调IRF4和NF-kB靶向ABC型DLBCL,早期临床数据显示ABC型DLBCL有较好活性。来那度胺联合R-CHOP治疗新诊断DLBCL的研究显示出令人鼓舞的结果。在ABC DLBCL细胞系中,PI3K激酶通路似乎对NF-kB的上游信号传导至关重要,因此抑制PI3K通路可能是具有ABC特征的EBV+ DLBCL的另一种途径。
未来方向
正在研究其他扩大CTL使用的新方法。去甲基化药物后EBV-CTL可作为EBV+淋巴瘤的一种新的治疗方法。白细胞介素7 (IL-7)信号传导对T细胞具有存活和抗凋亡作用,但IL-7在体内的可用性有限,IL-7受体在活化T细胞中下调。
免疫耐受和逃逸在EBV+淋巴增生性疾病的发病机制中起重要作用。PD-1是T细胞表面的一种信号分子,可抑制T细胞对肿瘤细胞的细胞毒性作用。PD-L1表达是侵袭性淋巴瘤预后不良的标志,大多数EBV+淋巴瘤显示高水平的PD-L1表达。慢性病毒感染(如EBV)也会导致T细胞衰竭,可以通过PD-1阻断来逆转。因此,靶向PD-L1/PD-1通路是EBV+ DLBCL的潜在治疗方法。
靶向肿瘤相关标志物(如CD19)的CAR-T细胞正在白血病和淋巴瘤的临床研究中,此外临床前证据表明LMP-1和gp350 CAR-T细胞治疗EBV+恶性肿瘤有效。鉴于CD30和CD38的高表达,维布妥昔单抗和达雷妥尤单抗也可能对EBV+ DLBCL有效,但相关报道治疗不高。此外,EBV预防疫苗的开发为预防由EBV感染引起的癌症提供了巨大的希望。
总结
EBV+ DLBCL-NOS是一种罕见但高度侵袭性的淋巴瘤亚型,在免疫化疗时代可能存在争议,但可能与不良预后相关。虽然EBV特别影响亚洲、拉丁美洲和东欧血统的患者,但目前的研究表明,EBV可以影响不同种族和民族背景的个体的预后。EBV+ DLBCL的发病率可能被低估,因为没有常规进行EBER检测,并且直到最近才定义了EBER阳性细胞百分比的截止值。更好地了解EBV病理生物学已经导致了对EBV+ DLBCL-NOS的理解,尽管迫切需要多机构的方法来更好地了解和改善这种罕见疾病的结局。
参考文献
Malpica L, Marques-Piubelli ML, Beltran BE, Chavez JC, Miranda RN, Castillo JJ. EBV-positive diffuse large B-cell lymphoma, not otherwise specified: 2024 update on the diagnosis, risk-stratification, and management.Am J Hematol. 2024;1‐14. doi:10.1002/ajh.27430


