奥希替尼对EGFR/BRAF共突变NSCLC有效,液体活检助力疗效监测
时间:2024-08-05 10:00:34 热度:37.1℃ 作者:网络
表皮生长因子受体(EGFR)和 B-Raf(BRAF)突变是非小细胞肺癌(NSCLC)中发现的两个最重要的驱动基因。本报告重点介绍了两例被诊断为转移性NSCLC的患者,在基线时同时存在EGFR和BRAF突变,并接受奥希替尼作为一线治疗。在初次诊断时对组织和血浆进行了分子检测,并基于前瞻性转化研究REM的设计,在 10 天、28 天和影像学进展时进行后续液体活检。这些病例表明,即使基线出现BRAF共突变,奥希替尼也可能对其有效。值得注意的是,影像学反应与液体活检观察结果一致:在这两种情况下,后续液体活检都表明EGFR突变的循环肿瘤DNA(ctDNA)得到清除。
背 景
在过去的二十年中,针对致癌基因成瘾疾病的靶向疗法改变了非小细胞肺癌(NSCLC)的治疗。致癌基因成瘾是一个术语,用于描述某些肿瘤对单一激活的致癌蛋白或通路的依赖,以维持恶性特性,并作为靶向治疗的理论基础。目前,已有多种靶向疗法获批用于治疗致癌基因依赖性肿瘤患者。EGFR和BRAF是两种最重要的驱动突变,分别占NSCLC病例的总体患病率的 32% 和 1%–3%。根据FLAURA试验的结果,第三代TKI奥希替尼成为EGFR突变转移性非小细胞肺癌(mNSCLC)的标准一线治疗药物。然而,临床获益的大小存在差异,而且最近证明新的组合治疗策略与无进展生存期的改善有关。虽然目前尚无可靠的预测标志物可用于临床实践,但已发现p53和PIK3CA等共突变的存在与有限的临床获益相关,尽管人们对BRAF共突变在这种特定情况下的作用知之甚少。有趣的是,BRAF突变已被描述为EGFR-TKI获得性耐药的可能机制。此外,尽管致癌基因驱动突变通常是互相排斥的,但两个可干预的驱动突变的存在意味着在治疗和管理的选择方面存在重大的临床挑战。
本文介绍了两例在基线时诊断为mNSCLC且同时携带EGFR和BRAF突变的患者。患者接受了奥希替尼一线治疗,诊断时对组织和血浆进行了肿瘤分子检测,并根据REM临床研究的时间表在不同时间点通过多次液体活检进行监测。REM是一项正在进行的多中心、前瞻性、观察性临床研究,其招募了接受一线奥希替尼治疗的EGFR突变NSCLC患者,旨在确定基线和进展时血浆中的同时发生的基因变异,并监测血浆中的EGFR突变并将其与影像学反应和结果相关联。在这种情况下,在开始治疗之前以及治疗后 10 天和 28 天采集血浆样本。使用了三种不同的检测来分析患者的cfDNA:RT-PCR技术以及两种包含EGFR突变和BRAF突变的NGS panel检测。研究设计和知情同意书已提交并获得当地伦理委员会的批准。
病例1
患者女,81 岁,从不吸烟。2023 年 2 月,患者出现呼吸困难,并接受了CT扫描,结果显示存在左下叶病变、多个胸膜同侧结节、胸腔积液和单个脑病变(良性脑膜瘤),这些病变在既往病史中已经报告过。通过CT引导下经皮针刺活检获得组织学样本,诊断结果符合肺腺癌。组织RT-PCR检测显示存在BRAF V600E突变和EGFR 19号外显子缺失(ex19del)。没有变异丰度数据,因此无法区分这些突变是克隆的还是亚克隆的。基线液体活检证实cfDNA中存在低水平的EGFR ex19del。相反,血浆中的两种NGS检测均未检测到BRAF V600E突变。患者临床状况良好(ECOG PS 0),除高血压得到控制外,无相关病史。考虑到临床分期、组织学诊断、无吸烟史和分子特征,患者开始接受奥希替尼治疗,并进行了密切的临床和影像学监测。随后根据临床实践进行影像学肿瘤评估,根据 RECIST v1.1标准,最佳影像学反应为疾病稳定。治疗耐受性良好,记录的唯一不良事件是G1血小板计数减少(根据CTCAE v5.0)。首先通过RT-PCR在不同时间点进行液体活检检测,结果显示EGFR突变的清除与临床治疗反应一致;事实上,从T1到T5的cfDNA样本未发现EGFR突变。通过NGS检测cfDNA样本,在T1(VAF,0.046%;4.22 MM)和 T2(VAF,0.029%;2.34 MM)样本中发现了微小分子残留,EGFR突变在治疗期间逐渐减少。事实上,在之后的时间点(T3-T4-T5),NGS检测表明血浆中的EGFR突变已完全清除。值得注意的是,在NGS分析的任何cfDNA样本中均未检测到在组织活检中发现的BRAF突变。12 个月后,患者仍在接受奥希替尼治疗,并且保持良好的临床和影像学反应。计划在病情进展时对组织和血浆进行进一步的血浆监测和重新表征。
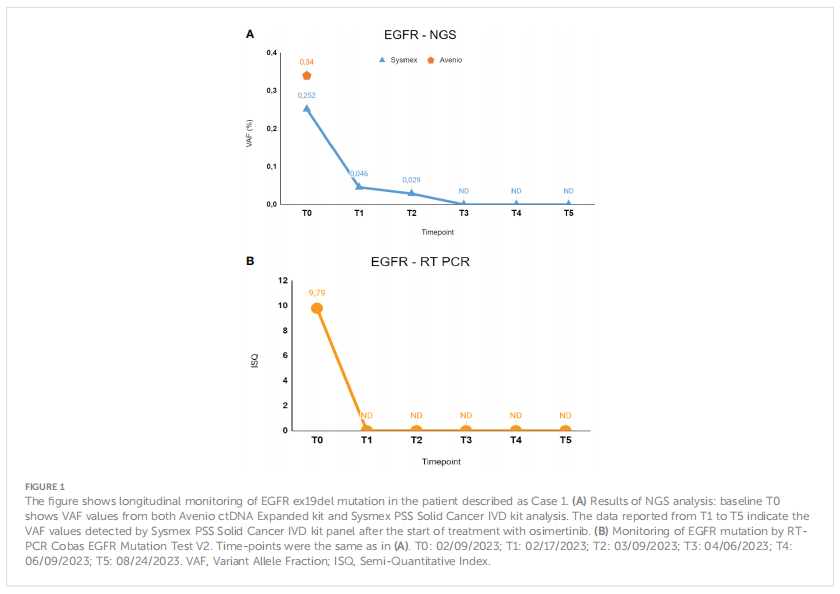
▲图1 病例1EGFR ex19del的动态监测
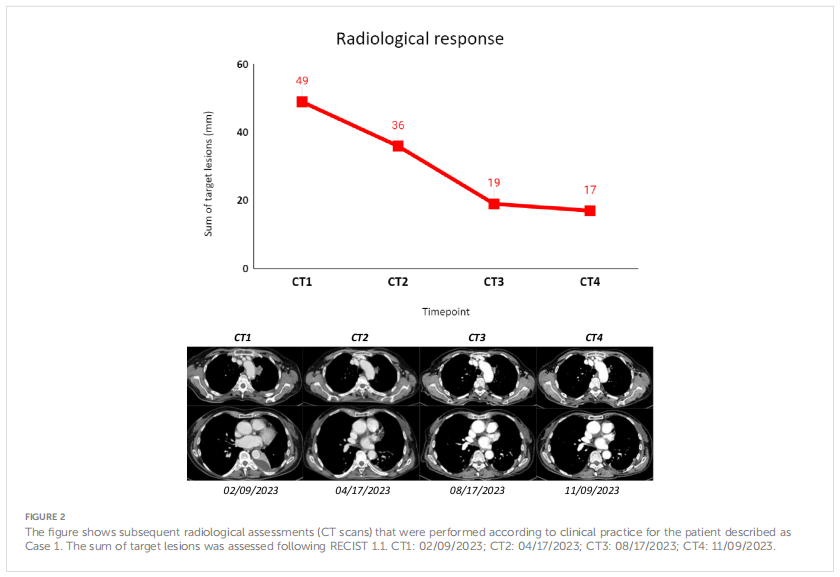
▲图2 病例1影像学评估结果
病例2
患者女,77 岁,白人。2022 年 7 月出现呼吸困难后,患者接受了CT扫描,结果显示双侧肺结节和左侧胸腔积液,接受了左胸腔穿刺术,并立即取得了临床获益。为明确诊断,对一个肺结节进行了CT引导下的穿刺活检,组织学诊断为肺腺癌,没有胸外疾病的证据。组织分子分析显示存在EGFR L858R和BRAF E501K突变,但没有可用的变异丰度信息。基线cfDNA的NGS检测证实了两种突变的存在。RT-PCR检测与NGS结果一致,提示存在EGFR L858R突变,ISQ= 5.99。EGFR和BRAF突变检测的VAF相似,分别为 0.35%和 0.31%,表明BRAF突变可能具有克隆性质。考虑到患者良好的体能状态、临床分期和疾病的分子表征,患者开始使用奥希替尼进行一线系统性治疗。随后在时间点T1和T2对液体活检进行EGFR RT-PCR检测,结果显示系统治疗开始 10 天后,EGFR突变就得到了清除。由于T1时可用的cfDNA数量不足,在T2时仅进行NGS监测,并确认EGFR突变清除。由于BRAF E501K突变未包含在T2时使用的panel,因此无法进行BRAF突变监测。第一次影像学评估显示,根据 RECIST v1.1标准,患者出现部分缓解,靶病灶减少 70%。截至撰写本文时,即诊断后 17 个月,患者仍在接受治疗,并保持影像学缓解和临床获益。
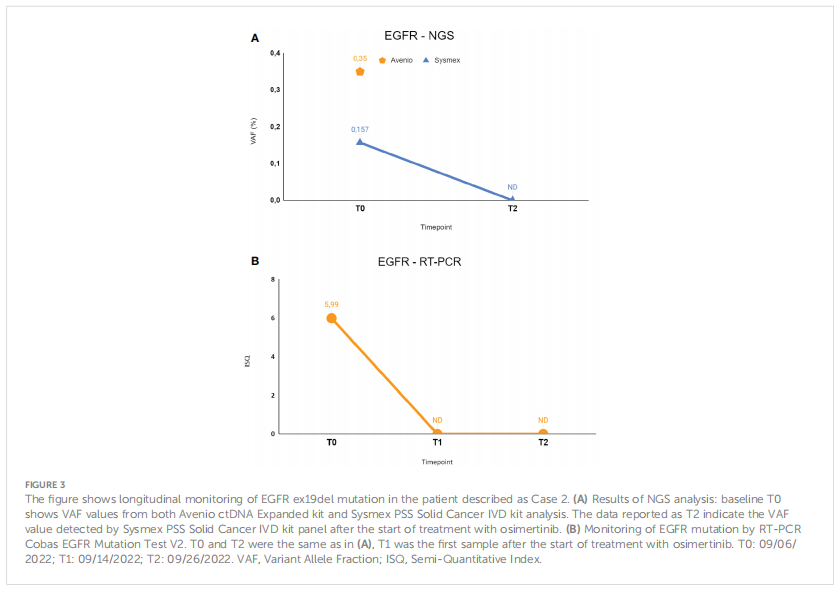
▲图3 病例2EGFR ex19del动态监测
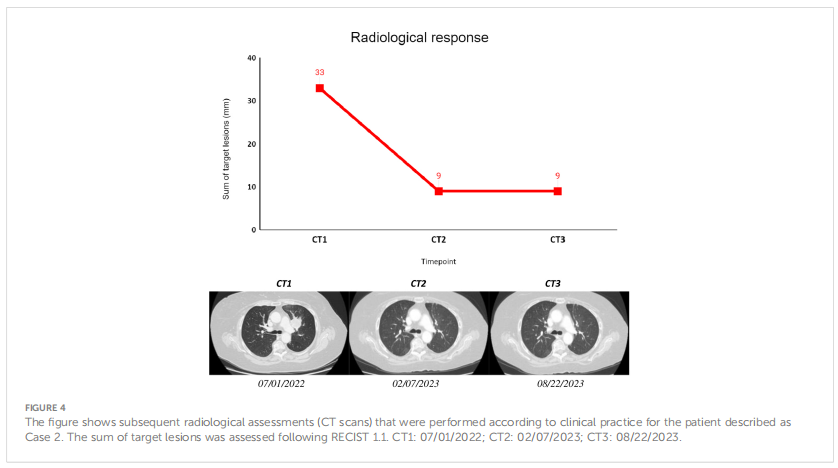
▲图4 病例2影像学评估结果
讨 论
这两个病例表明,奥希替尼即使在基线时存在BRAF共突变的患者中也可能保持其疗效。由于患者分别在治疗的第 12 个月和第 17 个月仍有持续的临床获益,且血浆中的EGFR突变得到清除,研究人员认为与其它共突变(特别是p53和KRAS)相比,携带BRAF共突变的患者可能代表了EGFR突变患者的不同分子亚群。
影像学反应伴随着液体活检结果:对于这两例病例,后续的液体活检均显示cfDNA中的EGFR突变被清除。奇怪的是,病例1的BRAF V600E仅在组织NGS检测中发现。这可能是因为患者仅表现为胸内疾病且ctDNA脱落有限。或者,考虑到EGFR突变在血浆中检测呈阳性且水平相对较低,研究人员推测BRAF V600E在该患者的肿瘤中是亚克隆的,因此,cfDNA检测未发现它,因为它低于所用NGS检测的检测限。这个病例清楚地说明了液体活检在揭示肿瘤异质性和区分两种驱动变异的生物学意义方面的潜力。
值得注意的是,病例2携带位于BRAF蛋白质激酶结构域的非V600突变。然而,这种突变目前尚无定论,因为描述BRAF E501K突变的生物学意义的数据相互矛盾和/或不足。体外研究表明,与对照组相比,这种突变可能会失活,表现为具有第二个BRAF突变的细胞系中的BRAF激酶活性降低。然而,另一项临床前研究发现与野生型相比,下游通路表达增加。尽管如此,仍需强调的是,在这种临床病例中,这种突变似乎不会对奥希替尼的疗效产生负面影响。
根据REM方案,研究人员还计划在疾病影像学进展时进行RT-PCR和NGS cfDNA检测,以进一步研究可能的获得性耐药机制。BRAF突变是否仍然存在是一个有趣的问题,因为在这种情况下已经描述了与抗EGFR和抗BRAF TKI的联合疗法。
这两个案例表明,液体活检在治疗期间监测患者方面可以发挥重要作用,表明分子反应与临床反应相关,可以在影像学评估之前进行评估。此外,特别是在共突变的情况下,还有待进一步收集数据,以了解其在揭示肿瘤异质性和伴随基因改变的不同作用方面的潜在作用。最后,研究人员得出结论,在这种情况下,对患者血浆进行分子检测具有临床有效性,并且可以在罕见的BRAF共同突变中帮助追踪EGFR TKI的影响。
参考文献:
Bao LC, Padovan A, Boscolo Bragadin A, Calvetti L, Guarneri V, Bonanno L and Indraccolo S (2024) Efficacy of osimertinib and the role of sequential liquid biopsy in patients diagnosed with NSCLC harboring EGFR and BRAF mutations at baseline: insights from two case reports. Front. Oncol. 14:1363069. doi: 10.3389/fonc.2024.1363069



